miR-182调控RECK信号通路在非小细胞肺癌进展中的作用
2015-06-28陈光朋付万垒杨坤富孙建国朱海振江飞龙彭丽娜陈正堂
陈光朋,付万垒,杨坤富,孙建国,朱海振,江飞龙,彭丽娜,陈正堂
miR-182调控RECK信号通路在非小细胞肺癌进展中的作用
陈光朋,付万垒,杨坤富,孙建国,朱海振,江飞龙,彭丽娜,陈正堂
目的 探讨miR-182在非小细胞肺癌(NSCLC)发展中的作用及其相关机制。方法 采用实时定量PCR检测NSCLC细胞系以及30组配对的NSCLC患者癌组织和癌旁组织样本中miR-182的表达水平。在NSCLC细胞株A549和H1299中过表达miR-182后,测定细胞增殖活性及侵袭转移能力。利用荧光素酶活性实验鉴定miR-182的预测靶基因(RECK)。采用qRT-PCR和Western blotting分别检测转染miR-182类似物和miR-182抑制物后RECK mRNA和蛋白的表达水平。结果 miR-182在NSCLC细胞系和癌组织中的表达水平明显高于癌旁组织,在伴淋巴结转移的肺癌患者癌组织中的表达水平明显高于不伴淋巴结转移者,差异有统计学意义(P<0.01)。过表达miR-182可增强NSCLC细胞株A549 和H1299的增殖、侵袭和迁移能力。双荧光素酶实验结果表明,RECK的翻译水平受miR-182直接调控。qRT-PCR和Western blotting 检测结果表明,转染miR-182类似物后,RECK表达水平降低,转染miR-182抑制物后,RECK表达水平升高。结论 miR-182可调控RECK的表达,促进NSCLC的进展。
癌,非小细胞肺;微RNAs;基因,RECK
非小细胞肺癌(NSCLC)包括腺癌和鳞癌。在世界范围内,肺癌为恶性肿瘤死亡的首要原因,而NSCLC占所有确诊肺癌的80%~85%[1]。尽管肺癌的临床诊断和治疗技术不断发展[2-5],但确诊为NSCLC患者的5年总生存率(约11%)在过去10年中并未得到实质性提高[6]。因此,深入理解NSCLC发生发展的机制,对NSCLC的诊断和治疗具有重要的临床意义。
MicroRNAs (miRNAs)是近年来新发现的一类内源性非编码RNA分子,长20~25个核苷酸,通过与靶mRNAs 3'非翻译区互补结合,诱导靶mRNA降解或抑制靶mRNA翻译,从而实现转录后基因的表达调控作用[7]。miRNAs在发育、分化、细胞增殖及凋亡、代谢等过程中发挥重要的调节作用[8]。研究表明,miRNAs 作为一类新的癌基因或抑癌基因,其表达失衡与多种肿瘤的发生密切相关,如乳腺癌[9]、肝癌[10]、结肠癌[11]、肺癌等[12]。近年来,miRNAs与NSCLC的关系越来越受关注,已证实miR-128[13]、miR-195[14]、miR-483[15]、miR-451[16]、miR-630[17]等参与了NSCLC的发生、发展过程。新近研究发现,miR-182在NSCLC中的表达显著上调[18],提示其作为一种OncomiR可能参与了NSCLC的发生发展,但其具体分子生物学机制尚未阐明。
本研究旨在明确miR-182在NSCLC患者癌组织和癌旁组织中表达的差异,探讨过表达miR-182能否促进NSCLC细胞系的增殖、侵袭及转移,并通过生物信息学预测和靶基因鉴定实验,探讨miR-182 在NSCLC中与抑癌基因RECK表达的相关性及其在肿瘤发生发展中的作用。
1 资料与方法
1.1 研究对象及材料 选择2014年度在第三军医大学新桥医院接受NSCLC切除手术的30例患者,年龄50~70岁,均经病理诊断确认,其临床资料见表1。在病理医师的指导下,切除适量NSCLC组织以及邻近的癌旁正常肺组织(距离癌组织5cm以上)。手术切除的新鲜标本立即置于液氮中冷冻保存。患者均签署知情同意书。本实验已通过第三军医大学伦理委员会批准。人胚肾细胞HEK293,人NSCLC细胞系A549、H1299、PC9、NCI-H460以及人胎儿肺成纤维细胞系MCR-5均购自中国上海细胞研究所。miR-182对照质粒(miR-NC)、miR-182类似物(miR-182 mimics)和miR-182抑制物(miR-182 inhibitor)购自广州锐博生物技术公司。HEK293和MCR-5细胞用含10%胎牛血清的DMEM/H(Hyclone)培养基培养,A549、H1299、PC9和NCI-H460细胞用含10%胎牛血清的RPMI 1640(Hyclone)培养基,均在37℃、5% CO2条件下培养。
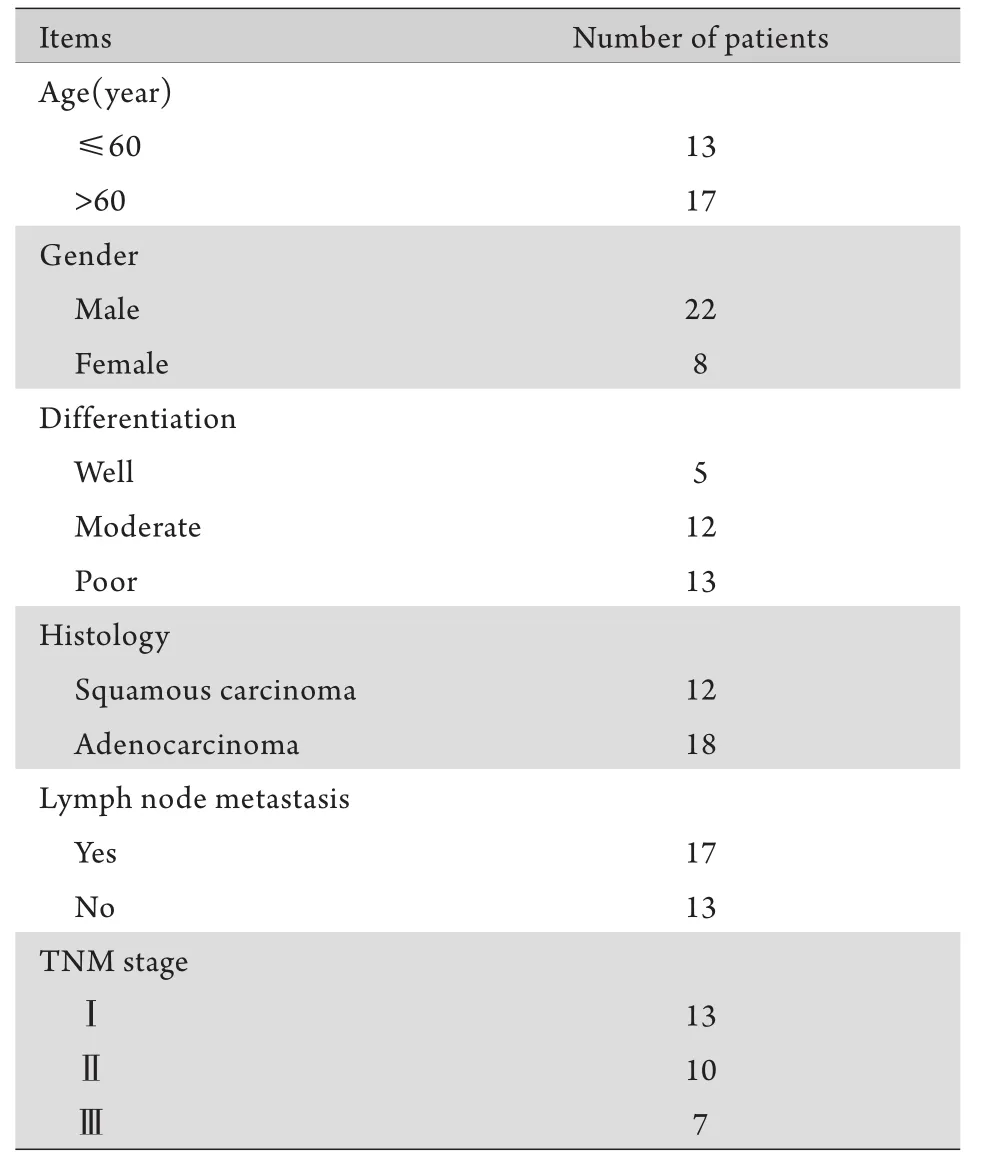
表1 30例NSCLC患者的临床资料Tab.1 Clinical data of 30 patients with NSCLC
1.2 miR-182在NSCLC细胞系及组织中的表达检测及其与NSCLC临床病理转移的关系 首先通过在线数据库(http://mirnamap.mbc.nctu.edu.tw/)分析筛选目的基因为miR-182,并进一步在肺癌细胞系和肺癌患者的肺癌组织中进行验证。取NSCLC细胞系(A549、H1299、PC9、NCI-H460)和人胎儿肺成纤维细胞系(MCR-5),行RNA提取,定量PCR检测miR-182的表达水平。进一步检测30例NSCLC患者癌组织及癌旁正常组织miR-182的表达水平,并结合患者的临床资料(表1)对有无淋巴结转移患者miR-182的表达水平进行比较。
1.3 miR-182的过表达及鉴定 在NSCLC细胞系A549、H1299细胞中分别转染miR-NC(阴性对照)和miR-182类似物,采用qRT-PCR检测miR-182 mRNA的表达水平。
1.4 miR-182过表达对NSCLC细胞系增殖、侵袭、迁移的影响 在NSCLC细胞系A549、H1299细胞中分别转染miR-NC和miR-182类似物,于转染后24、48、72h检测细胞的增殖活性[采用CCK-8试剂盒检测570nm波长处吸光度(A570)值]。采用Transwell方法ECM550系列和ECM220系列分别检测穿过细胞滤膜的细胞数以反映细胞的侵袭、迁移能力的变化。
1.5 miR-182靶基因RECK的鉴定 采用生物信息学软件(Targetscan)预测miR-182对应的靶基因,同时构建其3'UTR以及突变3'UTR的荧光报告载体,转染HEK293细胞后,通过双荧光素酶报告基因实验进行鉴定。
1.6 miR-182过表达对RECK表达的调控作用 在A549、H1299细胞中转染miR-NC、miR-182类似物和miR-182抑制物,采用qRT-PCR法和Western blotting法分别检测RECK及 RECK下游靶基因MMP9 mRNA和蛋白的表达变化。
1.7 实验技术
1.7.1 总RNA提取 从液氮中取出NSCLC癌组织及相应癌旁组织标本,置于DEPC处理过的预冷的匀浆器中,以100mg/ml比例加入Trizol试剂(Life Technology公司)匀浆,按Trizol试剂操作说明提取组织总RNA,溶于25μl DEPC中,分装冻存于–80℃备用。
1.7.2 实时定量聚合酶链反应(qRT-PCR) 参照TaqMan microRNA Reverse Transcription Kit操作说明,加入反转录反应所需试剂、miR-182 RT primer(广州锐博公司)和总RNA进行反应。反转录条件:42℃ 15min,85℃ 5s。以合成的cDNA作为模板进行qRT-PCR扩增,根据Premix ExTaq试剂盒说明加入premix、miR-182正向引物和miR-182反向引物进行反应。qRT-PCR反应条件:95℃ 1min;95℃ 5s,58℃ 5s,72℃ 20s,共47个循环;72℃20s,采集荧光。采用20μl反应体系,以U6作为内参照。采用2–ΔΔCt法对目的基因在癌组织及癌旁组织中的表达量进行相对定量分析。
1.7.3 RECK 3'UTR荧光报告载体的构建及荧光素酶活性检测 首先合成野生型RECK-3'UTR以及突变的RECK 3'UTR(上海生工)寡核苷酸,经退火、双酶切后插入荧光素酶报告基因载体pMIRREPORT。接种HEK293细胞于96孔板,24h后细胞贴壁达50%时进行转染。
将miR-182类似物及阴性对照miR-NC与构建好的RECK 3'UTR荧光素酶报告基因及质粒pRL-TK共转染HEK293细胞,按脂质体2000说明进行转染。转染后24h用双荧光素酶报告基因检测系统处理并裂解细胞,用GloMax20/20 Luminometer检测荧光强度。
1.7.4 Western blotting检测方法 用细胞裂解缓冲液裂解细胞,12 000r/min离心15min,收集上清并进行蛋白浓度测定(BCA法)。取20μg蛋白经10%SDSPAGE胶分离后,湿转至PVDF膜,根据marker标示切下RECK、MMP-9和GAPDH条带区域,5%脱脂奶粉封闭,分别用抗-RECK(1:500稀释)、抗-MMP9(1:500稀释)及抗-GAPDH(1:5000稀释)的一抗孵育过夜,再与辣根过氧化物酶标记山羊抗小鼠IgG孵育1h,用Supersignal West Dura Extended Duration Substrate Reagent处理并曝光显色。
1.8 统计学处理 采用SPSS 17.0软件进行统计分析。计量数据呈正态分布,以±s表示,两组方差齐,采用配对t检验进行组间比较。P<0.05为差异有统计学意义。
2 结 果
2.1 肺癌患者miR-182表达情况 在线数据库(http://mirnamap.mbc.nctu.edu.tw/)显示miR-182 在NSCLC肺癌组织中的表达高于正常肺组织(图1A、B)。在细胞系中的验证结果显示:miR-182在A549、H1299、PC9和NCI-H460四种肺癌细胞系中的表达明显高于胎儿肺成纤维细胞系MCR-5(图1C)。在30例患者的肺癌组织及癌旁组织中的验证结果显示,肺癌组织中miR-182的表达高于对应的癌旁组织(P=0.0008,图1D),其中有淋巴结转移的患者(n=17)癌组织中miR-182的表达明显高于无淋巴结转移者(n=13,P=0.003 24,图1E)。
2.2 miR-182过表达的鉴定结果 qRT-PCR检测结果显示,与转染miR-NC相比(A549 1.013,H1299 1.024),转染miR-182类似物(A549 1.893,H1299 2.033)能明显提高miR-182 mRNA在A549和H1299细胞中的表达。
2.3 miR-182过表达对NSCLC细胞系增殖、侵袭和迁移能力的影响 MTT检测结果显示,转染miR-182后,A549和H1299细胞的A570值在48和72h时间点均明显高于转染miR-NC的细胞(A549:P=0.038,P=0.007;H1299:P=0.042,P=0.008;图2A、B)。细胞侵袭和迁移实验显示,与转染miR-NC的细胞相比,转染miR-182的细胞侵袭和迁移到Transwell小室的数目明显增多(图2C、D)。
2.4 miR-182靶基因RECK的鉴定 Targetscan软件预测miR-182对应的靶基因为RECK,构建其3'UTR以及突变3'UTR的荧光报告载体(图3A)。将构建的载体miR-NC(对照)、miR-182、RECK 3'UTR-WT 和RECK 3'UTR-mutant分别转染HE293细胞,荧光素酶活性实验结果显示,共转染miR-182和RECK 3'UTR-WT 组的荧光强度明显低于共转染miR-NC 和RECK 3'UTR-WT组(P<0.05),表明miR-182对pMIR-RECK 3'UTR表达有抑制作用,且是通过miR-182与pMIR-RECK 3'UTR区结合实现的,提示RECK 是miR-182的靶基因(图3B)。
2.5 miR-182对RECK表达的抑制作用 qRT-PCR结果显示,与miR-NC组相比,miR-182类似物组RECK mRNA表达水平明显降低(P<0.01,图4A),miR-182抑制物组RECK mRNA表达水平明显升高(P<0.01,图4A);Western blotting结果显示,RECK蛋白的表达也呈现同样的趋势(图4B)。此外,与miR-NC组相比,MMP-9水平在miR-182类似物转染组明显升高,在miR-182抑制物转染组明显降低(图4B)。
3 讨 论
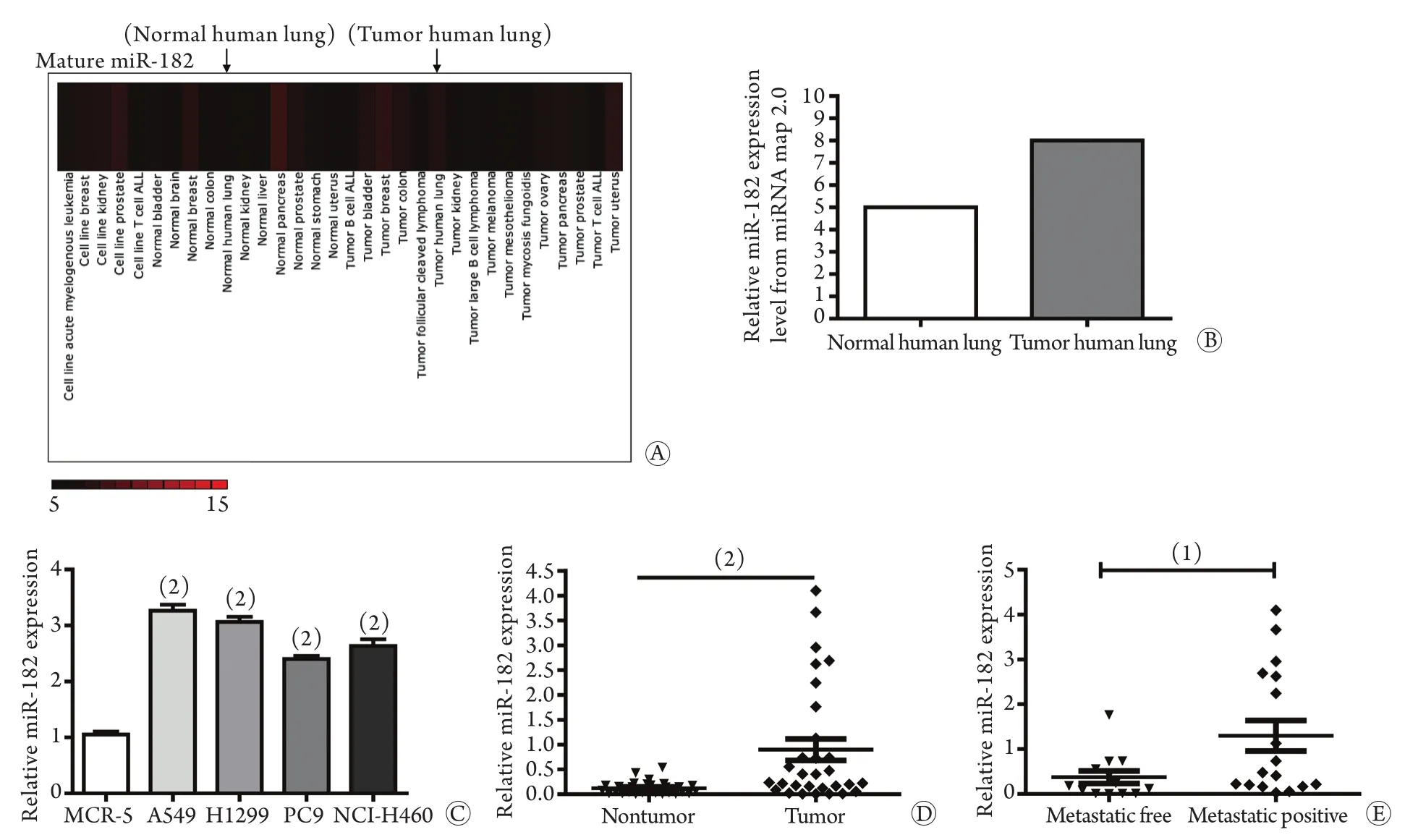
图1 miR-182在NSCLC细胞系及组织中的表达水平比较Fig.1 Comparison of miR-182 expression in NSCLC cells and tissues

图2 过表达miR-182对NSCLC细胞增殖、侵袭和迁移能力的影响Fig.2 Enhancement of proliferation, invasion and migration of NSCLC cell lines by over-expression of miR-182
本研究检测了NSCLC细胞系以及30例NSCLC患者的肺癌组织和癌旁正常组织中miR-182的表达水平,结果显示miR-182在NSCLC细胞系中的表达水平明显高于胎儿肺成纤维细胞系MCR-5,同时其在NSCLC患者肺癌组织的表达水平明显高于其对应的癌旁正常组织,更重要的是在存在淋巴结转移的患者中miR-182的表达明显高于无淋巴结转移的患者。体外实验中,本研究发现miR-182的过表达能显著增强NSCLC细胞系的增殖、侵袭及迁移能力。本研究进一步利用生物信息学预测miR-182的靶基因为RECK,并通过荧光素酶活性实验证实miR-182可直接靶向调节RECK 3'UTR区,转染miR-182类似物能明显抑制A549细胞中RECK mRNA和蛋白表达。因此,本研究证实了RECK是miR-182的靶基因,为NSCLC发生发展机制研究提供了新的线索。

图3 miR-182靶基因RECK的鉴定Fig. 3 Identification of RECK as one of miR-182 targeted genes
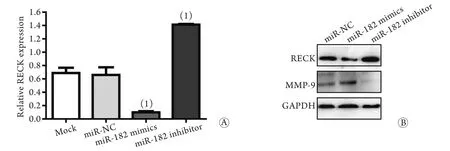
图4 qRT-PCR 和Western blotting检测RECK mRNA和蛋白的表达情况Fig.4 Expressions of RECK mRNA and protein determined by qRT-PCR and Western blotting
越来越多的研究报道miR-182与多种肿瘤发展进程相关,包括乳腺癌[19]、胃癌[20]、结直肠癌[21]、肾癌[22]、前列腺癌[23]、卵巢癌等[24]。既往报道,在乳腺癌中miR-182能通过抑制MIM基因的表达而激活RhoA,促进乳腺癌转移[25]。然而miR-182在NSCLC发生发展中的作用及其机制并不清楚。本研究结果显示miR-182在NSCLC患者癌组织中的表达水平明显高于对应的癌旁正常组织,更重要的是过表达miR-182能明显促进NSCLC细胞的增殖、侵袭及转移能力,提示miR-182可促进NSCLC的发生发展。因此,降低miR-182的表达可能抑制NSCLC的增殖、侵袭和转移。
RECK蛋白是基质金属蛋白酶(MMPs)的一种重要的抑制剂[26],既往研究表明RECK在NSCLC癌组织中的表达水平明显低于其对应的癌旁正常组织[27]。MMPs在肿瘤的侵袭和转移中发挥着重要作用,已有文献报道MMP-9在NSCLC的组织和血清中显著升高,并与肿瘤的分级和不良预后相关[28]。这些研究表明RECK-MMP-9信号通路在NSCLC的发生发展中具有重要意义。本研究利用荧光素酶活性实验确认了RECK是miR-182的靶基因,并明确了miR-182和RECK的调控关系,为阐明NSCLC的发生机制提供了新的线索。
【参考文献】
[1]Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2]Zhang H, Shao GG, Yan X, et al. Influence of visceral pleural invasion on prognosis of patients with early non-small cell lung cancer after operation[J]. J Jilin Univ (Med Ed), 2014, 40(2): 369-373. [张慧, 邵国光, 闫旭, 等. 脏层胸膜浸润对术后早期非小细胞肺癌患者预后的影响[J]. 吉林大学学报(医学版), 2014, 40(2): 369-373.]
[3]Li WB, Gao DW, Lu WN, et al. Analysis of complications and outcomes after pulmonary resection in patients aged 80 years or over with non-small cell lung cancer[J]. Med J Chin PLA, 2014, 39(10): 823-825. [李文兵, 高德伟, 卢文宁, 等. 80岁以上老年非小细胞肺癌切除术后并发症及预后分析[J]. 解放军医学杂志, 2014, 39(10): 823-825.]
[4]Wang L, Li XD, Zhang ZC, et al. The significance of thin-section CT in quality assurance and control of non-small cell lung cancer therapy through125I seed implantation[J]. Tianjin Med J, 2014, 42(4): 341-344. [王琳, 李小东, 张遵城, 等. 薄层CT对125I粒子植入治疗非小细胞肺癌的质量控制和保证的意义[J]. 天津医药, 2014, 42(4): 341-344.]
[5]Zhang LL, Wang L, Chen Z, et al. Efficacy analysis of two drugs consisting platinum combined with first-line chemotherapeutics regimens on 117 elderly patients with advanced non-small cell lung carcinoma[J]. Med J Chin PLA, 2013, 38(8): 644-648. [张黎黎, 王莉, 陈卓, 等. 一线含铂两药化疗方案治疗117例老年晚期非小细胞肺癌的疗效分析[J]. 解放军医学杂志, 2013, 38(8): 644-648.]
[6]Verdecchia A, Francisci S, Brenner H, et al. Recent cancer survival in Europe: a 2000-02 period analysis of EUROCARE-4 data[J]. Lancet Oncol, 2007, 8(9): 784-796.
[7]Farazi TA, Spitzer JI, Morozov P, et al. miRNAs in human cancer[J]. J Pathol, 2011, 223(2): 102-115.
[8]Lujambio A, Lowe SW. The microcosmos of cancer[J]. Nature, 2012, 482(7385): 347-355.
[9]Zhang W, Liu J, Wang G. The role of microRNAs in human breast cancer progression[J]. Tumour Biol, 2014, 35(7): 6235-6244.
[10] Callegari E, Gramantieri L, Domenicali M, et al. MicroRNAs in liver cancer: a model for investigating pathogenesis and novel therapeutic approaches[J]. Cell Death Differ, 2015, 22(1): 46-57.
[11] Zhou JJ, Zheng S, Sun LF. MicroRNA regulation network in colorectal cancer metastasis[J]. World J Biol Chem, 2014, 5(3): 301-307.
[12] Joshi P, Middleton J, Jeon YJ, et al. MicroRNAs in lung cancer[J]. World J Methodol, 2014, 4(2): 59-72.
[13] Hu J, Cheng Y, Li Y, et al. microRNA-128 plays a critical role in human non-small cell lung cancer tumourigenesis, angiogenesis and lymphangiogenesis by directly targeting vascular endothelial growth factor-C[J]. Eur J Cancer, 2014, 50(13): 2336-2350.
[14] Yongchun Z, Linwei T, Xicai W, et al. MicroRNA-195 inhibits non-small cell lung cancer cell proliferation, migration and invasion by targeting MYB[J]. Cancer Lett, 2014, 347(1): 65-74.
[15] Song Q, Xu Y, Yang C, et al. miR-483-5p promotes invasion and metastasis of lung adenocarcinoma by targeting RhoGDI1 and ALCAM[J]. Cancer Res, 2014, 74(11): 3031-3042.
[16] Chen D, Huang J, Zhang K, et al. MicroRNA-451 induces epithelial-mesenchymal transition in docetaxel-resistant lung adenocarcinoma cells by targeting proto-oncogene c-Myc[J]. Eur J Cancer,2014, 50(17): 3050-3067.
[17] Cao JX, Lu Y, Qi JJ, et al. MiR-630 inhibits proliferation by targeting CDC7 kinase, but maintains the apoptotic balance by targeting multiple modulators in human lung cancer A549 cells[J]. Cell Death Dis, 2014, 5: e1426.
[18] Zhang QH, Sun HM, Zheng RZ, et al. Meta-analysis of microRNA-183 family expression in human cancer studies comparing cancer tissues with noncancerous tissues[J]. Gene, 2013, 527(1): 26-32.
[19] Li P, Sheng C, Huang L, et al. MiR-183/-96/-182 cluster is upregulated in most breast cancers and increases cell proliferation and migration[J]. Breast Cancer Res, 2014, 16(6): 473.
[20] Kong WQ, Bai R, Liu T, et al. MicroRNA-182 targets cAMP-responsive element-binding protein 1 and suppresses cell growth in human gastric adenocarcinoma[J]. FEBS J, 2012, 279(7): 1252-1260.
[21] Wang S, Yang MH, Wang XY, et al. Increased expression of miRNA-182 in colorectal carcinoma: an independent and tissuespecific prognostic factor[J]. Int J Clin Exp Pathol, 2014, 7(6): 3498-3503.
[22] Xu X, Wu J, Li S, et al. Downregulation of microRNA-182-5p contributes to renal cell carcinoma proliferation via activating the AKT/FOXO3a signaling pathway[J]. Mol Cancer, 2014, 13: 109.
[23] Hirata H, Ueno K, Shahryari V, et al. MicroRNA-182-5p promotes cell invasion and proliferation by down regulating FOXF2, RECK and MTSS1 genes in human prostate cancer[J]. PLoS One, 2013, 8(1): e55502.
[24] Liu Z, Liu J, Segura MF, et al. MiR-182 overexpression in tumourigenesis of high-grade serous ovarian carcinoma[J]. J Pathol, 2012, 228(2): 204-215.
[25] Lei R, Tang J, Zhuang X, et al. Suppression of MIM by microRNA-182 activates RhoA and promotes breast cancer metastasis[J]. Oncogene, 2014, 33(10): 1287-1296.
[26] Alexius-Lindgren M, Andersson E, Lindstedt I, et al. The RECK gene and biological malignancy--its significance in angiogenesis and inhibition of matrix metalloproteinases[J]. Anticancer Res, 2014, 34(8): 3867-3873.
[27] Pesta M, Kulda V, Topolcan O, et al. Significance of methylation status and the expression of RECK mRNA in lung tissue of patients with NSCLC[J]. Anticancer Res, 2009, 29(11): 4535-4539.
[28] Pei J, Lou Y, Zhong R, et al. MMP9 activation triggered by epidermal growth factor induced FoxO1 nuclear exclusion in non-small cell lung cancer[J]. Tumour Biol, 2014, 35(7): 6673-6678.
Effect of miR-182 in non small cell lung cancer via regulating the RECK signaling pathway
CHEN Guang-peng1, FU Wan-lei2, YANG Kun-fu3, SUN Jian-guo1, ZHU Hai-zhen4, JIANG Fei-long1, PENG Li-na1, CHEN Zheng-tang1*1Institute of Cancer,2Department of Pathology,3Department of Thoracic Surgery, Xinqiao Hospital, Third Military Medical University, Chongqing 400037, China
4Department of Oncology, Guizhou Provincial People's Hospital, Guiyang 550002, China
*
, E-mail: czt05@163.com
This work was supported by the Key Project of Science and Technology Committee of Chongqing (CSTC2011AB5032)
ObjectiveTo explore the effect of miR-182 in non small cell lung cancer (NSCLC) and its mechanism.MethodsThe expression level and difference of miR-182 were detected by qRT-PCR in NSCLC cell line and matched tissues of 30 patients suffering from NSCLC. Cell proliferation, invasion and metastasis of A549 and H1299 via miR-182 was detected by miR-182 mimics. The predicted target gene (RECK) of miR-182 was identified via luciferase activation assay. The mRNA or protein expression of RECK after miR-182 mimic or inhibitor transfection was detected by qRT-PCR or Western blotting, respectively.ResultsExpression of miR-182 was significantly increased in NSCLC tissues and cell lines compared with that in the adjacent tissues (P<0.01), and it was correlated with the metastasis of NSCLC. The cell proliferation, invasion, and migration capacity was increased after miR-182 mimics transfection. Dual luciferase assay showed that miR-182 directly regulated the RECK translation level. RECK expression level was decreased after miR-182 mimics transfection in the A549 cells, while increased after miR-182 inhibitor transfection.ConclusionmiR-182 promoted tumor growth and metastasis of NSCLC by down-regulating the RECK expression.
carcinoma, non-small-cell lung; microRNAs; genes, RECK
R730.26
A
0577-7402(2015)04-0309-06
10.11855/j.issn.0577-7402.2015.04.11
2014-12-21;
2015-03-20)
(责任编辑:沈宁)
重庆市科委重点攻关课题(CSTC2011AB5032)
陈光朋,硕士研究生。主要从事肺癌发病机制及临床治疗方面的研究
400037 重庆 第三军医大学新桥医院肿瘤研究所(陈光朋、孙建国、江飞龙、彭丽娜、陈正堂),病理科(付万垒),胸外科(杨坤富);550002 贵阳 贵州省人民医院肿瘤科(朱海振)
陈正堂,E-mail:czt05@163.com
