营养治疗对酒精性肝病疗效的荟萃分析
2015-06-28别彩群吴胜兰汤绍辉
别彩群,吴胜兰,汤绍辉
营养治疗对酒精性肝病疗效的荟萃分析
别彩群,吴胜兰,汤绍辉
目的评价营养治疗对酒精性肝病(ALD)的疗效。方法检索PubMed、Embase、Web of Science、The Cochrane Central Register of Controlled Trials、中国期刊全文数据库、中国科技期刊数据库(维普)、万方数字化期刊全文数据库等从建库到2014年11月有关营养治疗对ALD疗效的临床随机对照试验(RCTs),采用RevMan 5.1.0软件对入选试验进行Meta分析。结果共12项RCTs 508例ALD患者符合入选标准。Meta分析结果显示,与对照组相比,营养治疗可以更有效地降低ALD患者血清总胆红素(P=0.04)及碱性磷酸酶(P=0.04)水平,提高血清转铁蛋白水平(P<0.00001),但在其他肝功能指标及ALD并发症等方面两种治疗方法的差异无统计学意义(P>0.05);营养治疗组短期及长期死亡发生率、感染发生率与对照组相比差异亦无统计学意义(P>0.05)。结论营养治疗可明显改善ALD患者血清总胆红素、碱性磷酸酶、转铁蛋白等部分肝功能指标,有望提高患者生存质量,但不能改善短期或长期生存率、其他肝功能及ALD并发症等指标,可以作为ALD患者的常规治疗方法。
肝炎,酒精性;营养疗法;随机对照试验;Meta分析
酒精性肝病(alcoholic liver diseases,ALD)是长期大量饮酒导致的一种肝脏损伤性疾病,是西方国家慢性肝病的主要病种[1-2],死亡率较高。目前ALD在我国的发病率逐年升高,已经成为继病毒性肝炎之后导致肝损害的第二大原因[3]。1984 年Mendenhall等[4]对284例中、重度ALD患者进行研究,结果显示几乎所有患者均存在不同程度的蛋白质能量营养不良(protein-energy malnutrition,PEM)。1993年Sehenker等[5]研究认为PEM可以影响机体整个免疫系统,降低对感染的应答能力,加重酒精毒性。而早在1980年,Nasrallah等[6]就进行了一项随机对照研究,结果显示营养治疗可改善ALD患者的生存率,降低血清总胆红素浓度并提高血浆白蛋白浓度;但随后Kearns等[7]的研究则显示营养治疗虽然可以降低ALD住院患者血清胆红素浓度并改善肝功能,但不能改善短期生存率。本文采用循证医学方法,分析营养治疗对ALD的疗效,旨在为临床决策提供参考。
1 资料与方法
1.1 文献获取 采用主题词及自由词联合检索策略,检索PubMed、Cochrane Library、Web of Science(1990-2014.11)、Embase、中国学术期刊全文数据库CNKI(1994-2014.11)、万方数据库(1990-2014.11)、中文科技期刊数据库VIP(1989-2014.11)、中国生物医学文献数据库CBMdisc(1978-2014.11)。中文检索词包括:酒精性肝病、酒精性肝炎、酒精性脂肪肝、酒精性肝硬化、营养治疗、营养支持、营养供给。英文检索词包括alcoholic liver diseases;alcoholic hepatitis;alcoholic steatohepatitis;alcoholic cirrhosis;nutrition therapy;nutrition support;nutrition supplementation。为避免漏查,对检索文献中的参考文献进行补充检索。
1.2 文献的纳入与排除标准 纳入标准:①研究类型。营养治疗ALD的临床随机对照试验(randomized controlled trial,RCTs)。②研究对象。ALD患者,不包括其他类型肝炎或合并肝癌患者。③干预措施。对照组给予ALD的常规对症支持治疗,营养治疗组在对照组的基础上加上营养治疗。④结局指标。肝功能指标,ALD并发症,平均住院日,死亡发生率,感染发生率。排除标准:①非随机对照试验;②未提供患者结局或测量方法的试验;③摘要;④综述;⑤重复报告。
1.3 数据提取及文献质量评价 由2名评价员独立进行计算机检索、选择试验并提取资料,不同意见通过讨论并征求第三者意见解决。文献的质量评价由2位评价员独立进行,主要根据Jadad评分标准(总分为5分,3分及以上为高质量研究),从随机方法、盲法以及随访三个方面对随机对照试验的方法学进行质量评价。
1.4 统计学处理 采用Cochrane 协作网提供的RevMan5.1.0 版软件进行数据统计分析。若研究间无统计学异质性,采用固定效应模型合并;若存在异质性则采用随机效应模型合并,然后再对异质性原因作进一步分析。处理效应量用相对危险度(risk ratio,RR)或均数差值(mean difference,MD)和95%可信区间(95% confidence interval,95%CI)表示,P<0.05为差异有统计学意义。
2 结 果
2.1 资料收集与研究类型 共检索到国内外相关文献2259篇,阅读文献题目、摘要以及全文后,共12个随机对照试验[6-17]入选本研究,文献搜集树状图见图1。
2.2 各纳入研究的一般情况 共508例ALD患者入选本研究,其中营养治疗组254例,对照组254例,两组患者基础资料比较差异无统计学意义。纳入文献的基本特征及干预措施见表1。
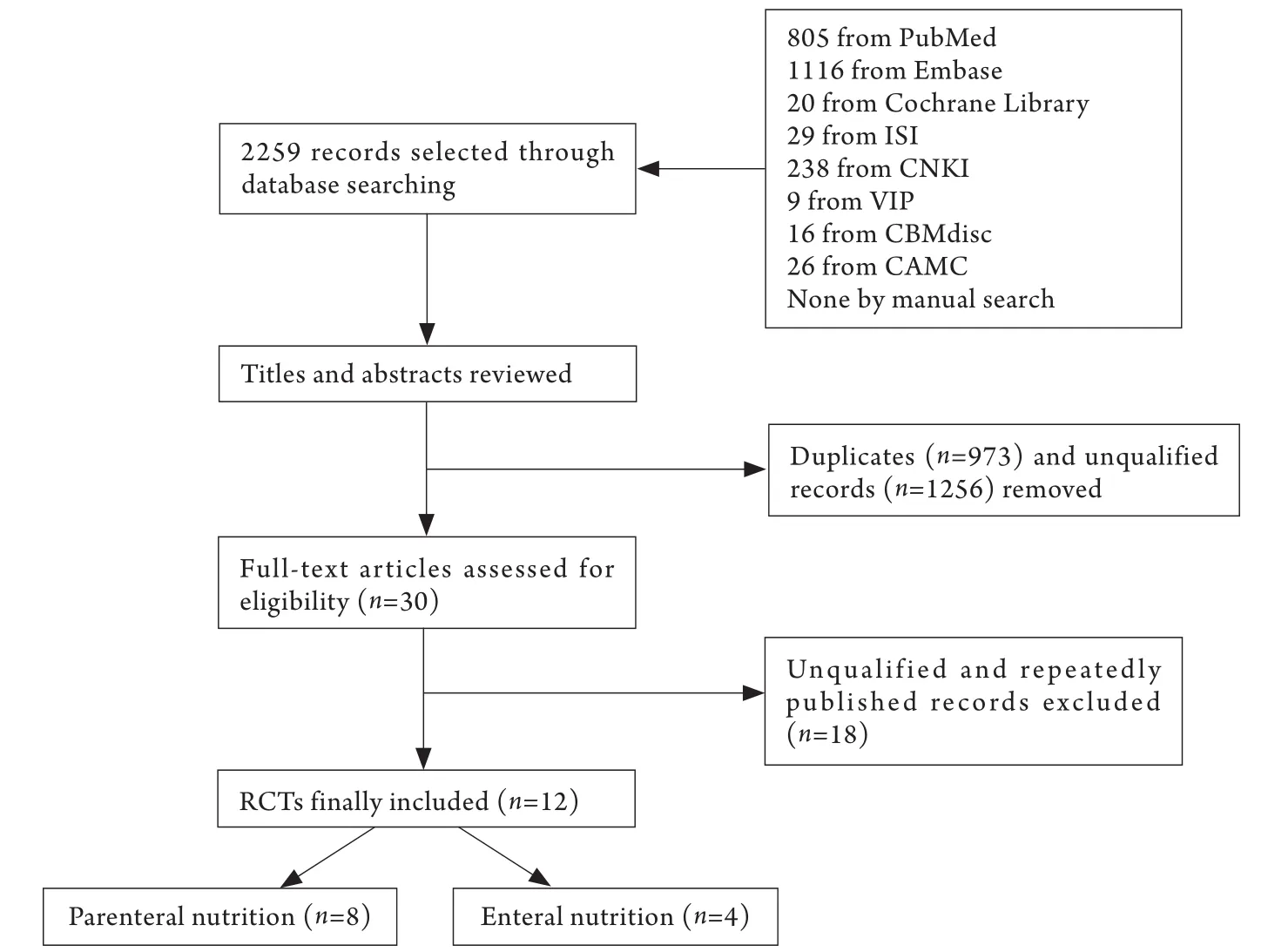
图1 文献搜集树状图Fig.1 Process of collecting documents
2.3 方法学质量评价 本研究纳入的RCT中有4篇Jadad评分为2分,其余RCT的Jadad评分均≥3分,为高质量文献(表2)。
2.4 疗效分析结果
2.4.1 肝功能指标 本研究分析的肝功能指标主要包括:血清总胆红素(TBIL)、碱性磷酸酶(ALP)、白蛋白(ALB)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、谷氨酰转肽酶(GGT)、前白蛋白(Pre-ALB)、视黄醇结合蛋白(RBP)、转铁蛋白(TF)。Meta分析结果显示,营养治疗组TBIL比对照组平均多降低37.41μmol/L(P=0.04,图2),血清ALP比对照组平均多降低625.7U/L(图3),血清TF比对照组平均多升高480.32mg/L(图4),差异均有统计学意义(P<0.05)。两组患者在其他肝功能指标方面差异均无统计学意义(P>0.05,表3)。
2.4.2 死亡发生率 共有9篇文献[6-8,10-13,15,17]提及了短期死亡发生率(1月内),异质性检验结果显示各研究间异质性小(I2=0%,P=0.91),采用固定效应模型合并效应量,Meta分析结果显示:营养治疗组与对照组治疗ALD患者的短期死亡发生率差异无统计学意义(RR=0.91,95%CI:0.64~1.27,P=0.57,图5)。4篇文献[6,10,15-16]提及了长期死亡发生率(6个月以上),异质性检验结果显示各研究间异质性小(I2=0%,P=0.43),采用固定效应模型合并效应量,Meta分析结果显示:营养治疗组与对照组治疗ALD患者的长期死亡发生率差异无统计学意义(RR=0.77,95%CI:0.53-1.12,P=0.17,图6)。
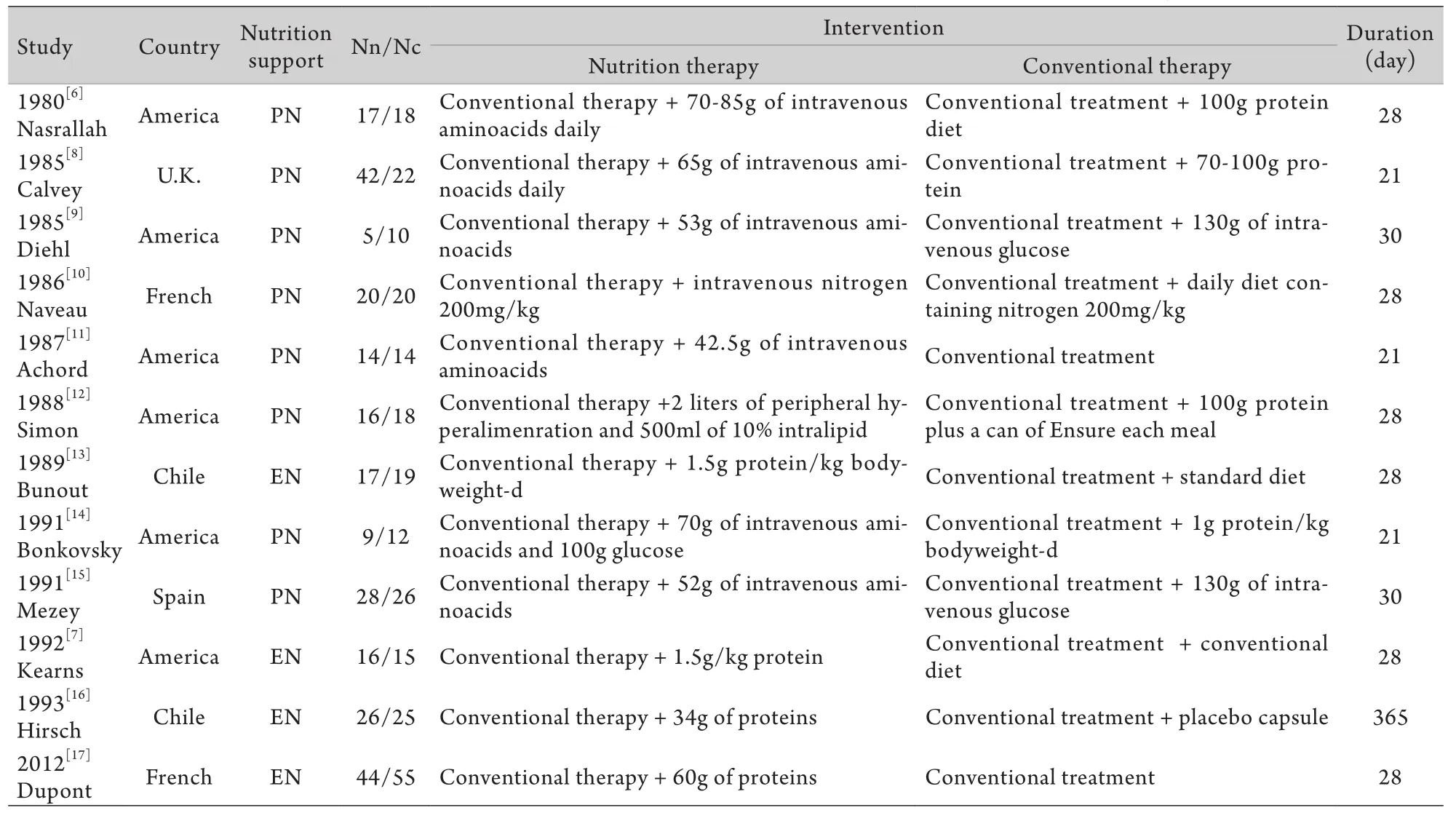
表1 纳入文献的基本特征及干预措施Tab.1 Characteristics and intervention measures of the trials included in meta-analysis
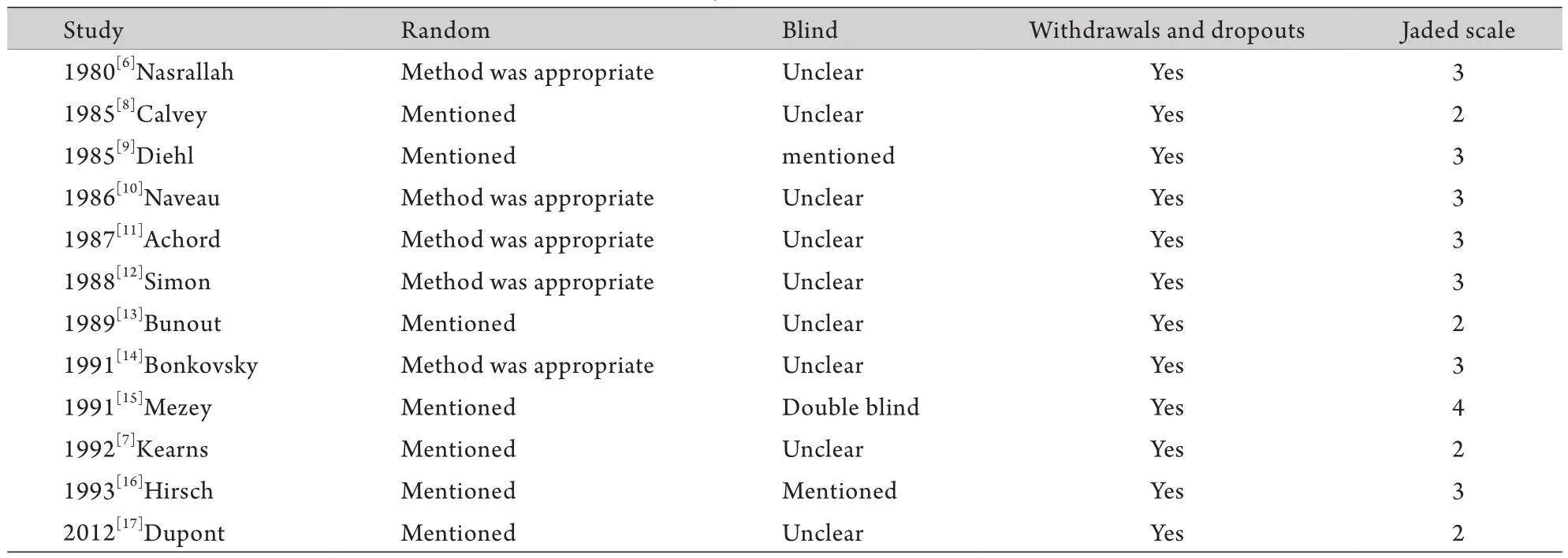
表2 纳入文献的质量评分Tab.2 Quality scores of included studies
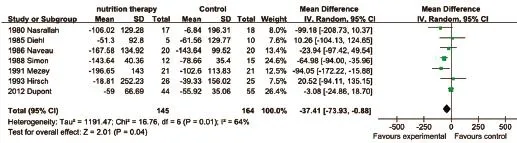
图2 两组ALD患者TBIL比较Fig.2 Comparison of serum total bilirubin of ALD patients between the two groups
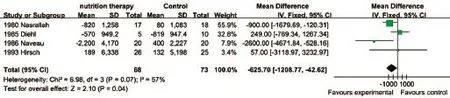
图3 两组ALD患者血清ALP比较Fig.3 Comparison of serum alkaline phosphatase of ALD patients between the two groups
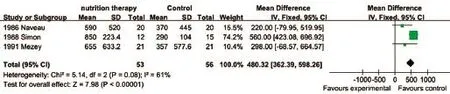
图4 两组ALD患者血清TF比较Fig.4 Comparison of serum transferrin of ALD patients between the two groups
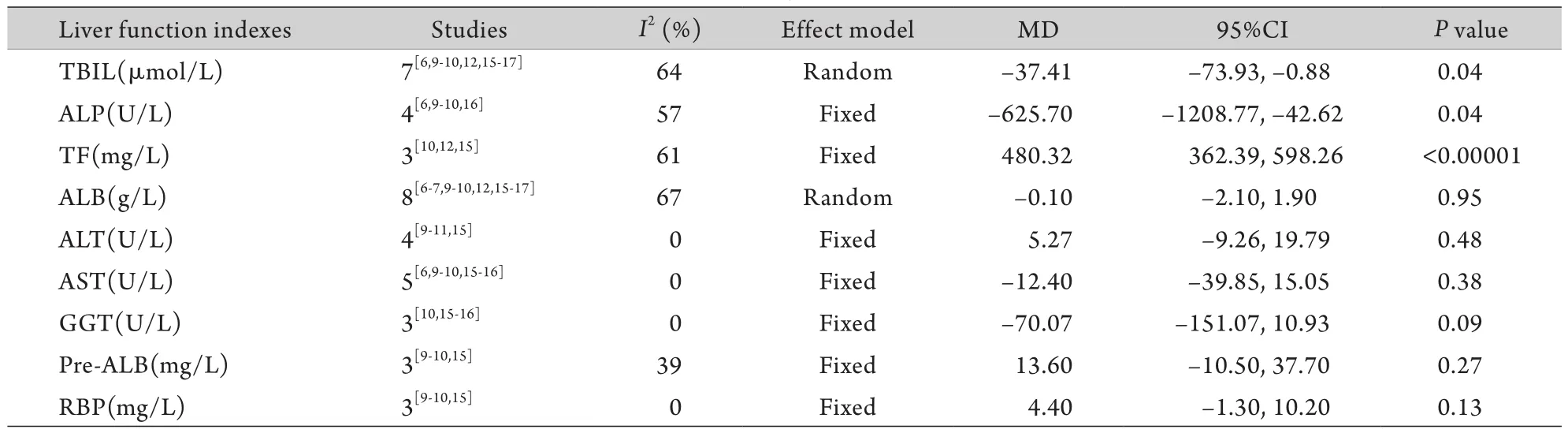
表3 肝功能指标Meta分析结果Tab.3 Results of meta-analysis of liver function indexes
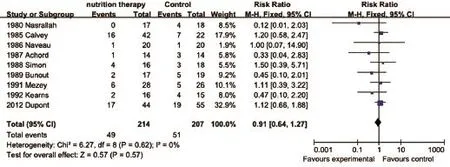
图5 两组ALD患者短期死亡发生率比较Fig.5 Comparison of short-term mortality of ALD patients in the two groups
2.4.3 ALD并发症及其他指标分析 本研究的ALD并发症及其他指标主要包括:肝性脑病缓解率、腹水缓解率、食管胃底静脉曲张破裂出血率、肝肾综合征发生率、凝血酶原时间、平均住院日。结果显示,两组患者上述指标差异均无统计学意义(P>0.05,表4)。
2.4.4 感染发生率 3篇文献[10,16-17]分析了感染发生率。结果显示,营养治疗组与对照组相比,两组间感染发生率差异亦无统计学意义(P>0.05,图7)。
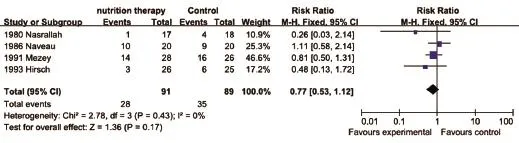
图6 两组ALD患者长期死亡发生率比较Fig.6 Comparison of long-term mortality of ALD patients in the two groups
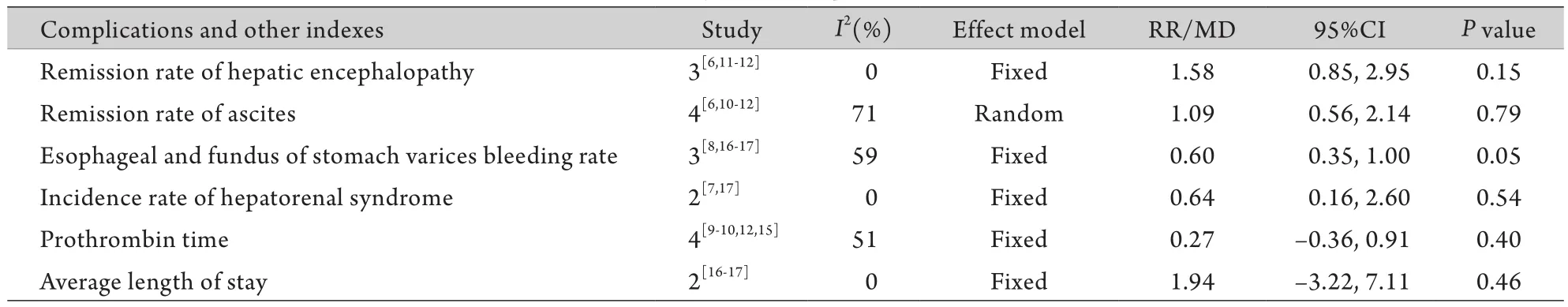
表4 并发症及其他指标meta分析结果Tab.4 Results of meta-analysis of complications and the other indexes
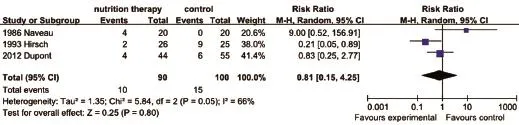
图7 两组ALD患者感染发生率比较Fig.7 Comparison of incidence of infection in ALD patients of the two groups
3 讨 论
ALD发病率逐步上升,目前已成为继病毒性肝炎之后威胁人类健康的第二大肝病病因。戒酒是治疗ALD最重要最基本的方法,即使在肝硬化阶段,戒酒仍然可以减缓疾病的进展。糖皮质激素自20世纪70年代开始就被应用于ALD的治疗,但其效果却一直备受争议。虽有学者分析过其他药物如己酮可可碱[18]、抗肿瘤坏死因子α(TNF-α)[19]以及S-腺苷甲硫氨酸[20]等在ALD治疗中的价值,但目前仍缺乏支持它们临床使用的有力证据。肝移植仅能作为终末期ALD对药物治疗无效的一种补救措施。
1982年Morgan等[21]报道失代偿期ALD的社区患者大约有20%合并PEM,而ALD的住院患者几乎100%合并有PEM。营养不良在ALD中的发生是一个复杂的涉及食物摄入不足以及营养消化吸收不良等[22]多因素参与的过程,而营养不良患者因体内抗氧化剂、维生素及氨基酸等缺乏而使自由基损伤加重,增加感染风险,后者又可进一步加重肝脏损伤,形成恶性循环[5]。由此可见,营养不良可加重ALD患者病情。早在1980年,Nasrallah等[6]将营养治疗引入ALD患者的综合治疗方案中,结果显示静脉给予氨基酸治疗可以降低患者的短期死亡发生率,并改善TBIL及ALB水平;而随后Kearns等[7]的研究结果显示,营养治疗可降低TBIL水平及肝性脑病发生率,但不能改善患者短期死亡发生率。鉴于上述疗效的差异,2012年Antar等[23]应用循证医学方法分析了营养治疗对ALD住院患者的疗效,结果显示营养治疗既不能改善患者死亡发生率,也不能改善TBIL等肝功能指标。但该研究存在以下不足:①仅纳入7个RCT,且只针对ALD的住院患者,未纳入门诊患者;②分析指标较少(仅分析了胆红素、ALB、ALP、AST、ALT、腹水及肝性脑病改善情况)。
在本文中,我们对国内外相关的临床随机对照研究进行了全面检索,最终纳入了12个RCTs,得出如下几方面结果。第一,在肝功能指标方面,营养治疗组TBIL比对照组平均多降低37.41μmol/ L,血清ALP比对照组平均多降低625.70U/L,血清TF比对照组平均多升高480.32mg/L。TBIL是Childpugh肝功能分级的5项主要指标之一,其水平升高常常提示肝功能受损较重;血清ALP升高是慢性肝炎、肝硬化的常见表现之一。本研究结果显示,营养治疗可明显降低上述两个指标,表明在ALD患者中适当补充营养可改善部分肝功能指标,有望提高患者生存质量。血清TF降低也是ALD的常见表现之一,本研究显示营养治疗可明显提高患者血清TF水平,进一步表明营养治疗在ALD中的积极作用。本结果与Antar等[23]的结果明显不同,其研究显示营养治疗不能改善TBIL、ALP等肝功能指标,造成这种差异的原因可能与他们纳入的研究及病例数较少有关。第二,在死亡发生率方面,营养治疗组的短期或长期死亡发生率与对照组相比差异均无统计学意义,这与Antar等[23]的研究结果类似。第三,在其他肝功能指标及并发症方面,两组患者血清ALB、ALT、AST、GGT、Pre-ALB、RBP及肝性脑病缓解率、腹水缓解率、食管胃底静脉曲张破裂出血率、肝肾综合征发生率、凝血酶原时间、平均住院日均无统计学差异。Antar等[23]的研究显示营养治疗不能改善ALB、ALT、AST等肝功能指标及不能缓解腹水形成,这些结果与本文类似。第四,在感染发生率方面,本结果显示营养治疗组与对照组相比差异无统计学意义,这在Antar等[23]的研究中尚未涉及。综上所述,本研究提示营养治疗虽不能影响ALD患者的短期或长期生存率,但可以明显改善患者的部分主要肝功能指标,而感染发生率并不增加,可以作为ALD患者的一项常规治疗措施。
本文也存在一些局限性:纳入文献均来自西方国家,由于人种差异,本研究结果能否用于国人,还需进一步证实;纳入文献较陈旧;入选的文献质量评价一般;入选试验的疗程及随访时间不一致;试验组干预措施成分差异较大;试验对象病情严重程度不一致。期待更多高质量、大样本、多中心的临床RCTs,以便更加全面评价营养治疗对ALD的有效性与安全性,为其临床应用取得更为可靠的循证医学证据。
[1]Gao B, Bataller R. Alcoholic liver disease: pathogenesis and new therapeutic targets[J]. Gastroenterology, 2011, 141(5): 1572-1585.
[2]Wang SY, Huang HH, Xu RN,et al. Analysis of cause of death in patients with liver diseases: report of 1890 cases[J]. Med J Chin PLA, 2014, 39(5): 392-395.[王嗣予, 黄辉煌, 徐若男, 等. 肝病患者死亡原因分析:1890例报告[J]. 解放军医学杂志, 2014, 39(5): 392-395.]
[3]Guan WJ, Lv XW, Yang WZ,et al. Research progress of treatment of alcoholic liver disease[J]. Anhui Med Pharm J, 2011, 15(8): 925-927.[管文婕, 吕雄文, 杨万枝, 等. ALD治疗的研究进展[J]. 安徽医药, 2011, 15(8): 925-927.]
[4]Mendenhall CL, Anderson S, Weesner RE,et al. Crolic KA. Protein-calorie malnutrition associated with alcoholic hepatitis. Veterans Administration Cooperative Study Group on Alcoholic Hepatitis[J]. Am J Med, 1984, 76(2): 211-222.
[5]Sehenker S, Halff GA. Nutritional therapy in alcoholic liver disease[J]. Semin Liver Dis, 1993, 13(2):196-209.
[6]Nasrallah SM, Galambos JT. Aminoacid therapy of alcoholic hepatitis[J]. Lancet, 1980, 2(8207): 1276-1277.
[7]Kearns PJ, Young H, Garcia G,et al. Accelerated improvement of alcoholic liver disease with enteral nutrition[J]. Gastroenterology, 1992, 2(1): 200-205.
[8]Calvey H, Davis M, Williams R. Controlled trial of nutritional supplementation, with and without branched chain amino acid enrichment, in treatment of acute alcoholic hepatitis[J]. J Hepatol, 1985, 1(2): 141-151.
[9]Diehl AM, Boitnott JK, Herlong HF,et al. Effect of parenteral amino acid supplementation in alcoholic hepatitis[J]. Hepatology, 1985, 5(1): 57-63.
[10] Naveau S, Pelletier G, Poynard T,et al. A randomized clinical trial of supplementary parenteral nutrition in jaundiced alcoholic cirrhotic patients[J]. Hepatology, 1986, 6(2): 270-274.
[11] Achord JL. A prospective randomized clinical trial of peripheral amino acid-glucose supplementation in acute alcoholic hepatitis[J]. Am J Gastroenterol, 1987, 82(9): 871-875.
[12] Simon D, Galambos JT. A randomized controlled study of peripheral parenteral nutrition in moderate and severe alcoholic hepatitis[J]. J Hepatol, 1988, 7(2): 200-207.
[13] Bunout D, Aicardi V, Hirsch S,et al. Nutritional support in hospitalized patients with alcoholic liver disease[J]. Eur J Clin Nutr, 1989, 43(9): 615-621.
[14] Bonkovsky HL, Fiellin DA, Smith GS,et al. A randomized, controlled trial of treatment of alcoholic hepatitis with parenteral nutrition and oxandrolone. I. Short-term effects on liver function[J]. Am J Gastroenterol, 1991, 86(9): 1200-1208.
[15] Mezey E, Caballeria J, Mitchell MC,et al. Effect of parenteral amino acid supplementation on short-term and long-term outcomes in severe alcoholic hepatitis: a randomized controlled trial[J]. Hepatology, 1991, 14(6): 1090-1096.
[16] Hirsch S, Bunout D, de la Maza P,et al. Controlled trial on nutrition supplementation in outpatients with symptomatic alcoholic cirrhosis[J]. JPEN J Parenter Enteral Nutr, 1993, 17(2): 119-124.
[17] Dupont B, Dao T, Joubert C,et al. Randomised clinical trial:enteral nutrition does not improve the long-term outcome of alcoholic cirrhotic patients with jaundice[J]. Aliment Pharmacol Ther, 2012, 35(10): 1166-1174.
[18] Whitfield K, Rambaldi A, Wetterslev J,et al. Pentoxifylline for alcoholic hepatitis[J]. Cochrane Database Syst Rev, 2009, (4): CD007339.
[19] Naveau S, Chollet-Martin S, Dharancy S,et al. A double-blind randomized controlled trial of infliximab associated with prednisolone in acute alcoholic hepatitis[J]. Hepatology, 2004, 39(5): 1390-1397.
[20] Mato JM, Camara J, Fernandez de Paz J,et al. S-adenosylmethionine in alcoholic liver cirrhosis: a randomized, placebo-controlled, double-blind, multicenter clinical trial[J]. J Hepatol, 1999, 30(6): 1081-1089.
[21] Morgan MY, Levine JA. Alcohol and nutrition[J]. Proc Nutr Soc, 1988, 47(2): 85-98.
[22] Charlton M. Branched-chain amino acid enriched supplements as therapy for liver disease[J]. J Nutr, 2006, 136(1 Suppl): 295S-298S.
[23] Antar R, Wong P, Ghali P. A meta-analysis of nutritional supplementation for management of hospitalized alcoholic hepatitis[J]. Can J Gastroenterol, 2012, 26(7): 463-467.
Efficacy of nutrition therapy in patients with alcoholic liver diseases: a meta-analysis
BIE Cai-qun1, WU Sheng-lan1, TANG Shao-hui2*1Department of Gastroenterology, Shenzhen Shajing Affiliated Hospital of Guangzhou Medical University, Shenzhen, Guangdong 518104, China
2Department of Gastroenterology, First Affiliated Hospital of Jinan University, Guangzhou 510630, China
*< class="emphasis_italic">Corresponding author, E-mail: tangshaohui205@163.com
, E-mail: tangshaohui205@163.com
ObjectiveTo evaluate the efficacy of nutrition therapy in alcoholic liver diseases (ALD).MethodsPubMed, Embase, Web of Science, The Cochrane Central Register of Controlled Trials, Chinese Journals Full-Text Database, Chinese Biomedical Database and Wan Fang Digital Journal Full-Text Database were searched for relevant articles. Statistical analysis was performed by meta-analysis using Review Manager 5.1.0.ResultsTwelve randomized controlled trials including 508 cases were analyzed. Meta-analysis results were as follows: Compared with conventional therapy, nutrition therapy was more effective in reducing the serum total bilirubin (P=0.04) and alkaline phosphatase (P=0.04), and increasing serum transferrin (P<0.00001), but there was no statistically significant difference between the two groups in other liver functions and complications associated with ALD. There was no statistically significant difference between the two groups in the incidence of infection, short-term or long-term mortality of ALD.ConclusionsNutrition therapy can improve some important liver functions, such as serum total bilirubin, alkaline phosphatase, and transferrin in patients with ALD, but it may not improve the short-term or long-term mortality, other liver functions, or complications of ALD. Due to the above role in improving liver function, the nutrition therapy can be recommended as a routine treatment in patients with ALD.
hepatitis, alcoholic; nutrition therapy; randomized controlled trials; Meta-analysis
R575
A
0577-7402(2015)11-0927-07
10.11855/j.issn.0577-7402.2015.11.14
2015-03-27;
2015-07-29)
(责任编辑:熊晓然)
别彩群,医学博士,副主任医师。主要从事肝癌的基础及临床研究
518104 广东深圳 广州医科大学附属深圳沙井医院消化内科(别彩群、吴胜兰);510630 广州 暨南大学附属第一医院消化内科(汤绍辉)
汤绍辉,E-mail:tangshaohui205@163.com
