经鼻内镜视神经减压术治疗非外伤压迫性视神经病
2015-06-28任成龙王小路单希征
任成龙,王小路,单希征
·临床研究·
经鼻内镜视神经减压术治疗非外伤压迫性视神经病
任成龙,王小路,单希征
目的探讨经鼻内镜视神经减压术治疗非外伤压迫视神经的临床疗效。方法回顾性分析2013年4月-2014年4月在武警总医院耳鼻咽喉头颈外科行鼻内镜下切除鼻腔颅底肿瘤同时行视神经管减压术的10例患者的临床资料。10例患者中男5例,女5例,年龄44.3±5.1岁,其中5例因肿瘤压迫视神经出现视力丧失,5例因肿瘤压迫视神经出现视力减退。对所有患者术前和术后6个月的临床和影像学资料进行总结分析。结果5例术前无光感的患者(其中2例为双侧视神经受压)中,术后第7天4例视力有不同程度的提高(双侧视力丧失的患者双侧视力均有提高)。5例术前视力下降患者术后视力均有不同程度的恢复。所有患者术后未见明显并发症。结论经鼻内镜视神经减压术治疗肿瘤压迫视神经是一种安全、有效、创伤小的外科技术,能明显改善非外伤压迫性视神经病患者的视力。
盲;颅底肿瘤;视神经减压
压迫性视神经病是继发于视神经压迫的一类疾病,由外伤或其他病理因素如肿瘤、感染、纤维异常增殖等引起[1],多数学者认为如果有明显的视神经压迫应该早期进行手术减压[1-2]。随着我国社会经济的发展,交通事故逐年增多,关于外伤性视神经病治疗的报道日趋丰富[3-4],但非外伤因素引起的视神经压迫治疗经验报道较少[5-6]。视神经减压可用于治疗病理改变(包括肿瘤和纤维异常增生症)引起的视神经压迫,达到保护视神经功能和保存视力的目的[7]。经鼻内镜手术在颅底外科领域有着广泛的应用,如处理垂体腺瘤、其他颅内病变和脑脊液鼻漏,也可用于治疗压迫性视神经病[8-12]。经鼻内镜入路能充分暴露眶尖和覆盖神经血管的骨质,避免牵拉脑组织,保持嗅觉功能,且避免了外部切口[1-2]。但采用经鼻内镜视神经减压术治疗非外伤性视神经病的报道目前鲜见[13-16]。本文报道10例颅底肿瘤压迫视神经引起视力下降患者接受经鼻内镜手术后视力的恢复情况及取得的初步经验。
1 资料与方法
1.1 临床资料 2013年4月-2014年4月因颅底肿瘤压迫视神经引起视力下降就诊于武警总医院耳鼻咽喉头颈外科的患者10例(12眼),其中男5例,女5例,年龄44.3±5.1岁。10例患者中5例因肿瘤压迫视神经出现视力丧失,5例因肿瘤压迫视神经出现视力减退。10例患者均有不同程度的头痛。5例患者同时出现动眼神经受压、眼睑下垂等表现。6例患者有鼻塞、鼻腔出血、流涕等鼻部症状。记录患者术前评估和术后半年随访的资料,以及手术和住院期间的情况。
1.2 术前评估 ①眼科检查:所有患者术前均行眼科检查,包括视力、视野、眼底、视觉诱发电位等。②相关科室会诊:术前由神经外科会诊,排除脑出血、脑梗死、动脉瘤等;个别患者由颌面外科会诊。③术前影像学检查:术前均行头颈部CT血管造影(CTA)、头颅MRI检查。一方面可明确视神经与肿瘤的关系,另一方面可排查颅内血管瘤,特别是假性动脉瘤。④术前容积重建:使用GE多层螺旋CT对10例患者进行图像采集。将采集后的图像传至影像工作站进行容积重建(volume rendering,VR)后观察。常规进行横断面、冠状面及矢状面的重建,重建的厚度为1mm。术者对重建后的图像及VR显示的图像进行不同角度的观察。根据内镜仰角观察病变与周围组织的关系,特别是颈内动脉及视神经管与颅底肿瘤的关系。
1.3 手术方法 所有患者均采用静脉诱导麻醉,控制性降压以减少术中出血,0.1%肾上腺素棉片收缩鼻腔以扩大手术空间,减少术中出血。术中充分暴露肿瘤组织,充分切除肿瘤,开放筛窦,充分开放蝶窦,辨认视神经管,磨除视神经管表面骨质,应使用高速颅底钻和大号金刚石钻头(7mm),同时使用水泵冲水。使用大号钻头是为避免钻头过于深入,引起致命并发症(颈内动脉破裂出血),而使用水泵冲水可减少对视神经的热损伤。术中采用双鼻孔两人四手操作,视野暴露充分,解剖结构显露清楚。磨除整个视神经管内段骨质达视神经周长1/2以上,充分切开总腱环,不必切开视神经鞘膜(图1)。整个过程在0°内镜下完成。术中出现海绵窦渗血时,可使用速即纱压迫止血。
术中充分切除肿瘤,可切除一部分与肿瘤组织联系紧密的脑组织,出现脑脊液鼻漏后可取左侧大腿肌肉脂肪及筋膜行脑脊液鼻漏修补术。充分减压视神经后,明确脑脊液漏口位置,使用人工硬脑膜覆盖视神经表面保护视神经,用肌肉组织、筋膜覆盖漏口,外覆人工硬脑膜加固,术区填塞碘仿纱条。
1.4 术中视神经管的定位方法 首先自眶尖部向后延伸寻找视神经管,或者凭借颈内动脉视神经隐窝判断视神经管位置。当以上方法定位视神经管遇到困难时,则应用CT扫描图像判断视神经管位置,若应用CT图像也很难定位视神经管位置,可复习VR图像,从多角度立体观察并定位视神经。
1.5 术后处理 术后患者无需进入ICU病房观察,通常1周内安排放化疗或者出院。术中出现脑脊液鼻漏并行颅底重建的患者无需绝对卧床,无需给予腰大池引流。所有患者术后给予营养神经、改善微循环治疗。
1.6 统计学处理 应用解剖学标志、CT图像和VR图像判断视神经管的位置,与手术实际所观察到的视神经管的位置进行比较,统计3种方法判断准确的例数,应用SPSS 17.0软件进行χ2检验,P<0.05为差异有统计学意义。
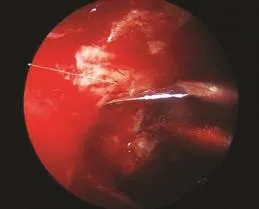
图1 充分减压的视神经Fig. 1 Adequate decompression of the optic nerve
2 结 果
2.1 病理结果 所有患者都进行了鼻内镜颅底肿瘤切除,在充分切除肿瘤后用高速电钻磨除视神经周围骨质,充分减压。术后病理:鳞癌3例(鳞癌颅底转移1例、鼻咽癌颅底转移1例、低分化鳞癌1 例)、鼻腔恶性黑色素瘤1例、内翻乳头状瘤1例、小细胞肿瘤1例、炎性假瘤1例、小细胞癌1例、乳腺癌颅底转移1例、蝶窦囊肿1例。其中1例低分化鳞癌患者和1例颅底转移性鳞癌患者术后接受放疗和化疗,1例鼻腔恶性黑色素瘤患者术后接受化学治疗(未完成全部疗程),其余患者术后未接受放疗或化疗。
2.2 视力恢复结果 5例术前无光感患者(其中2例为双侧视神经受压导致双侧视力丧失)中,术后第7天4例视力恢复至光感或以上(双侧视力丧失的患者双侧视力均有提高),另1例患者术后半年视力为1.2;5例术前视力下降的患者术后第7天视力恢复至数指或以上。所有患者术后未见明显并发症。
2.3 随访结果 经过半年的随访,1例患者(例5)因放弃治疗死亡;1例患者(例6)炎性假瘤术后复发,行眼眶内容物剜除术;1例患者(例8)术后放疗过程中出现视力下降;1例患者(例10)视力未见明显恢复(表1)。
2.4 三种方法判断视神经管位置的准确性比较应用解剖学标志、CT图像和VR图像判断视神经管的位置,与手术实际所观察到的视神经管位置做比较,结果显示,应用解剖学标志、CT图像和VR图像判断视神经管位置的准确率分别为10%、20%和90%,VR图像评估视神经管位置的准确率明显优于CT图像和解剖学标志(χ2=12.889,P<0.05)。
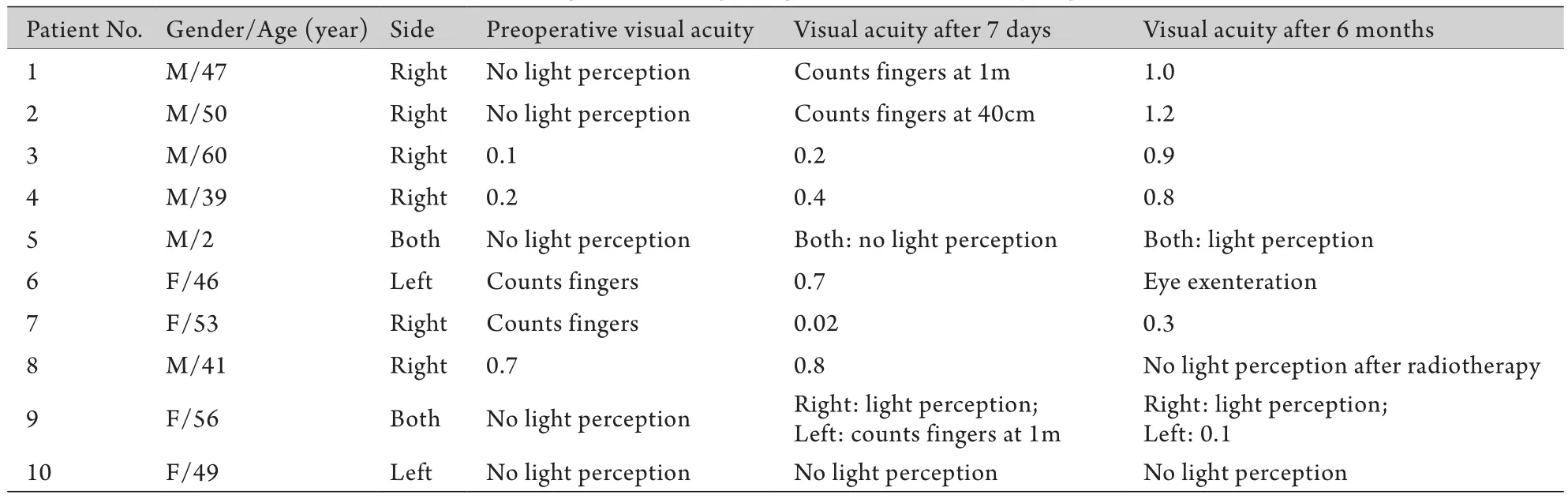
表1 患者术前术后视力Tab. 1 Preoperative and postoperative visual acuity of patients
3 讨 论
3.1 应用解剖 视神经是大脑延伸一部分,被3层脑膜覆盖[17-19],每一层长50mm,视神经解剖上分成4部分,即眼内段(1mm)、眶内段(25~30mm)、管内段(10mm)和颅内段(10mm),其中管内段最易受到压迫,且该段视神经被Zinn环固定。从鼻内镜视角观察,大多数人的视神经被1.5mm厚的薄骨板覆盖,但有4%的人无骨板覆盖。比较而言,有8%的人颈内动脉在蝶窦内是无骨板覆盖的。在磨除视神经管时对此点应予注意。
视神经从蝶骨小翼的两个桩之间浅出。视神经管大约长10mm,宽4~5mm,其近端细而薄,远端厚而窄,其内包含有视神经及眼动脉。通常情况下,眼动脉在视神经的外下方,视网膜中动脉在眼球后10mm离开眼动脉。
3.2 病理生理 从病理生理学的视角看[20-21],视神经走行在视神经管内,视神经外伤后的水肿、出血会造成视神经受压,这是急性视神经损伤的重要原因,基于这些病理生理改变,视神经减压术常用来治疗压迫性视神经病。
3.3 术前评估 术前应进行详细的眼科检查,至少应检查眼底、视力、视野。如果患者不能合作,则应行视觉诱发电位检查,但即使视觉诱发电位检查结果显示信号不能引出,视神经减压术仍有可能使患者受益。
术前进行头颈部CTA检查,可进行任意厚度的二维及三维重建,术者可在任意角度观察病变的位置及与周围重要结构的关系,特别是与视神经的关系,辅助制定手术计划。常规CT扫描只能提供平面二维图像,不利于观察病变的位置,本研究每例患者均进行了CT图像扫描后的体积重建,并根据患者的个体情况制定手术方案,体现了治疗的个体化,减少手术并发症。但是,术前体积重建图像与术中所见比较仍有一定差距,一方面主要是由于内镜透视效应[22],另一方面是因为病变使周围组织的相互关系发生改变,同时钙化等组织密度改变也会影响术前判断。
3.4 视神经的定位 在进行视神经减压时,视神经的准确定位十分重要。有学者提出可根据骨性标志进行视神经管定位,例如视神经隆突,但不是所有的患者都有视神经隆突。刘旭林等[23]报道400例患者中只有68例有明显的视神经隆突,李志海等[24]报道34例患者中只有7例有明显的视神经隆突,而Zhang等[25]提出可通过蝶窦与视神经的关系定位视神经。
本研究通过CT扫描,在图像工作站中进行体积重建,可以立体地观察视神经与周围病变和重要血管的关系,并能模拟内镜的角度进行观察。在手术过程中定位视神经遇到困难时,可以参考体积重建图像,有助于准确地找到视神经。统计学分析显示,根据体积重建图像判断视神经管位置的准确性明显优于CT图像和解剖学标志。由于患者病变的范围和侵犯视神经的程度不同,以及颅底病变的存在,骨性解剖标志的相互关系可发生变化,而通过体积重建图像可以个体化地观察视神经与周围骨质的关系,进而制定个体化的手术治疗方案。
3.5 手术要点 经鼻内镜处理肿瘤减少了手术中对视神经的牵拉,而且避免了对脑组织的牵拉[26-28]。另外,该入路对来自大脑前动脉和前交通动脉的血管影响更小[29-30]。有学者认为肿瘤侵及视神经管时不能经鼻内镜入路手术[31-32],但本研究结果显示,视神经管探查和开放不仅是安全可行的,而且对于改善视力和减少术后肿瘤复发率均具有重要作用。视神经管内侧位于蝶窦内,经鼻入路可开放视神经管直至眶尖部位[33],有助于切除视神经周围的肿瘤组织。
本组的经验是全麻插管后不进行头架固定,常规消毒铺单,头偏向术者15°,术前用肾上腺素纱条收缩鼻腔以扩大手术空间、减少出血。术前左侧大腿备皮,以备术中出现脑脊液鼻漏时重建颅底。铺单时应露出双眼,以便于术中参照及观察眼球是否凹陷。鼻腔操作常规在0°内窥镜下完成。在处理视神经表面骨质时,应用大钻头磨除,同时不断冲水,以减轻热损伤。
术中应充分开放筛窦,以利于暴露蝶窦,应完整去除蝶窦前壁以便于看清颅底的骨质及各种结构,部分病例中视神经和颈内动脉没有骨质覆盖。术前应认真阅读影像资料判断是否有Onodi气房,如果有Onodi气房,应在术中充分开放,以便于暴露视神经。术中避免破坏眶骨板,防止眶内脂肪突入术野。视神经减压的范围至少应达到骨管的1/2。是否应切开视神经鞘膜目前仍有争议,本组未行视神经鞘膜切开,但仍取得了较好的疗效。切开视神经鞘膜的缺点一是可能导致脑脊液鼻漏,二是有可能损伤眼动脉。
3.6 术后处理 本组根据术中情况安排患者术后用药,如果术中切除部分硬脑膜和脑组织,为防止术后出现脑水肿,常规给予甘露醇脱水,所有患者均未出现明显的脑水肿表现。术后是否给予激素冲击治疗仍有争议。本研究中对于良性肿瘤给予激素冲击减轻水肿,恶性肿瘤只给予营养神经治疗。术后7d评估患者早期视力恢复情况。术中行脑脊液鼻漏修补后,无需绝对卧床,所有患者在1周内出院或行进一步放化疗。术后给予鼻腔冲洗有利于鼻腔黏膜恢复,改善生活质量,术后1、3、6个月行CT、MRI检查评估是否有肿瘤复发。
3.7 病理类型 多种类型的颅底病变及肿瘤可压迫视神经引起视力丧失,如视神经鞘脑膜瘤、骨异常增生症、内分泌性眼病、眶尖肿瘤、眼眶内侧肿瘤、黏液囊肿、先天性颅内高压、海绵窦肿瘤侵及视神经、脑膜瘤、视神经或眼眶炎症等。本研究中1例乳腺癌颅底转移并有广泛的骨转移,颅底病变压迫双侧视神经致双侧视力丧失,向患者及家属交代相关手术情况后,患者及家属强烈要求手术改善视力,手术后7d左侧视力较快恢复,术后半年视力恢复至0.8,生活质量明显改善。1例鼻窦恶性黑色素瘤突入筛窦、蝶窦,压迫视神经引起视力下降,经鼻内镜充分切除肿瘤并行视神经减压术,术后恢复良好,无并发症,因患者家庭经济情况不良,放弃放化疗。术后随访半年肿瘤无复发,视力恢复至1.0。
3.8 影响手术效果的因素 内镜视神经减压术能明显改善压迫性视神经病患者的术后视力,但是有很多因素可影响视力改善的程度。2012年Carlson 等[34]的一项荟萃分析表明,视力损伤小、无视乳头水肿、病变小、原发肿瘤切除充分、未侵及海绵窦、组织不致密、未侵及蛛网膜、切除充分等因素有利于术后视力改善。2014年Berhouma等[35]报道视神经减压治疗非外伤性视神经病的有效率为36.4%,本研究中随访半年后获得稳定视力改善的有效率为60%,其中1例患者为放疗中出现视力丧失,1例患者放弃治疗后死亡。本研究中1例蝶窦囊肿患者出现视力下降、眼睑下垂,一直就诊于眼科,行相关检查未见异常,1个月后出现视力丧失后就诊于我院给予手术治疗,眼睑下垂恢复,视力丧失无恢复。可见手术治疗应早期进行才能获得更好的效果。本组患者能获得较好的视力恢复主要是由于:①手术中采用大号金刚砂磨钻,同时水泵冲水磨除视神经表面骨质,减少了术中操作对视神经的损伤;②收住院后积极安排手术,使患者早期接受手术治疗,也有利于视力的恢复;③手术过程大多采用“两人四手”操作,视野暴露充分,能清楚辨认视神经及相关结构。
本研究的初步经验表明,经鼻内镜侵袭入路避免了行开颅手术,不仅能切除肿瘤,而且可同时行视神经减压,同时还具有安全、有效、缩短住院时间、创伤小等优势,如果能尽早行视神经减压术不仅能降低手术难度,而且更有利于术后视力的恢复。术前行CT检查后进行体积重建,能够帮助术者详细了解病变情况,准确判断视神经管位置。但是,由于此类病变的发病率低,本研究中收录的病例数有限,随访时间较短,还需进一步进行大样本长期随访研究,以获得更有效的临床证据。
[1]Pletcher S D, Metson R. Endoscopic optic nerve decompression for nontraumatic optic neuropathy[J]. Arch Otolaryngol Head Neck Surg, 2007, 133(8): 780-783.
[2]Pletcher SD, Sindwani R, Metson R. Endoscopic orbital and optic nerve decompression[J]. Otolaryngol Clin North Am,2006, 39(5): 943-958.
[3]Guo WH. Effect of transnasal endoscopic optic nerve decompression[D]. Taiyuan: Shanxi Medical University, 2014. 1-41.[郭卫红. 外伤性视神经病变不同治疗方案的疗效观察[D]. 太原: 山西医科大学, 2014. 1-41.]
[4]Li X, Wang D, Li TL. Traumatic optic neuropathy: clinical analysis of 15 cases with no light perception[J]. Chin Remed Clin, 2014, 14(5): 650-652.[李欣, 王东, 李同丽. 外伤性视神经病无光感15例诊治分析[J]. 中国药物与临床, 2014, 14(5): 650-652.]
[5]Aldea S, Bica D, Gobej I,et al. Bilateral orbital and optic nerve endoscopic endonasal decompression for nonspecific inflammatory orbital disease: case report[J]. J Neurol Surg A Cent Eur Neurosurg, 2013, 74(Suppl 1): e133-e135.
[6]Haruna S, Tukidate T, Konno W,et al. Transnasal endoscopic surgery for benign orbital tumors[J]. Auris Nasus Larynx, 2013, 40(2): 227-230.
[7]Kong DS, Shin HJ, Kim HY,et al. Endoscopic optic canal decompression for compressive optic neuropathy[J]. J Clin Neurosci, 2011, 18(11): 1541-1545.
[8]Silva D, Attia M, Kandasamy J,et al. Endoscopic endonasal transsphenoidal "above and below" approach to the retroinfundibular area and interpeduncular cistern--cadaveric study and case illustrations[J]. World Neurosurg, 2014, 81(2): 374-384.
[9]Matsuo T, Kamada K, Izumo T,et al. Indication and limitations of endoscopic extended transsphenoidal surgery for craniopharyngioma[J]. Neurol Med Chir (Tokyo), 2014, 54(12): 974-982.
[10] Li XJ, Yuan XR, Liu JP,et al. Endoscopic anatomy involving the extended transsphenoidal approach[J]. Chin Med J, 2008, 88(33): 2321-2325.
[11] Xing HY, Wang XL, Wang XF,et al. The significance of the pterygopalatine fossa angiography before endoscopic sinus surgery[J]. Med J Chin PLA, 2013, 38(11): 926-929.[邢洪瑜,王小路, 王雪峰, 等. 鼻内镜手术前翼腭窝区域血管内成像的意义[J]. 解放军医学杂志, 2013, 38(11): 926-929.]
[12] Chen Y, Wang GN, Guo FX. Comparison of the different methods of controlled hypotension in endoscopic nasal surgery[J]. Med J Chin PLA, 2011, 36(8): 856-857.[陈艳, 王光楠, 郭福祥. 不同控制性降压方法用于鼻内镜手术效果的比较[J]. 解放军医学杂志, 2011, 36(8): 856-857.]
[13] Li KK, Teknos TN, Lai A,et al. Traumatic optic neuropathy: result in 45 consecutive surgically treated patients[J]. Otolaryngol Head Neck Surg, 1999, 120(1): 5-11.
[14] Song Y, Li H, Ma Y,et al. Analysis of prognostic factors of endoscopic optic nerve decompression in traumatic blindness[J]. Acta Otolaryngol, 2013, 133(11): 1196-1200.
[15] Thakar A, Mahapatra AK, Tandon DA. Delayed optic nerve decompression for indirect optic nerve injury[J]. Laryngoscope, 2003, 113(1): 112-119.
[16] Rajiniganth MG, Gupta AK, Gupta A,et al. Traumatic optic neuropathy: visual outcome following combined therapy protocol[J]. Arch Otolaryngol Head Neck Surg, 2003, 129(11): 1203-1206.
[17] Bleier BS, Healy DJ, Chhabra N,et al. Compartmental endoscopic surgical anatomy of the medial intraconal orbital space[J]. Int Forum Allergy Rhinol, 2014, 4(7): 587-591.
[18] Hart CK, Theodosopoulos PV, Zimmer LA. Anatomy of the optic canal: a computed tomography study of endoscopic nerve decompression[J]. Ann Otol Rhinol Laryngol, 2009, 118(12): 839-844.
[19] Zhang J, Liao J, Yang Y,et al. Applied anatomy study of optic canal by transnasal endoscopy[J]. J Clin Otorhinolaryngol Head Neck Surg, 2009, 23(8): 346-348.
[20] Song Y, Li H, Ma Y,et al. Analysis of prognostic factors of endoscopic optic nerve decompression in traumatic blindness[J]. Acta Otolaryngol, 2013, 133(11): 1196-1200.
[21] Xie MQ, Long Z, Li ZH,et al. Timing of operation and therapeutic effect of endoscopic optic nerve decompression for traumatic optic neuropathy[J]. Chin J Otorhinolaryngol Head Neck Surg, 2009, 44(3): 197-202.[谢民强, 龙镇, 李仲汉, 等.外伤性视神经损伤经鼻内镜视神经减压手术时期选择及疗效观察[J]. 中华耳鼻咽喉头颈外科杂志, 2009, 44(3): 197-202.]
[22] Wang XL, Shan XZ, Gao JH. Construction and spatial directions analysis of digitized visible model of frontal sinus drainage pathway[J]. J Clin Rehabil Tissue Eng Res, 2010, 14(26): 4796-4800.[王小路, 单希征, 高建华. 额窦引流通路可视模型构建及空间方向分析[J]. 中国组织工程研究与临床康复, 2010, 14(26): 4796-4800.]
[23] Liu XL, Zhou CT, Zhang GH. CT anatomic measurement of the optic canal and its clinical significance[J]. Chin J Otorhinolaryngol, 2000, 35(4): 275.[刘旭林, 周承涛, 张光辉, 等. 健康人视神经管的CT测量及临床意义[J]. 中华耳鼻咽喉科杂志, 2000, 35(4): 275.]
[24] Li ZH, Gao QX, Cai ZY,et al. Three dimensional reconstruction study of multi slice helical CT imaging on optic canal area[J]. J Clin Otorhinolaryngol Head Neck Surg, 2007, 21(1): 7-9.[李志海, 高起学, 蔡志毅, 等. 视神经管区多层螺旋CT三维成像研究[J]. 临床耳鼻咽喉头颈外科杂志, 2007, 21(1): 7-9.]
[25] Zhang H, Liu X, Cheng Y,et al. A new method of locating the optic canal based on structures in sella region: computed tomography study[J]. J Craniofac Surg, 2013, 24(3): 1011-1015.
[26] Margalit NS, Lesser JB, Moche J,et al. Meningiomas involving the optic nerve: technical aspects and outcomes for a series of 50 patients[J]. Neurosurgery, 2003, 53(3): 523-532.
[27] Mahmoud M, Nader R, Al-Mefty O. Optic canal involvement in tuberculum sellae meningiomas: influence on approach, recurrence, and visual recovery[J]. Neurosurgery, 2010, 67(3 Suppl Operative): s108-s118.
[28] Mathiesen T, Kihlstrom L. Visual outcome of tuberculum sellae meningiomas after extradural optic nerve decompression[J]. Neurosurgery, 2006, 59(3): 570-576.
[29] Laufer I, Anand VK, Schwartz TH. Endoscopic, endonasal extended transsphenoidal, transplanum transtuberculum approach for resection of suprasellar lesions[J]. J Neurosurg, 2007, 106(3): 400-406.
[30] Wang Q, Lu XJ, Ji WY,et al. Visual outcome after extended endoscopic endonasal transsphenoidal surgery for tuberculum sellae meningiomas[J]. World Neurosurg, 2010, 73(6): 694-700.
[31] Dusick JR, Esposito F, Kelly DF,et al. The extended direct endonasal transsphenoidal approach for nonadenomatous suprasellar tumors[J]. J Neurosurg, 2005, 102(5): 832-841.
[32] de Divitiis E, Cavallo LM, Esposito F,et al. Extended endoscopic transsphenoidal approach for tuberculum sellae meningiomas[J].Neurosurgery, 2007, 61(5 Suppl 2): 229-237.
[33] Roth J, Fraser JF, Singh A,et al. Surgical approaches to the orbital apex: comparison of endoscopic endonasal and transcranial approaches using a novel 3D endoscope[J]. Orbit, 2011, 30(1): 43-48.
[34] Carlson A, Stippler M, Myers O. Predictive factors for vision recovery after optic nerve decompression for chronic compressive neuropathy: systematic review and meta-analysis[J]. J Neurol Surg B Skull Base, 2013, 74(1): 20-38.
[35] Berhouma M, M S, Jacquesson T, Abouaf L,et al. Endoscopic endonasal optic nerve and orbital apex decompression for nontraumatic optic neuropathy: surgical nuances and review of the literature[J]. Neurosurg Focus, 2014, 37(4): E19.
Endoscopic optic nerve decompression for nontraumatic compressive optic neuropathy
REN Cheng-long, WANG Xiao-lu*, SHAN Xi-zheng
Department of Otolaryngology-Head and Neck Surgery, General Hospital of People’s Armed Police Forces, Beijing 100039, China
*< class="emphasis_italic">Corresponding author, E-mail: wxl13341050@163.com
, E-mail: wxl13341050@163.com
This work was supported by the Nursery Foundation of the General Hospital of People's Armed Police Forces (WZ2010043)
ObjectiveTo describe the preliminary experience with endoscopic optic nerve decompression (EOND) for nontraumatic compressive optic neuropathies (NCONs).MethodsThe clinical data of 10 patients, male 5 and female 5, with a mean age of 44.3±5.1 years, who underwent EOND for visual loss (n=5) or visual deterioration (n=5) due to tumor compression in General Hospital of Armed Police Forces of China in the period from April 2013 to April 2014 were analyzed retrospectively. Preoperative and 6-month-postoperative clinical and imaging data of these patients were reviewed and analyzed.ResultsAmong 5 patients who lost light perception (including 2 patients with bilateral optic nerve compression) before operation, 4 of them showed visual improvement to different degrees on the 7th day after operation (with improvement of bilateral visual acuity). The other 5 patients with visual impairment before operation recovered their visual acuity to different extent after the operation. All of the patients had no obvious post-operative complications.ConclusionEOND is a safe, effective, and minimally invasive surgical technique affording recovery of visual function to NCON patients.
blindness; skull base neoplasms; optic nerve decompression
R739.41;R774.6
A
0577-7402(2015)11-0915-06
10.11855/j.issn.0577-7402.2015.11.12
2015-06-03;
2015-08-17)
(责任编辑:李恩江)
武警总医院苗圃基金(WZ2010043)
任成龙,硕士研究生。主要从事耳鼻咽喉科疾病的基础与临床研究
100039 北京 武警总医院耳鼻咽喉头颈外科(任成龙、王小路、单希征)
王小路,E-mail:wxl13341050@163.com
