华通胶源间充质干细胞经冠状动脉移植治疗慢性缺血性心肌病的实验研究
2015-06-28张宁坤陈宇王志国李俊风王丽华朱智明王力高连如
张宁坤,陈宇,王志国,李俊风,王丽华,朱智明,王力,高连如
华通胶源间充质干细胞经冠状动脉移植治疗慢性缺血性心肌病的实验研究
张宁坤,陈宇,王志国,李俊风,王丽华,朱智明,王力,高连如
目的探讨华通胶源间充质干细胞(WJMSCs)经冠状动脉移植治疗猪慢性缺血性心肌病(CIMP)的安全性和有效性。方法巴马小型猪29头,其中25头行左冠状动脉前降支球囊闭塞制作心肌梗死后CIMP模型,以超声心动图检查左室射血分数(LVEF)≤45%为CIMP成功标准,其余4头为假手术(Sham)组。造模成功17头,3头未成功,5头死亡,研究初始6头CIMP模型猪(3头成功造模+3头造模未成功)先行WJMSCs经冠状动脉移植剂量选择安全性实验,依次以6×106、1×107、2×107剂量经冠状动脉移植,每剂量组小型猪2头,造模成功与未成功者各1头,以TIMI 3级为安全剂量。余14头CIMP模型猪被随机分为WJMSCs移植组和对照组(n=7),分别经冠状动脉移植WJMSCs(2×107),或注入生理盐水。在WJMSCs移植8周后,对两组模型猪进行超声心动图、病理组织学、免疫荧光学检测。结果CIMP小型猪在WJMSCs移植8周后,LVEF较移植前增高11.6%(P<0.01),左室收缩末容积减少4.1ml(P<0.05),而对照组心室功能进一步恶化(LVEF从42.8%下降为35.9%,P<0.01),左室进一步扩张(左室舒张末容积从42.8±1.2ml进展为46.7±1.3ml,P<0.05)。病理组织学检查显示WJMSCs移植组梗死区心室壁厚度明显增厚,梗死边缘区血管密度明显增加。免疫荧光检测可见带有Myc标志的WJMSCs在梗死心肌内存活,且与心肌肌钙蛋白T、α-actin和Connexin-43共表达。结论经冠状动脉移植WJMSCs治疗猪慢性CIMP是安全、有效的。
华通氏胶;间质干细胞移植;冠状血管;心肌缺血
目前,急性心肌梗死(acute myocardial infarction,AMI)通过直接介入手术及药物溶栓等早期血运重建后,死亡率明显下降,但由于早期血管重建只能挽救顿抑冬眠心肌,而已经坏死的心肌必将被纤维结缔组织替代形成瘢痕,经历心室壁变薄、心室腔扩大的心室重构过程,部分患者将发展为慢性缺血性心肌病(chronic ischemia myocardiopathy,CIMP),以致目前缺血性心力衰竭的发病率及死亡率逐年升高[1],然而,迄今为止除心脏移植外,还无有效方法根本改变其预后[2]。
近年来随着细胞生物学的飞速进展,具有多向分化及自我更新能力的干细胞移植修复心肌的理念正在实现临床转化[3-5]。临床前研究已经证实,不同来源的间充质干细胞(mesenchymal stem cells,MSCs)移植到小鼠、大鼠及小型猪梗死心肌可以分化为心肌样细胞、内皮细胞,并与内源心肌细胞整合,明显缩小心肌梗死范围[6-9]。临床证据也表明,AMI患者经冠状动脉移植MSCs或自体骨髓单个核细胞(bone marrow mononuclear cells,BMMCs)可缩小心肌梗死范围,提高左室射血分数(LVEF),有效地预防心室重构[10-14]。然而遗憾的是,在临床研究中发现,老年人尤其是冠心病老年患者BMMSCs数量少,增殖能力低,使临床应用受到了很大限制[15-16]。显然,这给CIMP再生医学治疗带来了瓶颈式的障碍。
本课题组从新生儿脐带内一种特殊黏液状组织——华通胶(Wharton's jelly)中提取分离培养了一种远较成体BMMCs更原始的华通胶源间充质干细胞(Wharton's jelly derived mesenchymal stem cell,WJMSCs)[17]。WJMSCs具有独特的类似胚胎干细胞的原始干细胞生物学特性,增殖能力远远高于BMMSCs,且分泌细胞因子、生长因子的量远高于BMSCs[18-21]。本课题组对WJMSCs进行全基因微阵列分析发现,WJMSCs不仅表达多种胚胎干细胞标志基因,如OCT4、SSEA3、SSEA4、Nkx2.5、KLF4、FLK1、SOX2、NANOG、MYC、TERT、REX1、CRIPTO、DAPPA4、TRA-1-8、Isl-1,还可以高表达心肌前体细胞特异转录因子Isl-1、Nkx2.5、Flk1[17]。体外研究发现,在5-氮胞苷诱导下WJMSCs可分化为心肌样细胞[17]。本课题组的Ⅰ期临床试验结果显示,异体WJMSCs治疗慢性缺血性心力衰竭是安全的,无触发免疫反应[22]。然而,WJMSCs对慢性CIMP是否有治疗效果至今尚不清楚。因此本研究拟在小型猪心肌梗死后诱发的心力衰竭模型上,经冠状动脉移植WJMSCs,观察其对心肌修复、心功能改善的作用,并筛选WJMSCs的有效及安全剂量。
1 材料与方法
1.1 主要仪器及实验动物 彩色超声仪(便携式,美国Sonosite),大型X线机(FD20,荷兰PHILIPS),动脉鞘管、PTCA球囊导丝(美国Cordis),培养箱(371型,美国Thermo),超净工作台(SW-CJ-2FD,中国苏州净化),倒置显微镜(CKX-41,日本Olympus),电子天平(A1-204,瑞士梅特勒),流式细胞仪(EPICS XL/XL-MCL,美国Beckman Coulter),共聚焦激光扫描显微镜(TCS SP5,德国Leica Microsystems)。清洁级巴马小型猪购自北京科宇动物养殖中心,雌雄不限,体重25.7±2.3kg,月龄5.0±0.5个月,清洁环境喂养。
1.2 小型猪心肌梗死后CIMP模型的建立 参照本课题组既往的方法[23]。巴马小型猪29头,其中25头制作CIMP模型,其余4头为假手术(Sham)组。经肌内注射氯胺酮(5mg/kg)和速眠新(0.08ml/kg)诱导麻醉,将动物平卧于设有大型X线机的手术台上,右腹股沟部备皮,碘伏消毒,铺无菌巾,右腹股沟韧带下1cm穿刺股动脉,常规消毒铺巾,经右侧股动脉穿刺置入6F动脉鞘管,经股动脉弹丸式注入肝素钠2500U,然后每隔1h追加肝素钠1250U。采用冠脉指引导管行冠脉造影,造影后置入经皮冠状动脉腔内血管成形术(PTCA)球囊导丝,在导丝指引下置入2.5mm×20.0mm Mewerik球囊至前降支前中段交界处,以2~4atm(1atm=1.01×105Pa)充盈球囊,经缺血预适应3~4次,每次球囊充盈20s,间隔3~5min。以6~8atm充盈球囊堵塞冠脉,造影示球囊远端血流中断,球囊保持充盈90min,此间持续监测压力及电活动。术中根据肢体运动情况每隔1h左右重复肌内注射氯胺酮2ml+速眠新0.5ml,使猪保持麻醉状态,注意猪的呼吸情况,术后持续心电监测。术中发生室颤即予以电除颤,根据心律失常性质,酌情予阿托品或利多卡因等药物应用。术中至术后24h共死亡5头,其中术中2头猪因梗死范围大,发生泵衰竭死亡,1头死于顽固室颤;术后24h内死亡2头,疑死于室颤或心力衰竭。术后每天肌内注射青霉素160万U,连续3d。4头Sham组未进行球囊充盈,均存活。
术后10~12d行二维超声心动图检查,确定LVEF≤45%,左室腔舒张末直径(LVEDD)≥40mm 为CIMP模型建立成功。3头动物LVEF未达此标准,故除外,共17头成功。另4头小型猪设为假手术组即Sham组。
1.3 WJMSCs的分离、培养、鉴定 参照本课题组既往的方法[17]。孕检指标正常的产妇,剖腹产后无菌取出脐带,移至无菌培养皿中,用生理盐水冲洗去除血渍,将脐带剪成4cm长脐带段,加入生理盐水洗涤血凝块,直至基本去除血渍。剥离静脉,剔除脐带的两条动脉。分离位于羊膜与血管之间的白色结缔组织华通胶,使用眼科剪将华通胶剪成1mm3以下块状,移入75cm2培养瓶中,预先在培养瓶中加入8ml完全培养基,将培养瓶盖旋松,保证通气,放置于37℃、5%CO2、饱和湿度培养箱中培养。原代细胞组织块贴壁培养10~14d,WJMSCs从组织块中爬出,并快速分裂生长,当细胞达到80%融合时,弃培养基,用PBS轻轻洗涤2次,加入0.125%胰蛋白酶消化1.5min,WJMSCs收缩脱离瓶壁,加入含10%胎牛血清的培养基中和胰蛋白酶,使用移液管轻轻吹打,将WJMSCs悬液移入50ml离心管,再加入PBS洗涤2次,冲洗的细胞悬液均移入50ml离心管,100×g离心10min,弃上清;重新加入完全培养基重悬细胞,计数,按照0.8×106/75cm2培养瓶培养。WJMSCs培养2~4d后,细胞融合90%左右时开始传代培养。取第3代生长良好的WJMSCs,转染c-myc基因作为移植细胞标志。所用细胞外观、细胞浓度、存活率、细胞形态、MSCs纯度指标、生物学效力、特殊病毒检测、无菌实验检测、细菌内毒素检测等各项指标达国际细胞学会临床应用标准。
1.4 WJMSCs经冠状动脉移植术、剂量梯度研究及实验分组 动物麻醉同上,胸部及双侧腹股沟部备皮,术中根据肢体运动情况每隔1h左右重复肌内注射氯胺酮2ml+速眠新0.5ml,使猪保持麻醉状态,并注意猪的呼吸情况,同时进行心电监护,及时处理各种心律失常。6头小型猪(包括3头CIMP模型未成功及3头CIMP模型小型猪)常规穿刺右侧股动脉,进行冠状动脉造影、PTCA,在穿刺导丝球囊闭塞前降支条件下拔出导丝,经穿导丝球囊导管注入WJMSCs,剂量梯度为6×106、1×107、2×107,每一剂量分4次注入,每次容量1ml,气囊保持充盈1min,后恢复灌注2min,重复冠状动脉造影观察前向血流,对照均以生理盐水注入。经以上剂量梯度观察,各剂量组均无前向血流影响后,本研究决定采用最大剂量2×107个WJMSCs作为冠脉内注入剂量。余14头CIMP模型小型猪随机分为2组:WJMSCs移植组(CIMP+WJMSCs,n=7)及对照组(CIMP+saline,n=7)。采用本课题组既往研究的方法[16],经穿导丝球囊导管重复4次注入WJMSCs。对照组动物经导管注入同等容量生理盐水,步骤同WJMSCs移植组。手术完毕,拔除动脉鞘管,局部压迫止血,动物放回舍内,术后每天肌内注射青霉素160万U,持续3d,饲养2个月。
1.5 超声心动图检查 Sham组、WJMSCs移植组、对照组均手术前及术后2个月行超声心动图检查。探头频率为3.5MHz,可同步进行M型、2D动态显示,扫描速度为100mm/s。测量LVEDD、左室舒张末容积(LVEDV)、左室收缩末直径(LVESD)、左室收缩末容积(LVESV)、左室短轴缩短百分率(LVSF)、LVEF及梗死部位厚度(MIT)。
1.6 病理组织学检查 所有动物经超声心动图检查后,肌内注射氯胺酮(5mg/kg)和速眠新(0.08ml/kg),使猪处于麻醉状态,切开颈动脉抽血处死,取心脏左室,按WJMSCs移植组、对照组、Sham组及检测目的,分别置于10%甲醛固定,或立即置入液氮中保存,病理检查标本行常规行石蜡切片,HE染色,光镜检查。
1.7 免疫荧光染色 参照本课题既往的研究方法[24],WJMSCs移植组、对照组取左室以梗死部为核心、连续10μm厚度冰冻切片,分别应用心肌细胞特异标志TnT、α-actin、connexin-43单克隆抗体(1:200,Beijing Boisynthesis Biotechnology Co.,LTD)及WJMSCs标志Myc单克隆抗体(1:200,北京傲锐公司)染色,然后与荧光标记二抗(1:100,Beijing Boisynthesis Biotechnology Co.,LTD)染色。应用Leica Microsystems共聚焦显微镜摄取图像,获取图像后应用Leica共聚焦图像数字处理软件进行分析。
1.8 免疫功能检测 两组动物分别于治疗前及治疗后2个月处死前,静脉抽取6ml全血,其中3ml置于生化采血管中,3000r/min离心20min,取上清置于新离心管中,采用ELISA法进行IgG、IgM检测,另外3ml全血置于EDTA抗凝采血管中,混匀,采用流式细胞仪进行CD3、CD4、CD8检测。
1.9 统计学处理 采用SPSS 16.0软件进行统计分析。所有资料均以表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,组内移植前后比较进行配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 WJMSCs表型鉴定 WJMSCs呈梭形贴壁生长,表达CD44、CD73、CD90、CD105、HLAABC,不表达CD34、CD45及HLA-DR,可向脂肪、骨、软骨分化,符合国际干细胞学会MSCs标准(图1)。
2.2 经冠状动脉WJMSCs移植剂量安全性观察WJMSCs经冠状动脉注入剂量呈梯度增加(6×106、1×107、2×107),注入的相关冠状动脉前向血流TIMI均在3级,表明WJMSCs经冠状动脉注入最高剂量(2×107)未影响冠状动脉前向血流,未发生相关冠状动脉导流血管及微血管栓塞征象。2×107个WJMSCs经冠状动脉注入移植是安全的。
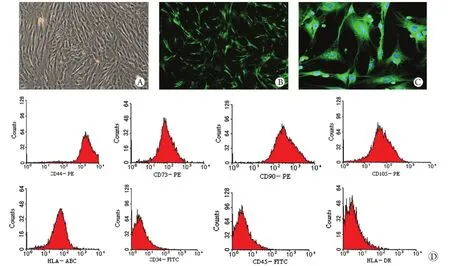
图1 WJMSCs表型特征Fig.1 Phenotypic characteristics of WJMSCsWJMSCs showed a homogeneous spindle-shaped morphology. A. Spindle-shaped WJMSCs adherent growth (×40); B. Spindle-shaped WJMSCs-transfected green fluorescent protein adherent growth (×40); C. Spindle-shaped WJMSCs-transfected green fluorescent protein adherent growth (×100); D. Immunophenotype of WJMSCs detected by flow cytometry. The WJ-MSCs positively expressed CD44, CD73, CD90, CD105, and human leukocyte antigen (HLA)-A, -B and -C, but not for CD34, CD45 and HLA-DR
2.3 WJMSCs移植对CIMP动物生存的影响 本研究在CIMP动物模型建立期,29头小型猪死亡5头,死亡发生率17.2%。治疗干预后,WJMSCs移植组7 头CIMP小型猪全部存活。对照组7头CIMP小型猪术后1个月内死亡1头,2个月内死亡1头,余5头存活,对照组2个月生存率为71.4%,与WJMSCs移植组差异有统计学意义(P<0.01)。
2.4 WJMSCs移植对左心室组织结构的影响 大体观察见对照组左室前壁塌陷,呈灰白色,全部为纤维瘢痕,而WJMSCs移植组左室前壁增厚,梗死部位室壁厚度较移植前增加,肉眼可见新生的红色血管。HE染色结果显示,WJMSCs移植组在梗死边缘区可见新生的心肌细胞(图2)。
2.5 WJMSCs移植再生心肌效应 携带Myc基因的WJMSCs经冠状动脉注入后2个月,经免疫荧光共聚焦检测,心肌内可见表达Myc标志的WJMSCs生长,并与心肌细胞特异标志TnT、α-actin、Connexin-43共表达,提示其特征性向心肌细胞分化(图3)。
2.6 WJMSCs移植对心功能的影响 如图4、表1所示,WJMSCs移植组治疗前后对比观察,左室腔直径明显缩小,左室壁运动明显改善,左室收缩速率明显增加(P<0.05),且LVEF明显增加(P<0.01),而LVESV、LVEDV均较治疗前明显缩小(P<0.05)。对照组左室腔进一步扩大,收缩功能进一步减低,LVESV、LVEDV进一步增加。两组间比较显示,WJMSCs移植组的左室腔大小、收缩功能、LVESV 及LVEDV均明显优于对照组。
2.7 WJMSCs移植对免疫功能的影响 WJMSCs移植组及对照组治疗前后对比,IgG、IgM、CD3、CD4、CD8差异无统计学意义(P>0.05)。WJMSCs移植组、对照组及Sham组比较,IgG、IgM、CD3、CD4、CD8差异亦无统计学意义(P>0.05,表2)。
3 讨 论
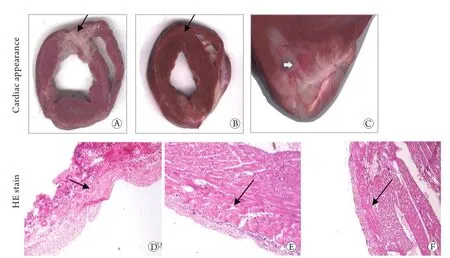
图2 WJMSCs移植对左心室组织结构的影响Fig.2 Effect of WJMSCs transplantation on left ventricular structureA. Wall scar in control group; B. Wall thickening in WJMSCs group; C. Small blood vessels increased after WJMSCs transplantation; D. Fibrous tissue formation in control group; E. WJMSCs transplantation instead of scar; F. New cardiac myocytes
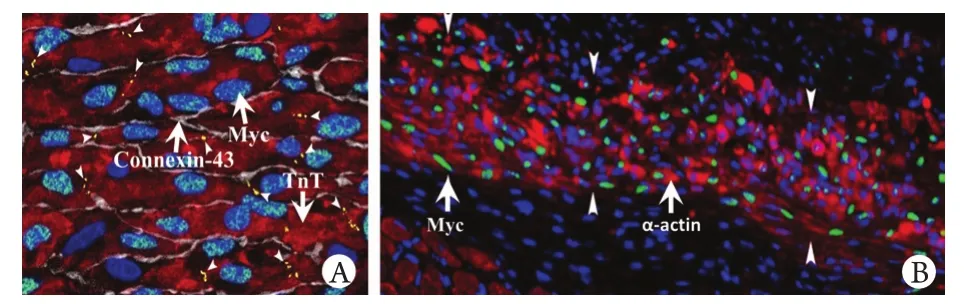
图3 免疫荧光共聚焦检测WJMSCs移植后的再生心肌效应Fig.3 Effect of WJMSCs transplantation on myocardium regeneration (Immunofluorescence)A. Coexpression of Myc, Connexin-43 and TnT in myocardium after Myc-WJMSCs coronary artery transplantation (×200); B. Coexpression of Myc and α-actin in myocardium after Myc-WJMSCs coronary artery transplantation (×100)
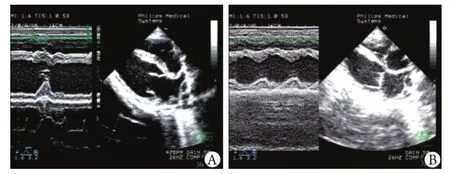
图4 WJMSCs移植前(A)后(B)的心肌室壁运动Fig.4 Ventricular wall movement before (A) and after (B) WJMSCs transplantation
表1 WJMSCs移植对CIMP动物心功能的影响(±s)Tab.1 Effect of WJMSCs transplantation on cardiac function of CIMP animals (±s)
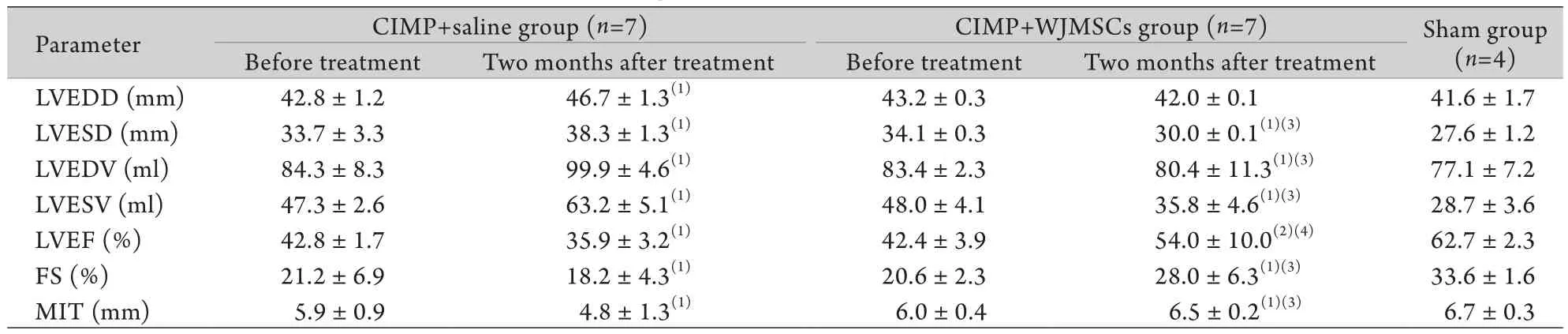
表1 WJMSCs移植对CIMP动物心功能的影响(±s)Tab.1 Effect of WJMSCs transplantation on cardiac function of CIMP animals (±s)
(1)P<0.05, (2)P<0.01 compared with before treatment; (3)P<0.05, (4)P<0.01 compared with CIMP+saline group
Parameter CIMP+saline group (n=7) CIMP+WJMSCs group (n=7) Sham group (n=4) Before treatment Two months after treatment Before treatment Two months after treatment LVEDD (mm) 42.8±1.2 46.7±1.3(1) 43.2±0.3 42.0±0.1 41.6±1.7 LVESD (mm) 33.7±3.3 38.3±1.3(1) 34.1±0.3 30.0±0.1(1)(3) 27.6±1.2 LVEDV (ml) 84.3±8.3 99.9±4.6(1) 83.4±2.3 80.4±11.3(1)(3) 77.1±7.2 LVESV (ml) 47.3±2.6 63.2±5.1(1) 48.0±4.1 35.8±4.6(1)(3) 28.7±3.6 LVEF (%) 42.8±1.7 35.9±3.2(1) 42.4±3.9 54.0±10.0(2)(4) 62.7±2.3 FS (%) 21.2±6.9 18.2±4.3(1) 20.6±2.3 28.0±6.3(1)(3) 33.6±1.6 MIT (mm) 5.9±0.9 4.8±1.3(1) 6.0±0.4 6.5±0.2(1)(3) 6.7±0.3
表2 WJMSCs移植对CIMP动物免疫功能影响(±s)Tab.2 Effect of WJMSCs transplantation on the immune function of CIMP animals (±s)
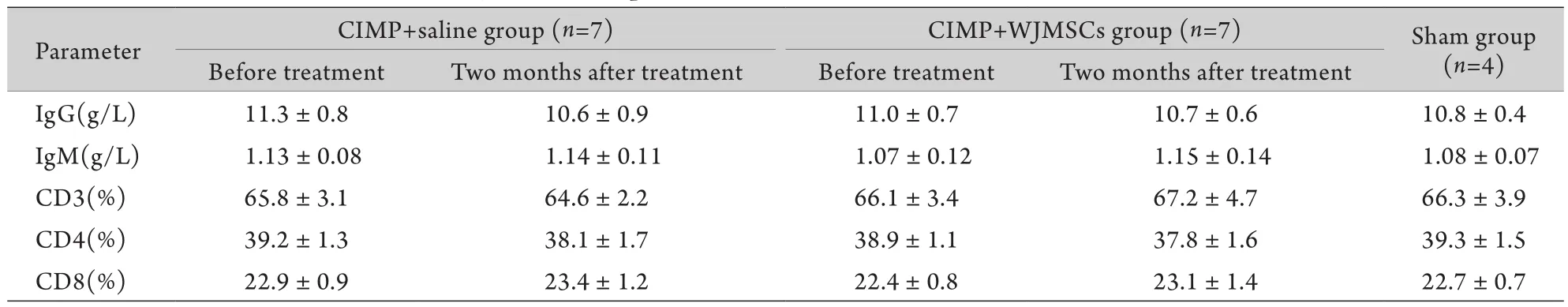
表2 WJMSCs移植对CIMP动物免疫功能影响(±s)Tab.2 Effect of WJMSCs transplantation on the immune function of CIMP animals (±s)
Parameter CIMP+saline group (n=7) CIMP+WJMSCs group (n=7) Sham group (n=4) Before treatment Two months after treatment Before treatment Two months after treatment IgG(g/L) 11.3±0.8 10.6±0.9 11.0±0.7 10.7±0.6 10.8±0.4 IgM(g/L) 1.13±0.08 1.14±0.11 1.07±0.12 1.15±0.14 1.08±0.07 CD3(%) 65.8±3.1 64.6±2.2 66.1±3.4 67.2±4.7 66.3±3.9 CD4(%) 39.2±1.3 38.1±1.7 38.9±1.1 37.8±1.6 39.3±1.5 CD8(%) 22.9±0.9 23.4±1.2 22.4±0.8 23.1±1.4 22.7±0.7
本研究在大动物CIMP模型上观察了WJMSCs经冠状动脉移植对其心肌再生及心功能改善的作用,结果显示2×107个WJMSCs经冠状动脉分4次灌注是安全的,无冠状动脉栓塞征象。在大动物CIMP模型上,应用Myc标记的WJMSCs在心肌内存活,并分化为表达心肌细胞特异标志TnT、α-actin、connexin-43阳性的心肌样细胞。与此一致的是,在心脏结构上可见梗死室壁增厚,形成新生小血管。在整体心功能上,WJMSCs移植后2个月,LVEF增加11.6%(54.0±10.0%),与移植前(42.4±3.9%,P<0.01)及对照组(35.9±3.2,P<0.01)比较均呈显著差异,而LVESV、LVEDV明显减低。WJMSCs治疗有效地逆转了心肌梗死后CIMP的心功能恶化及心室扩张。
目前,除了心脏移植外,尚无有效的治疗方法能从根本上改善CIMP的预后,而细胞生物学技术给CIMP的治疗带来了新的希望。近年来大量基础研究证据,以及临床研究的荟萃分析表明,骨髓单个核细胞及骨髓间充质干细胞治疗心肌梗死或慢性缺血性心力衰竭患者,可改善心功能,LVEF平均提高3.66%,显著改善了存活情况[3,6-9,14]。然而,临床研究发现老年人及冠心病患者骨髓干细胞数量少,增殖能力低[15-16]。虽然晚近研究发现Lin-c-kit+或Sca-1+自体心肌源干细胞可在体外诱导分化为心肌细胞、内皮细胞、平滑肌细胞[25],但Ⅰ期临床研究尚无一致性结纶。Makkar等[26]在17例陈旧性心肌梗死患者中经心肌活检取得心肌组织,经胶原酶消化后获得心肌球(98%表达CD105),经冠状动脉移植后6个月,LVEF、LVESV、LVEDV与对照组(8例)比较均无显著差异。Bolli等[27]取患者自体心肌组织,分离纯化c-kit阳性心肌干细胞治疗CIMP患者9例,4个月后LVEF提高8.2%(P=0.001)。然而,心肌源干细胞来源于自体,需有创性心肌活检获取少量心肌组织,而成年残存的心肌源干细胞数目很少,仅万分之一,需要体外较长期扩增,使其临床应用受到限制[26-27]。
因此,本研究从胚外组织——脐带华通胶中提取间充质干细胞作为治疗CIMP的种子细胞。本课题组既往研究及其他大量基础研究证实,WJMSCs较自体成体干细胞更原始,其细胞生物学特性更接近胚胎干细胞,理论上是良好的种子细胞。然而,WJMSCs是异基因干细胞,虽然本课题组既往研究已证实WJMSCs具有低免疫原性的特征[22],但此次在体内研究中再一次进行了免疫源性观察,结果显示WJMSCs移植后2个月细胞及体液免疫均未受到激活,未产生免疫应答反应,血CD3、CD4、CD8及IgG、IgM未见异常变化。
WJMSCs移植后能否在梗死心肌内存活是心脏再生医学的关键,本研究应用Myc标记WJMSCs,经免疫荧光抗体检测,在梗死心肌边缘可见Myc-WJMSCs阳性细胞生长,并与心肌细胞特异标志TnT、α-actin、Connexin-43共表达,表明WJMSCs在移植术后2个月仍存活,并可分化为心肌样细胞。与之一致的是,左室病理组织学观察显示在梗死纤维组织边缘区可见新生心肌细胞及小血管,梗死部位室壁较对照组明显增厚。以上发现与Lupu等[28]报道的WJMSCs可整合到小鼠心肌中,成功再生心肌组织是一致。也与Zhang等[29]在小型猪MI模型上发现的WJMSCs可分化为心肌细胞、内皮细胞,在梗死心肌内再生心肌组织相一致。
本研究虽未深入探讨WJMSCs的作用机制,但结果已再次证实WJMSCs治疗确实能显著改善心功能。其作用机制除上述WJMSCs再生心肌血管的效应外,考虑还与WJMSCs表达大量细胞因子、生长因子、生物活性肽有关[17]。近来较多研究发现这些生物因子在WJMSCs培养液及整体循环中均呈高水平表达,提示WJMSCs具有良好的旁/自分泌功能,可产生大量生物因子,动员及激活心脏本身干细胞及前体细胞的分裂增殖,替代坏死心肌,协同促进心脏功能的恢复。尤其突出的是,WJMSCs移植不仅可再生冠状小血管,而且释放大量血管内皮生长因子、肝细胞生长因子、成纤维生长因子等,直接促进冠状动脉小血管的新生[30-31]。
总之,本临床前研究证实,在机体心脏慢性缺血及功能衰竭状态下,移植WJMSCs修复心肌及改善心功能是安全和有效的。WJMSCs独特的优点,如远较自体间充质干细胞具有更原始的生物学特性,良好的再生潜能及旁/自分泌效应,特有的免疫调节功能,低免疫原性,无创性取材,统一制备标准,产品化备用,选用标准剂量等,可为CIMP治疗提供良好的种子细胞,值得进一步进行临床试验以证实以上发现。
[1]Yeh RW, Sidney S, Chandra M,et al. Population trends in the incidence and outcomes of acute myocardial infarction[J]. N Engl J Med, 2010, 362(23): 2155-2165.
[2]Lindvall O, Hyun I. Medical innovation versus stem cell tourism[J]. Science, 2009, 324(5935): 1664-1665.
[3]Rosenzweig A. Cardiac regeneration[J]. Science, 2012, 338(6114): 1549-1550.
[4]Miao ZC, Gao H. Effect of transplantation of BMP-2-induced bone marrow mesenchymal stem cells on myocardial infarction of rats after reperfusion[J]. Med J Chin PLA, 2014, 39(8): 601-608.[苗忠澄, 高航. BMP-2预诱导骨髓间充质干细胞移植治疗大鼠再灌注后心肌梗死的实验研究[J]. 解放军医学杂志, 2014, 39(8): 601-608.]
[5]Wei XW, Zhang XG, Yang L. Effect of induced pluripotent stem cell transplantation on Q-T interval of acute myocardiac infarction rats[J]. Med J Chin PLA, 2011, 36(11): 1178-1182.[魏新伟, 张晓刚, 杨梁. 诱导多能干细胞移植对急性心肌梗死小鼠Q-T间期的影响[J]. 解放军医学杂志, 2011, 36(11): 1178-1182.]
[6]Toma C, Pittenger MF, Cahill KS,et al. Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart[J]. Circulation, 2002, 105(1): 93-98.
[7]Vela DC, Silva GV, Assad JA,et al. Histopathological study of healing after allogenic mesenchymal stem cell delivery in myocardial infarction in dogs[J]. J Histochem Cytochem, 2009, 57(2): 167-176.
[8]Perin EC, Tian M, Marini FC 3rd,et al. Imaging long-term fate of intramyocardially implanted mesenchymal stem cells in a porcine myocardial infarction model[J]. PLoS One, 2011, 6(9): e22949.
[9]Williams AR, Hare JM. Mesenchymal stem cells: biology, pathophysiology, translational findings, and therapeutic implications for cardiac disease[J]. Circ Res, 2011, 109(8): 923-940.
[10] Schächinger V, Erbs S, Elsässer A,et al. Intracoronary bone marrow-derived progenitor cells in acute myocardial infarction[J]. N Engl J Med, 2006, 355(12): 1210-1221.
[11] Meyer GP, Wollert KC, Lotz J,et al. Intracoronary bone marrow cell transfer after myocardial infarction: eighteen months' follow-up data from the randomized, controlled BOOST (BOne marrOw transfer to enhance ST-elevation infarct regeneration) trial[J]. Circulation, 2006, 113(10): 1287-1294.
[12] Gao LR, Chen Y, Zhang NK,et al. Intracoronary infusion of Wharton's jelly-derived mesenchymal stem cells in acute myocardial infarction: double-blind, randomized controlled trial[J]. BMC Med, 2015, 13: 162.
[13] Hare JM, Traverse JH, Henry TD,et al. A randomized, doubleblind, placebo-controlled, dose-escalation study of intravenous adult human mesenchymal stem cells (prochymal) after acute myocardial infarction[J]. J Am Coll Cardiol, 2009, 54(24): 2277-2286.
[14] Jeevanantham V, Butler M, Saad A,et al. Adult bone marrow cell therapy improves survival and induces long-term improvement in cardiac parameters a systematic review and meta-analysis[J]. Circulation, 2012, 126(5): 551-568.
[15] Fan M, Chen W, Liu W,et al. The effect of age on the efficacy of human mesenchymal stem cell transplantation after a myocardial infarction[J]. Rejuvenation Res, 2010, 13(4): 429-438.
[16] Gao LR, Pei XT, Ding QA,et al. A critical challenge: dosagerelated efficacy and acute complication intracoronary injection of autologous bone marrow mesenchymal stem cells in acute myocardial infarction[J]. Int J Cardiol, 2013, 168(4): 3191-3199.
[17] Gao LR, Zhang NK, Ding QA,et al. Common expression of stemness molecular markers and early cardiac transcription factors in Wharton's jelly-derived mesenchymal stem cells[J]. Cell Transplant, 2013, 22(10): 1883-1900.
[18] Wang HS, Hung SC, Peng ST,et al. Mesenchymal stem cells in the Wharton's jelly of the human umbilical cord[J]. Stem Cells, 2004, 22(7): 1330-1337.
[19] Troyer DL, Weiss ML. Wharton's jelly-derived cells are a primitive stromal cell population[J]. Stem Cells, 2008, 26(3): 591-599.
[20] Karahuseyinoglu S, Cinar O, Kilic E,et al. Biology of stem cells in human umbilical cord stroma:in situandin vitrosurveys[J]. Stem Cells, 2007, 25(2): 319-331.
[21] Kim DW, Staples M, Shinozuka K,et al. Wharton's jelly-derived mesenchymal stem cells: phenotypic characterization and optimizing their therapeutic potential for clinical applications[J]. Int J Mol Sci, 2013, 14(6): 11692-11712.
[22] Chen HY, Zhang NK, Li T,et al. Human umbilical cord Wharton's jelly stem cells: Immune property genes assay and effect of transplantation on the immune cells of heart failure patients[J]. Cell Immunol, 2012, 276(1-2): 83-90.
[23] Gao LR, Zhu ZM, He S,et al. Percutaneous epicardial bone marrow mononuclear cell transplantation for the treatment of severe ischemic heart failure in pigs[J]. Acad J Sec Mil Med Univ, 2004, 25(9): 940-944. [高连如, 朱智明, 贺声, 等. 经皮穿刺心外膜骨髓单个核细胞移植治疗猪严重缺血性心力衰竭[J]. 第二军医大学学报, 2004, 25(9): 940-944.]
[24] Gao LR, Zhang NK, Bao J,et al. The apelin-APJ pathway exists in cardiomyogenic cells derived from mesenchymal stem cellsin vitroandin vivo[J]. Cell Transplant, 2010, 19(8): 949-958.
[25] Johnston PV, Sasano T, Mills K,et al. Engraftment, differentiation, and functional benefits of autologous cardiosphere-derived cells in porcine ischemic cardiomyopathy[J]. Circulation, 2009, 120(12): 1075-1083.
[26] Makkar RR, Smith RR, Cheng K,et al. Intracoronary cardiosphere- derived cells for heart regeneration after myocardial infarction (CADUCEUS): a prospective, randomised phase 1 trial[J]. Lancet, 2012, 379(9819): 895-904.
[27] Bolli R, Chugh AR, D'Amario D,et al. Cardiac stem cells in patients with ischaemic cardiomyopathy (SCIPIO): initial results of a randomised phase 1 trial[J]. Lancet, 2011, 378(9806): 1847-1857.
[28] Lupu M, Khalil M, Andrei E,et al. Integration properties of Wharton's jelly-derived novel mesenchymal stem cells into ventricular slices of murine hearts[J]. Cell Physiol Biochem, 2011, 28(1): 63-76.
[29] Zhang W, Liu XC, Yang L,et al. Wharton's jelly-derived mesenchymal stem cells promote myocardial regeneration and cardiac repair after miniswine acute myocardial infarction[J]. Coron Artery Dis, 2013, 24(7): 549-558.
[30] Fong CY, Chak LL, Biswas A,et al. Human Wharton's jelly stem cells have unique transcriptome profiles compared to human embryonic stem cells and other mesenchymal stem cells[J]. Stem Cell Rev, 2011, 7(1): 1-16.
[31] Sobolewski K, Mafkowski A, Bańkowski E,et al. Wharton's jelly as a reservoir of peptide growth factors[J]. Placenta, 2005, 26(10): 747-752.
Intracoronary infusion of Wharton’s jelly derived mesenchymal stem cells in the treatment of chronic ischemia cardiomyopathy in porcine model
ZHANG Ning-kun, CHEN Yu, WANG Zhi-guo, LI Jun-feng, WANG Li-hua, ZHU Zhi-ming, WANG Li, GAO Lian-ru*
Department of Cardiology, Navy General Hospital, Beijing 100048, China
*< class="emphasis_italic">Corresponding author, E-mail: lianru666@163.com
, E-mail: lianru666@163.com
This work was supported by the National High Technology Research and Development Program of China (863 Program) (2013AA020101) and the National Natural Science Foundation of China (81170094)
ObjectiveTo investigate the safety and efficacy of transplantation of allogeneic Wharton's jelly-derived mesenchymal stem cells (WJMSCs) in a porcine model of chronic ischemia cardiomyopathy.MethodsCardiomyopathy models (CIMP) were reproduced in 25 minipigs out of 29 by left anterior descending coronary artery balloon occlusion, and the 4 remains served as sham group. The left ventricular ejection fraction (LVEF) was detected by echocardiography, and the value ≤45% was defined as successful modeling. Of that 25 minipigs, 5 died, 3 failed of modeling and 17 remains were successfully modelled. The dose safety experiment of WJMSCs transplantation was firstly performed in 3 successful models and 3 failed models. Three doses were tested in turn at 6×106, 1×107and 2×107with 1 successful and 1 failed model for each dose, and TIMI 3 was considered safety dosage. The remainder 14 CIMP models were randomly assigned to transplantation group and control group (7 each), and given 2×107WJMSCs intracoronary infusion or equal amounts of normal saline respectively. Echocardiography, histopathology and immunofluorescence tests were performed 8 weeks after WJMSCs transplantation.ResultsLVEF increased by 11.6% (P<0.01) and the left ventricular end systolic volume decreased by 4.1ml (P<0.05) in CIMP models 8 weeks after WJMSCs transplantation, while in control group the ventricular function further deteriorated (LVEF decreased from 42.8% to 35.9%,P<0.01) and the left ventricular further expanded [left ventricular end diastolic volume (LVEDV) increased from 42.8±1.2ml to 46.7±1.3ml (P<0.05)].Histopathological assessment showed that the ventricular wall in the infarction area was significantly thickening and the vascular density in the border zone was obviously increased in transplantation group. Immunofluorescence test revealed that the injected Myc-WJMSCs survived in the immunocompetent host heart, and colocalized with cardiac troponin T, α-actin and connexin-43.ConclusionIntracoronary infusion of WJMSCs is safe and effective in treatment of ischemia cardiomyopathy in a porcine model.
Wharton jelly; mesenchymal stem cell transplantation; coronary vessels; myocardial ischemia
R542.2
A
0577-7402(2015)11-0885-07
10.11855/j.issn.0577-7402.2015.11.06
2015-08-31;
2015-10-08)
(责任编辑:张小利)
国家863计划项目(2013AA020101),国家自然科学基金(81170094)
张宁坤,主管技师。主要从事干细胞的基础与临床研究
100048 北京 海军总医院心脏中心(张宁坤、陈宇、王志国、李俊风、王丽华、朱智明、王力、高连如)
高连如,E-mail:lianru666@163.com
