大蒜素对D-半乳糖致衰老模型大鼠学习记忆能力及脑组织氧化应激相关蛋白的影响
2015-06-28于洋徐冶刘师兵李松岩曾林川
于洋,徐冶,刘师兵,李松岩,曾林川
论 著
大蒜素对D-半乳糖致衰老模型大鼠学习记忆能力及脑组织氧化应激相关蛋白的影响
于洋,徐冶,刘师兵,李松岩,曾林川
目的观察大蒜素对D-半乳糖致衰老大鼠脑部衰老的影响,并从氧化应激通路入手探讨其中可能的机制。方法取50只雄性SD大鼠作为研究对象,随机分为5组(n=10):正常组(C组)、D-半乳糖组(D组)和大蒜素组,其中大蒜素组按剂量分为低剂量组(L组)、中剂量组(M组)和高剂量组(H组)。D、L、M、H组按大鼠体重以125mg/kg的剂量皮下注射D-半乳糖生理盐水溶液,C组皮下注射同体积生理盐水对照,每日8:00注射1次。同时,L、M和H组分别腹腔注射10、20和40mg/kg大蒜素注射液,C组和D组以同体积生理盐水作对照处理,每日20:00注射1次,所有大鼠均持续注射6周。通过行为学实验,观察各组大鼠学习记忆能力。处死后取各组大鼠脑组织:检测丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性及总抗氧化力(T-AOC);另取部分脑组织:固定包埋后石蜡切片,采用免疫组织化学法观察海马区凋亡相关蛋白Bax和Bcl-2的表达。结果行为学实验结果显示,与C组比较,D组大鼠学习记忆能力明显下降,而大蒜素干预的各组大鼠记忆能力有所增强。与C组比较,D组大鼠脑组织匀浆中MDA含量升高(P<0.05),SOD活性下降(P<0.05),T-AOC下降(P<0.05),大蒜素干预的各组大鼠较D组MDA含量下降(P<0.05),SOD活性增强(P<0.05),T-AOC上升(P<0.05),且呈现一定的剂量效应关系。免疫组化结果显示,与C组比较,D组Bax表达明显增加(P<0.05),Bcl-2表达明显减弱(P<0.05),大蒜素干预的L、M、H组大鼠Bax表达较D组呈减弱趋势,Bcl-2表达较D组呈增强趋势,但结果并无统计学意义。结论大蒜素可改善D-半乳糖致衰老大鼠的学习记忆能力,提高脑组织匀浆中SOD活性,降低MDA含量,增强脑组织总抗氧化力,并减轻衰老大鼠脑海马区细胞凋亡。
大蒜素;衰老;脑;氧化应激;凋亡
随着我国人口老龄化形势日趋严峻,由衰老所致脑功能性记忆减退甚至阿尔茨海默病等疾病发病率逐年上升[1]。如何对抗脑部功能衰老成为各国科学家们关心的课题[2-3]。目前,体内高氧化应激状态可导致衰老的观点得到较为广泛的认同[4-5]。当生物体处于过氧化状态时,能够诱导细胞凋亡或自噬,进而导致系统功能失调甚至丧失[6-8]。纠正这种过氧化状态,有利于保护衰老机体器官的结构和功能。大量研究表明,大蒜素具有较好抗菌、调血脂、降血糖、抗肿瘤、抗衰老等多种功能[9-12]。但有关其对衰老大脑作用的研究尚不充分。本实验以D-半乳糖复制经典大鼠衰老模型,用不同剂量的大蒜素注射液腹腔注射,以行为学实验判断大鼠学习记忆能力的变化,并检测各组大鼠脑组织匀浆内丙二醛(malondialdehyde,MDA)含量、超氧化物歧化酶(superoxide dismutase,SOD)活性及总抗氧化力(total antioxidant capacity,T-AOC),免疫组化法检测大鼠大脑海马区凋亡蛋白Bax、Bcl-2的表达,观察大蒜素对大鼠脑部衰老的影响并探讨可能的机制。
1 材料与方法
1.1 材料 雄性SD大鼠50只,体重200~220g,购于吉林大学实验动物中心。D-半乳糖(Sigma,美国),大蒜素注射液(广东罗浮山国药股份有限公司),生理盐水(吉林省康乃尔药业有限公司),MDA检测试剂盒、SOD活性检测试剂盒及T-AOC检测试剂盒(南京建成生物工程研究所)。一抗、二抗均购自Santa Cruz公司产品(美国);二步法免疫组化检测试剂(北京中杉金桥)。Morris水迷宫视频跟踪系统(成都仪器厂)。大鼠避暗仪及大鼠跳台测试仪(成都泰盟软件技术有限公司)。
1.2 实验动物分组与衰老模型建立 雄性SD大鼠50只,按体重随机均分为5组(n=10):即正常组(C 组)和D-半乳糖组(D组)、低剂量大蒜素组(L组)、中剂量大蒜素组(M组)、高剂量大蒜素组(H组)。D、L、M、H组按大鼠体重以125mg/kg的剂量皮下注射D-半乳糖生理盐水溶液,C组皮下注射同体积生理盐水作为对照,每日8:00注射1次,持续6周,各组均以普通饲料喂养,建立衰老模型[13]。注射D-半乳糖的同时,L、M和H组分别以10、20mg/kg 和40mg/kg剂量腹腔注射大蒜素注射液,C组和D组腹腔注射同体积生理盐水作对照处理,每日20:00注射1次,持续6周。
1.3 Morris水迷宫实验 在Morris水迷宫水池装置中加入适量豆浆,使水池呈现不透明的乳白色,控制水温30±2℃,实验过程中保持环境安静,避免移动迷宫周围的物品及改变室内灯光亮度。将平台放置于离迷宫正中心15cm的预定位置,作为大鼠入水后的搜索目标。实验共进行7d,前6d为定位航行实验,考察大鼠在水迷宫中的学习和记忆功能。主要方法是:在水池边选取与平台等距的3个入水点。将大鼠从入水点轻轻放入水中,由自动摄像系统记录大鼠寻找平台的时间(即逃避潜伏期),设定60s为最长逃避潜伏期[14],如果60s内未找到平台,由实验者将其引至平台,记录该次逃避潜伏期为60s,每次测试结束后,让大鼠在平台上停留30s,再次进行测试,每只大鼠共测试6d,3次/d,记录并计算每只大鼠每天3次潜伏期的平均值,主要考察其在水迷宫中的学习和记忆功能。实验第7天为空间探索实验,撤去平台,选取任一入水点,将大鼠从入水点轻轻地放入水中,记录大鼠入水后60s内的游泳路径,分析游泳轨迹及经过原平台区域次数,主要用于观察大鼠记忆保持能力[15]。
1.4 避暗反应实验 实验前先将大鼠放入避暗仪反应箱中训练5min,正式测试开始时将大鼠背对洞口放入明室,大鼠进入暗室则受到交流电电击,避暗仪自动记录5min内大鼠进入暗室的次数(即错误次数)和首次进入暗室前在明室的停留时间(即避暗潜伏期)。共测试7d,记录5min内错误次数和避暗潜伏期,将每只大鼠7次结果的均值进行统计分析[16]。
1.5 跳台实验 将大鼠放入大鼠跳台反应箱的台上、台下适应3min后,将其放置在反应箱内的铜栅上,立即通以交流电,其正常反应是跳回平台(绝缘体)以躲避伤害性刺激。多数大鼠会再次或多次跳回至铜栅上,受到电击又迅速跳回平台上。训练一次后,将大鼠放在反应箱内的平台上,记录3min内各鼠跳下平台的错误次数和第一次跳下平台前的停留时间(即逃避潜伏期),以此作为评价其学习能力的指标,共测试7d。如果大鼠在3min内未跳下平台,则其潜伏期以180s记,将每只大鼠7次结果的均值进行统计分析[17]。
1.6 大鼠脑组织匀浆相关氧化指标的测定 处死大鼠后迅速剥离其脑组织,取大脑左半球准确称重,按重量体积比1:10加入4℃预冷的生理盐水制成组织匀浆液,进行蛋白标定后,严格按照南京建成公司相应试剂盒操作步骤测定MDA含量、SOD活性和T-AOC。大脑右半球多聚甲醛固定后石蜡包埋,常规制备石蜡切片,严格按照北京中杉金桥生物技术有限公司免疫组化试剂盒步骤检测大鼠脑海马区凋亡蛋白Bax、Bcl-2表达。对图像进行灰度分析并随机取10个视野灰度值进行统计学分析。
1.7 统计学处理 应用SPSS 13.0软件进行统计学分析,计量资料以表示,组间样本均数比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 Morris水迷宫实验 定位航行实验结果显示,与C组比较,D组大鼠潜伏期明显延长(P<0.05),大蒜素各组潜伏期较D组明显缩短(P<0.05)。空间探索实验发现,与C组比较,D组大鼠经过平台次数明显减少(P<0.05),而大蒜素各组与D组比较,经过平台次数增多(P<0.05,表1)。
表1 大鼠Morris水迷宫实验结果(±s,n=10)Tab. 1 Results of Morris Water Maze test in rats (±s,n=10)
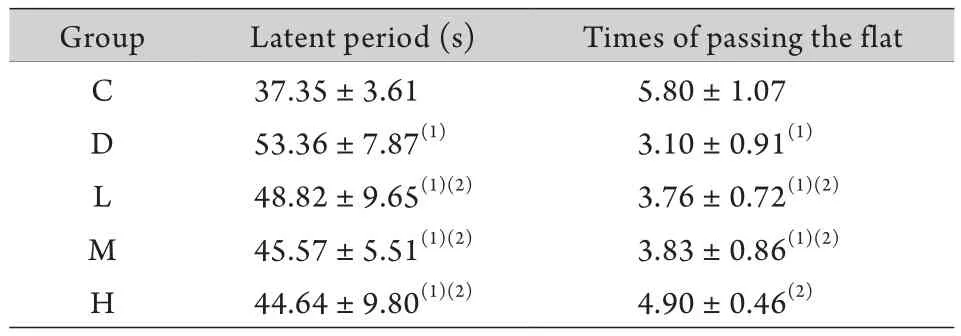
表1 大鼠Morris水迷宫实验结果(±s,n=10)Tab. 1 Results of Morris Water Maze test in rats (±s,n=10)
(1)P<0.05 compared with group C; (2)P<0.05 compared with group D
Group Latent period (s) Times of passing the flat C 37.35±3.61 5.80±1.07 D 53.36±7.87(1) 3.10±0.91(1)L 48.82±9.65(1)(2) 3.76±0.72(1)(2)M 45.57±5.51(1)(2) 3.83±0.86(1)(2)H 44.64±9.80(1)(2) 4.90±0.46(2)
2.2 避暗反应实验 D组较C组大鼠避暗潜伏期明显缩短,错误次数明显增加(P<0.05)。与D组比较,大蒜素干预各组潜伏期延长,错误次数减少(P<0.05,表2)。
表2 大鼠避暗反应实验结果(±s,n=10)Tab. 2 Results of step-through Avoiding Dark Reaction test in rats (±s,n=10)
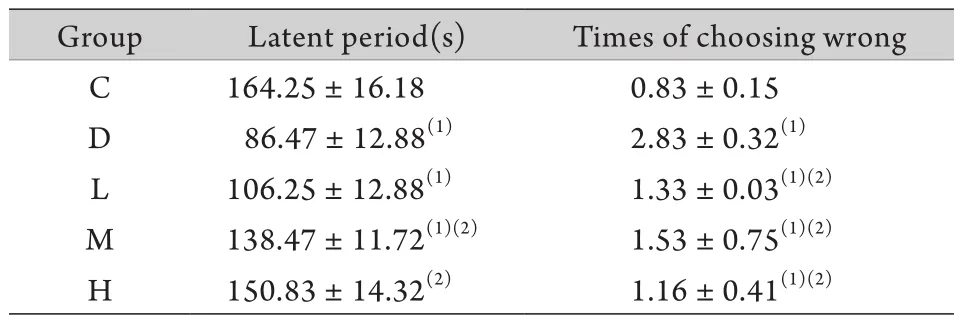
表2 大鼠避暗反应实验结果(±s,n=10)Tab. 2 Results of step-through Avoiding Dark Reaction test in rats (±s,n=10)
(1)P<0.05 compared with group C; (2)P<0.05 compared with group D
Group Latent period(s) Times of choosing wrong C 164.25±16.18 0.83±0.15 D 86.47±12.88(1) 2.83±0.32(1)L 106.25±12.88(1) 1.33±0.03(1)(2)M 138.47±11.72(1)(2) 1.53±0.75(1)(2)H 150.83±14.32(2) 1.16±0.41(1)(2)
2.3 跳台实验 跳台实验结果显示,与C组比较,D组大鼠的潜伏期缩短且错误次数明显增加(P<0.05)。与D组比较,大蒜素干预各组大鼠的潜伏期延长,错误次数减少(P<0.05,表3)。
表3 大鼠跳台实验结果(±s,n=10)Tab. 3 The results of step down tests in rats (±s,n=10)
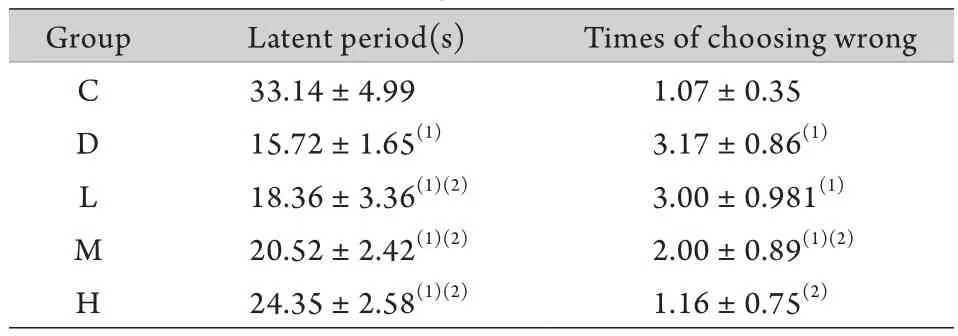
表3 大鼠跳台实验结果(±s,n=10)Tab. 3 The results of step down tests in rats (±s,n=10)
(1)P<0.05 compared with group C; (2)P<0.05 compared with group D
Group Latent period(s) Times of choosing wrong C 33.14±4.99 1.07±0.35 D 15.72±1.65(1) 3.17±0.86(1)L 18.36±3.36(1)(2) 3.00±0.981(1)M 20.52±2.42(1)(2) 2.00±0.89(1)(2)H 24.35±2.58(1)(2) 1.16±0.75(2)
2.4 MDA含量、SOD活性及T-AOC测定 与C组比较,D组大鼠脑组织匀浆中MDA含量明显升高(P<0.05),SOD活性明显下降(P<0.05),T-AOC明显降低(P<0.05)。与D组比较,大蒜素组脑组织匀浆中MDA含量减少(P<0.05),SOD活性明显升高(P<0.05),T-AOC有所提升(表4)。
表4 大鼠脑组织中MDA含量以及SOD和T-AOC的活性(±s,n=10)Tab. 4 Content of MDA, activity of SOD and T-AOC in brain tissue of rats (±s,n=10)
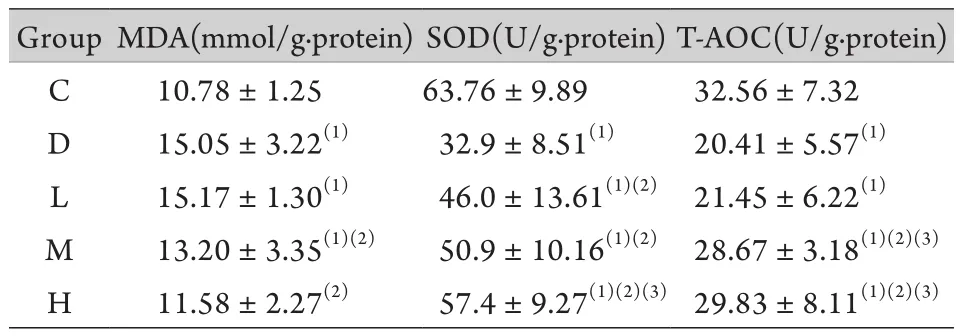
表4 大鼠脑组织中MDA含量以及SOD和T-AOC的活性(±s,n=10)Tab. 4 Content of MDA, activity of SOD and T-AOC in brain tissue of rats (±s,n=10)
(1)P<0.05 compared with group C; (2)P<0.05 compared with group D; (3)P<0.05 compared with group L
Group MDA(mmol/g·protein)SOD(U/g·protein)T-AOC(U/g·protein) C 10.78±1.25 63.76±9.89 32.56±7.32 D 15.05±3.22(1) 32.9±8.51(1) 20.41±5.57(1)L 15.17±1.30(1) 46.0±13.61(1)(2) 21.45±6.22(1)M 13.20±3.35(1)(2) 50.9±10.16(1)(2) 28.67±3.18(1)(2)(3)H 11.58±2.27(2) 57.4±9.27(1)(2)(3)29.83±8.11(1)(2)(3)
2.5 大鼠海马区Bax及Bcl-2的表达 由图1可见,D组大鼠海马区Bax表达较C组增强,各大蒜素干预组中,Bax表达比D组有所减弱。Bcl-2表达则与之相反,在C组表达最强,D组最弱,大蒜素干预组表达强于D组而弱于C组。D组大鼠脑部海马区Bax表达明显强于C组(P<0.05),而Bcl-2表达较C组明显减弱(P<0.05),给药后中、高剂量大蒜素组Bax表达弱于D组(P<0.05),而低、中和高剂量组大鼠海马区Bcl-2表达均较D组增强(P<0.05,图2)。
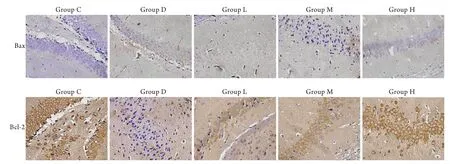
图1 大鼠海马区Bax和Bcl-2表达的免疫组化检测结果(DAB×200)Fig. 1 Expressions of Bax and Bcl-2 in hippocampus of rats (Immunohistochemistry staining, DAB×200)
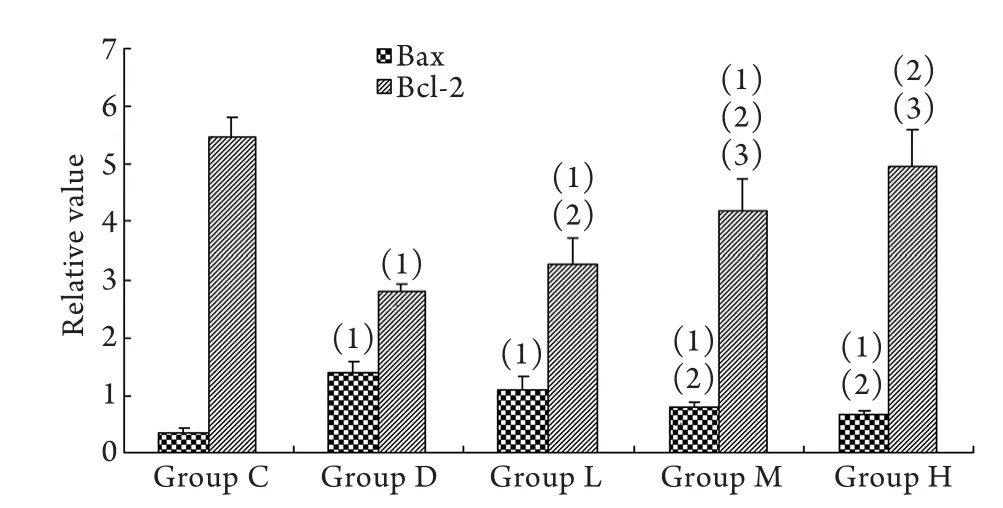
图2 大鼠海马区Bax、Bcl-2表达情况Fig. 2 Expressions of Bax and Bcl-2 in hippocampus of rats(1)P<0.05 compared with group C; (2)P<0.05 compared with group D; (3)P<0.05 compared with group L
3 讨 论
通过Morris水迷宫、避暗反应实验和鼠跳台实验系列行为学实验发现,大蒜素能够增强衰老大鼠记忆及学习能力,并呈现一定的剂量效应关系。目前,有研究发现细胞代谢过程中产生的大量具有强氧化性的自由基是引起机体衰老的主要因素之一[18],正常情况下,体内的抗氧化能力与氧化能力保持动态平衡[19],本实验通过对MDA、SOD及T-AOC系列氧化指标检测发现D-半乳糖致衰老大鼠脑部处于过氧化状态,大蒜素干预后,情况有所纠正。过氧化状态带来氧化指标改变的同时,也会导致相应组织器官细胞凋亡、坏死、自噬等方面的变化[20],本实验通过观察各组大鼠脑海马区凋亡蛋白Bcl-2、Bax的表达情况,发现D组大鼠相较于C组Bcl-2表达减弱,Bax表达增强,大蒜素干预组相较于D组则Bcl-2表达明显升高,Bax表达减少,一般认为Bcl-2可以通过结合并失活促凋亡家族成员中具有破坏线粒体膜完整性功能的Bax蛋白来调控凋亡,当Bcl-2磷酸化或受凋亡因素刺激时,Bcl-2与Bax蛋白结合的亲和力改变,Bax可从其与Bcl-2的结合体中释放出来,异位到线粒体,发挥其促凋亡的功能[21],实验结果提示D-半乳糖致衰老大鼠Bcl-2蛋白家族介导的线粒体凋亡通路激活,导致衰老组大鼠脑海马区细胞凋亡,而大蒜素有效改变了该通路关键蛋白的表达,从而抑制衰老大鼠海马区细胞的凋亡,减缓衰老脑部功能的下降。综合上述三方面指标我们可以得出结论:D-半乳糖致衰老大鼠的脑部学习记忆能力有明显下降,脑组织处于过氧化应激状态,海马区细胞线粒体凋亡途径激活,大蒜素的干预能明显降低脑部过氧化水平,减轻海马区脑细胞凋亡,增强衰老大鼠的学习记忆能力,说明大蒜素能够较好地缓解衰老大鼠脑部功能的减退,且这种作用很有可能是通过降低衰老大鼠脑部氧化应激水平并减少大脑主要记忆功能区——海马区脑细胞的凋亡得以最终实现的。
[1]Qiu CX, Xu WL, Winblad B. Vascular risk profiles for dementia and Alzheimer's disease in very old people: a population-based study[J]. J Alzheimers Dis, 2010, 20(1): 293-300.
[2]Liang CR, Liu YH, Wang YR,et al. Correlation between serum inflammatory factor levels and cognitive function in patients with Alzheimer's disease[J]. Med J Chin PLA, 2014, 39(2): 133-137. [梁春荣, 刘雨辉, 王叶冉, 等. 阿尔茨海默病患者外周血炎症因子水平与认知功能的相关性研究[J]. 解放军医学杂志, 2014, 39(2): 133-137.]
[3]Du YH, Xu ML, He GQ,et al. Distribution and expression of MKP-1 in the brain of APP/PS1 double-transgenic mice[J]. Med J Chin PLA, 2014, 39(11): 859-863. [杜烨鸿, 徐明亮, 贺桂琼, 等. MKP-1在APP/PS1双转基因小鼠脑内的分布及表达[J].解放军医学杂志, 2014, 39(11): 859-863.]
[4]Sohal RS. Role of oxidative stress and protein oxidation on the aging process[J]. Free Radic Biol Med, 2002, 33(1): 37-44.
[5]Zhang LB, Huang SH, Ma GL,et al. The effect of oxidative stress to aging mice induced by D-galactose[J]. Chin J Gerontol, 2010, 30(11): 1527-1529.[张林波, 黄帅, 马广丽, 等. 氧化应激对D-半乳糖致衰老小鼠的影响[J]. 中国老年学杂志, 2010, 30(11): 1527-1529.]
[6]Zhang WJ, Cui LY, Zhang J. Autophagy and ischemia/reperfusion injury[J]. Lab Med, 2014, 29(2): 182-185.[张文静, 崔丽艳, 张捷. 自噬与缺血再灌注损伤[J]. 检验医学, 2014, 29(2): 182-185.]
[7]Dai JY, Zhang XC, Yang WL,et al. Research progresses of apoptosis and autophagy induced by ER stress[J]. Chin J Exp Surg, 2012, 29(7): 1419-1420.[代景友, 张新晨, 杨维良, 等. 内质网应激介导的细胞自噬与凋亡研究进展[J]. 中华实验外科杂志, 2012, 29(7): 1419-1420.]
[8]Xue Q, Ma L, Zhu QL,et al. The effect of lowering of antioxidation capability on myocardium in rats with pneumonia[J]. Med J Chin PLA, 2003, 28(10): 911-913.[薛桥, 马路, 朱庆磊, 等. 抗氧化能力降低对肺炎小鼠心肌的损伤[J]. 解放军医学杂志, 2003, 28(10): 911-913.]
[9]Mei SW, Zhu HZ. Research advances in allicin[J]. Chin Agri Sci Bull, 2009, 25(6): 97-101.[梅四卫, 朱涵珍. 大蒜素的研究进展[J]. 中国农学通报, 2009, 25(6): 97-101.]
[10] Padilla-Camberos E, Zaitseva G, Padilla C. Antitumoral activity of allicin in murine lymphoma L5178Y[J]. Asian Pac J Cancer Prev, 2010, 11(5): 1241-1244.
[11] Chang HP, Chen YH. Differential effects of organosulfur compounds from garlic oil on nitric oxide and prostaglandin E2 in stimulated macrophages[J]. Nutrition, 2005, 21(4): 530-536.
[12] Xu L, Lv LH, Yu JD,et al. Effects of allicin on anti-tumor activity of rat NK cellsin vitro[J]. Chin J Pathophysiol, 2010, 26(11): 2091-2096.[ 徐丽, 吕丽虹, 俞建东, 等. 大蒜素对大鼠NK细胞肿瘤杀伤活性的影响[J]. 中国病理生理杂志, 2010, 26(11): 2091-2096.]
[13] Xu Z, Wu GM, Qian GS,et al. Preliminary establishment of aging model in rat[J]. J Third Mil Med Uni, 2003, 25(4): 312-315.[徐智, 吴国明, 钱桂生等. 大鼠衰老模型的初步建立[J]. 第三军医大学学报, 2003, 25(4): 312-315.]
[14] Frick KM, Baxter MG, Markowaska AL,et al. Age-related spatial reference and working memory deficits assessed in the water maze[J]. Neurobiol Aging, 1995, 16(2): 149-160.
[15] Li AP, Zhao H, Li S,et al. Species differences of muridae in the learning and memory behavior in morris water maze[J].Chin J Behav Med Sci, 2005, 14(1): 29-31.[李爱萍, 赵慧, 李韶, 等. 不同鼠种在Morris水迷宫学习记忆行为中的种属差异[J]. 中国行为医学科学, 2005, 14(1): 29-31.]
[16] Ye CF, Li B, An Wen-lin,et al. Exploration of step through avoidance response: determination of learning and memory function in rat[J]. Acta Laboratorium Animalis Scientia Sinica, 2000, 8(3): 164-169.[叶翠飞, 李斌, 安文林, 等. 避暗反应测定大鼠学习记忆功能方法的探讨[J].中国实验动物学报, 2000, 8(3): 164-169.]
[17] Zhu XD, Jiang XC, Mao X. Effects of electroacupuncture on AD rats step-down test latencies and error frequency effects and the related mechanism research[J]. Chin J Chin Med, 2011, 26(9): 485-487.[朱晓冬, 蒋希成, 毛翔. 电针对阿尔海茨默病模型大鼠跳台试验潜伏期和错误次数的影响及其相关机制研究[J]. 中医学报, 2011, 26(9): 485-487.]
[18] Chen J, Li RH. The mechanisms of aging by free radical[J]. Chin J Gerontol, 2004, 24(7): 677-679.[陈瑾, 李荣亨. 衰老的自由基机制[J]. 中国老年学杂志, 2004, 24(7): 677-679.]
[19] Emerit J, Michelson AM. Free radicals in medicine and biology[J]. Semaine Des Hopitaux, 1982, 6(45): 2670-2675.
[20] Shi YH, Ding ZB, Zhou J,et al. Targeting autophagy enhances sorafenib lethality for hepatocellular carcinomaviaER stressrelated apoptosis[J]. Autophagy, 2011, 7(10):1159-1172.
[21] Rossé T, Olivier R, Monney L,et al. Bcl-2 prolongs cell survival after Bax-induced release of cytochrome c[J]. Nature, 1998, 391(6666): 496-499.
Effects of allicin on the capacity for learning and the expression of oxidative stress related proteins in D-galactose induced aging rats
YU Yang1, XU Ye1*, LIU Shi-bing1, LI Song-yan1, ZENG Lin-chuan21Medical Research Laboratory,2Preventive Medicine Undergraduate Class of 2011, Jilin Medical College, Jilin, Jilin 132013, China
*< class="emphasis_italic">Corresponding author, E-mail: xuye_9707@163.com
, E-mail: xuye_9707@163.com
This work was supported by the National Natural Science Foundation of China (81372793), and the Key Project of "Twelfth Five-year Plan" Science and Technology of Jilin Province (2014552)
ObjectiveTo investigate the effects of allicin on the brain of D-galactose induced aging rats, and explore the possible mechanism of the effect through studying oxidative stress pathway.MethodsFifty male SD rats were randomly divided into 5 groups (10 each): control group (Group C), D-galactose group (Group D), and allicin groups with different allicin dosage, i.e. low-dose allicin group (Group L), medium-dose allicin group (Group M) and high-dose allicin group (Group H). Rats in group C
subcutaneous injection of 0.5ml normal saline, and those in groups D, L, M and H were given injection of 125mg/kg D-galactose for 6 weeks (one time every day at 8:00 am). Meanwhile, rats in groups L, M and H were intraperitoneally injected with allicin in the doses of 10, 20 and 40mg/kg, respectively, while those in groups C and D were injected with the same volume of normal saline as control for 6 weeks (one time every day at 8:00 pm). The learning and memory ability of the rats were observed by ethological examination, and animals were then sacrificed and the brain tissues were acquired. The malondialdehyde (MDA) content, superoxide dismutase (SOD) activity, and the total antioxidant capacity (T-AOC) in the homogenate of brain tissue weremeasured. Another part of brain tissue was examined under the microscope, and the expression of the apoptosis related proteins in hippocampus was examined. Bax and Bcl-2 expressions were also determined by immunohistochemistry.ResultsEthological examination indicated that, compared with that in group C, the learning and memory ability were attenuated obviously in group D (P<0.05), while the memory ability increased in the 3 allicin groups (P<0.05). Compared with that in group C, the MDA content increased (P<0.05), SOD activity lowered (P<0.05), and T-AOC decreased (P<0.05) in group D. Compared with that in group D, the MDA content decreased (P<0.05), and SOD activity and A-TOC increased in the 3 allicin groups (P<0.05) with a certain dose-effect relationship. Immunohistochemical assay showed that, compared with that in group C, the expression of Bax upregulated significantly (P<0.05), and that of Bcl-2 down-regulated obviously (P<0.05) in group D. Compared with that in group D, the expression of Bax lowered and of Bcl-2 elevated in Groups L, M and H, but the differences showed no statistical significance.ConclusionAllicin may improve the learning and memory ability of aging rats induced by D-galactose, and if may increase the SOD activity, decrease the MDA content, and increase the T-AOC in brain tissue, thus it may attenuate the apoptosis of brain cells in hippocampus of aging rats.
allicin; aging; brain; oxidative stress; apoptosis
R592
A
0577-7402(2015)11-0880-05
10.11855/j.issn.0577-7402.2015.11.05
2015-04-07;
2015-09-22)
(责任编辑:李恩江)
国家自然科学基金面上项目(81372793);吉林省“十二五”科学技术研究项目(2014552)
于洋,医学硕士。主要从事卫生毒理学方面的研究
132013 吉林省吉林市 吉林医药学院医学科研实验室(于洋、徐冶、刘师兵、李松岩),2011级预防医学本科班 (曾林川)
徐冶,E-mail:xuye_9707@163.com
