原发性肝癌规范化病理诊断指南(2015年版)
2015-06-28丛文铭,步宏,陈杰等
·指南与共识·
原发性肝癌规范化病理诊断指南(2015年版)
Evidence-based practice guidelines for the standardized pathological diagnosis of primary liver cancer (2015 edition)
中国抗癌协会肝癌专业委员会,中华医学会肝病学分会肝癌学组,中国抗癌协会病理专业委员会,中华医学会病理学分会消化病学组,中华医学会外科学分会肝脏外科学组,中国抗癌协会临床肿瘤学协作专业委员会,全国肝胆肿瘤及移植病理协作组
肝癌;病理学;诊断;指南
我国是世界上肝癌高发国家之一。手术切除是肝癌的首选治疗方法,而病理学则是肝脏外科最主要的支撑学科之一。为此,中国抗癌协会肝癌专业委员会、中国抗癌协会临床肿瘤学协作专业委员会、中华医学会肝病学分会肝癌学组和中华医学会病理学分会全国肝胆肿瘤及移植病理协作组于2010年制订了《原发性肝癌规范化病理诊断方案专家共识(2010年版)》(《共识》)[1],对推进我国肝癌病理诊断规范化起到了积极的引导作用。近5年来,肝癌临床和病理学研究又有了新进展,肝癌异质性、生物学特性、分子分型和个体化治疗等新概念开始成为现代临床肝癌治疗学的基本指导思想,这对肝癌病理诊断的规范化和标准化提出了更高的要求。为此,2014年4月,在吴孟超院士的直接参与和指导下,中国抗癌协会肝癌专业委员会、中华医学会肝病学分会肝癌学组、中国抗癌协会病理专业委员会、中华医学会病理学分会消化病学组、中华医学会外科学分会肝脏外科学组、中国抗癌协会临床肿瘤学协作专业委员会和全国肝胆肿瘤及移植病理协作组召开了《原发性肝癌规范化病理诊断指南(2015年版)》(《指南》)制订专家会议。
本《指南》制订的主要目的是:在2010年版《共识》的基础上,采用美国肝病研究学会(AASLD)临床指南委员会推荐的循证医学证据等级评价标准(表1)[2],吸收近5年国内外肝癌临床病理学研究的新成果,听取肝脏病理、外科和内科等多学科专家的意见和建议,回应临床提高肝癌疗效对病理的需求和关切,为肝癌规范化病理诊断提供指导依据。为此,专家组多次就《指南》的制订,重点就肝癌大体标本取材规范和微血管侵犯病理诊断规范等问题展开专题研讨,对各单位在肝脏肿瘤病理诊断与研究实践中积累的经验进行深入交流。在此基础上撰写了初稿提交专家组讨论修改,并于2015年1月召开定稿会,做进一步的补充和完善,最后形成了能基本反映我国现阶段肝癌病理诊断技术水平的《指南》,以期为提高我国肝癌病理诊断的规范化和标准化水平提供指导性和引导性的意见和建议。
1 病理检查方案
原发性肝癌统指起源于肝细胞和肝内胆管上皮细胞的恶性肿瘤,其中以肝细胞癌和肝内胆管癌最为常见,但本方案中的大部分内容也适用于肝脏其他类型的原发性肿瘤。病理检查方案主要包括大体标本的固定和取材、大体和显微镜下特点的描述、免疫组化和分子病理学检查等重要环节。规范化的病理检查是从源头上保证病理诊断准确性的基础和前提,由此可为临床评估肝癌复发风险和远期预后以及制订个体化治疗方案提供有价值的参考依据。
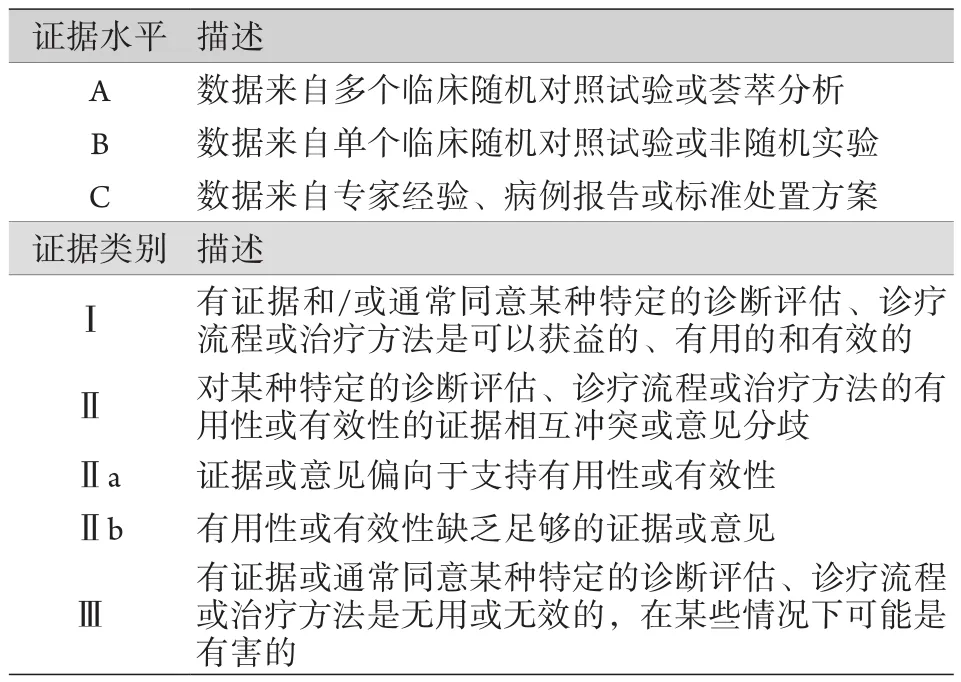
表1 循证医学证据推荐分级系统Tab. 1 Grading system of evidence recommendation in evidence-based medicine
1.1 大体标本的处理
1.1.1 标本固定 (1)手术医生应在病理申请单上标注送检标本的种类和数量,对手术切缘、可疑病变以及重要血管和胆管切缘可用染料染色或缝线标记,对切除小组织标本及淋巴结等应单独放置容器内并贴好标签说明;(2)为最大限度地保留细胞内核酸和蛋白质的完整性,防止细胞自溶,应尽可能将肿瘤标本在离体30min以内送达病理科切开固定[3];(3)病理科接收标本后,在不影响病理诊断的前提下切取新鲜组织冻存于组织库,以备分子病理学检查之用,沿瘤体最大直径,每隔1cm做一个剖面,并保持标本的连续性;(4)常温下10%中性缓冲福尔马林溶液4~5倍于标本体积固定12~24h[4]。上述处理基本能够满足分子病理学和免疫病理学诊断的需要[5]。
1.1.2 标本取材 根据目前对肝癌异质性和微环境特点的认识,肝癌的外周区域是肿瘤异质性的代表性区域,是高侵袭性细胞群体分布的集中区域,是微血管侵犯和卫星结节形成的高发区域,也是影响转移、复发和预后的高风险区域[6-7]。为此,应特别重视在癌与癌旁肝组织交界处取材,以便在相互对照中客观评估肝癌的生物学特性。为此,推荐以下肝癌标本“7点”基线取材方案(图1):(1)选取出血坏死少、组织完整的剖面,分别在12点、3点、6点和9点的位置上于癌与癌旁肝组织交界处取材,癌与癌旁肝组织的比例约为1:1,以着重观察肿瘤对包膜、微血管以及邻近肝组织的侵犯情况;(2)在肿瘤无出血和坏死的部位至少取材1块,以供分子病理学检查之用,对质地和色泽有差异的肿瘤区域还应增加取材;(3)对距肿瘤边缘≤1cm(近癌旁肝组织或切缘)和>1cm(远癌旁肝组织或切缘)范围内的肝组织分别取材,以观察肿瘤卫星结节、异型增生结节以及肝组织背景病变(肝纤维化和肝硬化)等情况;(4)取材时应做好部位编号,组织块大小为(1.5~2.0) cm×1.0cm×0.2cm。
建议1:肝癌标本“7点”取材方案是一种基线方案,实际取材的部位和数量还须根据肿瘤的直径、形状、数量以及癌旁肝组织的大小等情况酌情增减;微血管侵犯和卫星结节的检出率还与癌旁肝组织的切除范围有关。因此,应描述癌旁肝组织的大小,并在多剖面检查的基础上,对可疑病灶重点取材(C,Ⅰ)。
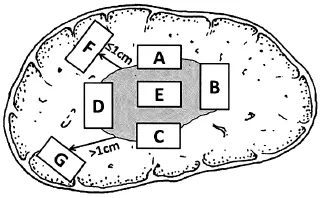
图1 肝脏肿瘤标本基线取材部位示意图Fig. 1 Schematic diagram of baseline sampling site of a liver tumor specimen编号A、B、C和D:分别对应12点、3点、6点和9点的癌与癌旁肝组织交界处;编号E:肿瘤区域;编号F:近癌旁肝组织区域;编号G:远癌旁肝组织区域A, B, C, D: Junction of carcinoma and para carcinoma tissues corresponding to clockwise 12, 3, 6 and 9; E: Tumor region; F: Adjacent para carcinoma liver tissue region; G: Distant para carcinoma liver tissue region
建议2:当肿瘤距肝切缘较近时,可在距肿瘤最近的切缘处做垂直于切缘取材,以实际评估肿瘤与切缘的距离;当肿瘤距切缘较远时,可沿切缘做平行取材,以最大面积评估切缘肝组织的状态(C,Ⅰ)[3]。
1.2 大体标本描述的重点内容 除描述送检肝脏标本的一般特点外,应重点描述肿瘤的大小、数量、颜色、质地、肿瘤与血管和胆管的关系、包膜形成与侵犯、周围肝组织病灶、肝硬化类型、肿瘤至切缘的最近距离以及切缘受累等情况,并对形态特殊的肿瘤标本拍照存档。肝细胞癌的大体分型可参照中国肝癌病理协作组分类[8]和卫生部《原发性肝癌诊疗规范(2011年版)》分类[9],其中单个肿瘤直径≤1cm为微小癌、>1cm~≤3cm为小肝癌(small hepatocellular carcinoma,SHCC);肝内胆管癌的大体类型可参照世界卫生组织(WHO)的分类,分为块状型、管周浸润型和管内生长型[10]。
SHCC是临床早诊早治的重要病理学基础,但目前国际上有多个SHCC体积标准,从瘤体直径2~5cm不等[11]。有研究显示,SHCC生长至近3cm大小时,是其生物学特性由相对良性向高度恶性转变的重要时期[12],≤3cm SHCC可出现特定基因的改变[13-14];>3cm肝癌发生微血管侵犯、卫星结节以及不良预后的风险明显增加[12,15];≤3cm SHCC患者的术后5年总生存期和无复发生存期分别为67.8%和52%,显著好于>3cm肝癌患者的42.3%和29.3%(P<0.01)[12]。至于≤2cm SHCC,目前多是基于多中心的长时期病例汇总,单中心报道的病例还较少,生物学特性研究不多[11,15-16]。
建议3:≤3cm SHCC多表现出分化好、膨胀性生长、微血管侵犯和卫星结节发生率低等相对温和的生物学行为,具有根治性治疗的病理学基础;在SHCC出现高侵袭性行为之前进行根治性治疗,对提高肝癌患者远期疗效具有重要的临床实际意义(B,Ⅰ)。
建议4:SHCC是一个肿瘤体积概念,并不完全等同于生物学意义上的早期肝癌;有些SHCC甚至微小癌也可以出现分化差、侵袭性生长、微血管侵犯和卫星结节形成等恶性生物学行为,提示这类SHCC已较早进入恶性演进阶段。因此。对≤3cm SHCC的肿瘤组织应全部取材检查生物学行为表现,临床上对≤3cm SHCC也应注意保留一定的治疗边界[17](B,Ⅰ)。
1.3 显微镜下描述的重点内容[10,18](1)肝细胞癌的组织学类型:常见有细梁型、粗梁型、假腺管型和团片型等;(2)肝细胞癌的特殊细胞类型:如透明细胞型、富脂型、梭形细胞型和未分化型等;(3)肝细胞癌的分化程度:可采用国际上常用的Edmondson-Steiner四级(Ⅰ-Ⅳ)分级法;(4)肿瘤坏死(如介入治疗后)、淋巴细胞浸润及间质纤维化的范围和程度;(5)肝内胆管癌:以腺癌最为常见,也可以出现多种组织学和细胞学特殊类型,分化程度分为高分化、中分化和低分化;(6)肿瘤生长方式:包括癌周浸润、包膜侵犯或突破、微血管侵犯和卫星结节等;(7)慢性肝病评估:肝癌常伴随不同程度的慢性病毒性肝炎或肝硬化,应采用公认的组织学分级和分期系统进行评估[19]。
建议5:文献中常用的慢性病毒性肝炎组织学分级和分期系统较多,包括国际肝脏研究学会(IASL)[20]、Knodell[21]、Scheuer[22]、Batts-Ludwig[23]、METAVIR[24]以及Ishak[25]系统等(B,Ⅰ)。建议在病理诊断工作中选用较为简便的指数系统,例如Scheuer系统与中国2000年慢性病毒性肝炎组织学分级和分期标准[26]基本对应。
建议6:通常应做Masson三色染色和网状纤维染色以辅助评估肝纤维化和肝小叶改建的程度(B,Ⅰ)。
1.4 癌前病变描述的重点内容
1.4.1 肝细胞癌癌前病变的主要类型[18,27-28](1)肝细胞异型增生:①大细胞改变:肝细胞与细胞核体积均增大,核染色质浓染及多核;②小细胞改变:肝细胞体积缩小,核体积增大伴轻度异型,细胞核呈拥挤表象;(2)异型增生灶:多由小细胞改变构成的直径≤1.0mm病灶;(3)低度异型增生结节(LGDN):以大细胞改变为主构成的结节,细胞无明显异型性,间质内无孤立性动脉,无膨胀性生长;(4)高度异型增生结节(HGDN):以小细胞改变为主构成的结节,肝细胞异型性增加,间质内出现孤立性动脉,有膨胀性生长,局部发生癌变时称为结节内结节;(5)肝细胞腺瘤(HCA):WHO将HCA分为HNF1α失活型、β-catenin活化型、炎症型和未分类型等4种亚型,其中β-catenin活化型HCA的癌变风险增加。
1.4.2 肝内胆管癌癌前病变的主要类型[10](1)胆管上皮内瘤变(biliary intraepithelial neoplasia,BilIN):根据胆管上皮的异型程度,可分为BilIN-1(低级别)、BilIN-2(中级别)和BilIN-3(高级别或原位癌);(2)胆管内乳头状肿瘤:限于胆管腔内生长的管状-乳头状肿瘤,可伴有不同级别的BilIN;(3)其他:胆管黏液性囊性肿瘤和胆管错构瘤等也可有不同程度的恶变风险,须结合BilIN程度考虑。
建议7:对HGDN与高分化SHCC的鉴别诊断十分重要,后者可不同程度地表现出细胞的核/质比和排列密度增加、小梁间隙增宽、假腺管结构、浸润性生长、CD34染色显示微血管密度增高、Ki-67表达增加、p53和GPC-3阳性表达,以及网状纤维染色显示病灶内网状支架减少或消失等特点,应在与HGDN鉴别的基础上做出诊断(B,Ⅰ)。
1.5 微血管侵犯的病理诊断 微血管侵犯(microvascular invasion,MVI),也称微血管癌栓,主要是指在显微镜下于内皮细胞衬覆的血管腔内见到癌细胞巢团。MVI多见于癌旁肝组织内的门静脉小分支(含肿瘤包膜内血管),这与门静脉血流动力学紊乱,成为肝癌主要的出瘤血管有关[29-30]。肝静脉分支作为肝癌次要的出瘤血管也可发生MVI,当两者不易区分时诊断MVI即可;偶可见到肝癌侵犯肝动脉、胆管以及淋巴管等脉管小分支,应单独另报[31-33];区分脉管的性质可选用CD34(血管内皮)、SMA(血管壁平滑肌层)、弹力纤维(微小血管壁弹力纤维层)以及D2-40(淋巴管内皮)染色等。有研究显示,MVI癌细胞数量≥50个与肝癌患者的预后密切相关,如果脉管内仅有少量松散悬浮癌细胞(<50个),应在病理报告中另行说明,此类MVI被视为低度复发风险[33]。
MVI是肝癌术后复发风险的重要预测指标,也是临床肝癌术后抗复发治疗的重要病理学指征。文献资料显示,肝癌MVI的发生率为15%~57.1%[31],这种差异可能与标本取材和诊断标准的不同有关。临床研究表明,MVI与肝癌患者的不良预后,包括复发风险增加和远期生存率降低密切相关,即使≤3cm SHCC也是如此[34]。Roayaie等[35]的研究显示,MVI发生血管壁肌层侵犯以及MVI数量在5个以上时与术后复发率显著相关,MVI发生于癌旁肝组织>1cm范围与术后生存率显著相关。Sumie等[36]根据MVI的数量将患者分为无MVI组、轻度MVI组(1~5个MVI)和重度MVI组(>5个MVI),结果显示,MVI分组越高,患者的疾病特异性生存期和无复发生存期越短。不仅如此,肝移植患者发生MVI也可显著降低移植术后3年无病生存率[RR=3.41(2.05~5.7)]和3年总生存率[RR=2.41(1.72~3.37)][31]。
此外,Pawlik等[37]发现,MVI的发生与肝癌瘤体大小呈正相关;MVI的发生率在瘤体直径<3cm、3.1~5cm、5.1~6.5cm和>6.5cm的肝癌中分别为25%、40%、55%和63%(P<0.01);肝癌的瘤体大小和数量都是预测MVI的重要指标。
建议8:MVI是肝癌患者预后的重要预测指标(A,Ⅰ),应将全部组织切片内的MVI进行计数,并根据MVI的数量和分布情况进行风险分级。M0:未发现MVI;M1(低危组):≤5个MVI,且发生于近癌旁肝组织区域(≤1cm);M2(高危组):>5个MVI,或MVI发生于远癌旁肝组织区域(>1cm;B,Ⅰ)。
1.6 卫星结节的病理诊断 卫星结节(子灶)主要是指主瘤周边近癌旁肝组织内出现的肉眼或显微镜下小癌灶,与主瘤分离,两者的组织学特点相似。卫星结节起源于MVI,当两者在组织学上不易区分时可诊断为卫星结节[38]。Lim等[39]发现,卫星结节发生率在<5cm和>5cm肝癌中分别为7%和23%(P<0.01),是总生存率差的预测因素(P=0.0054)。另有研究显示,92.3%的肝癌标本近端和91.7%的肝癌标本远端出现微转移灶的最大扩散距离分别为<1.5cm和<3cm[40],可作为检查和治疗的重点区域,而且卫星结节还是术后复发风险的重要预测因素[41]。MVI和卫星结节的病理诊断对临床治疗模式的选择也有实际参考价值。例如,Meniconi 等[42]发现,首次切除肝癌标本中无MVI和卫星结节的患者出现早期肝内复发时,选择再次肝切除(P=0.01)或射频消融(P=0.007)治疗后的总生存率要明显好于肝动脉插管化疗栓塞。
建议9:卫星结节的病理诊断应包括:(1)卫星结节的数量;(2)卫星结节的分布范围;(3)远癌旁肝组织内出现的癌结节(包括多结节性肝癌)既可能是肝内转移灶,也可能是多中心起源的新生肿瘤,需要时可做分子克隆检测以明确癌灶的来源(B,Ⅰ)。
1.7 肝穿刺活检组织的处理 对肝脏占位性病变通常采用16G穿刺针,于肿瘤及肿瘤旁肝组织交界处穿刺1条,或于肿瘤和肿瘤旁肝组织各穿刺1条,以便相互对照做出正确诊断;评估慢性病毒性肝炎的穿刺组织则需略长,经10%中性缓冲福尔马林固定后长度宜在1.5cm左右,固定时间1~2h,并保持组织完整无断裂,在每张玻片上放置≥6张间隔性连续组织切片,以综合评估各组织切片的病损程度[19,43]。
2 免疫病理诊断
2.1 常用诊断标志物[27,44-45]
2.1.1 肝细胞癌 (1)肝细胞抗原(Hep Par-1,肝细胞特异性,不能区别肝细胞性肿瘤的性质);(2)磷脂酰肌醇蛋白聚糖-3(GPC-3);(3)CD34(标记肿瘤新生血管);(4)多克隆性癌胚抗原(pCEA,肝细胞特异性,不能区别肝细胞性肿瘤的性质);(5)CD10(肝细胞特异性,不能区别肝细胞性肿瘤的性质);(6)精氨酸酶-1(arginase-1,肝细胞特异性,不能区别肝细胞性肿瘤的性质);(7)热休克蛋白70(HSP70);(8)谷氨酰胺合成酶(GS);(9)甲胎蛋白(AFP)。
2.1.2 肝内胆管癌 (1)细胞角蛋白CK19、CK7;(2)黏蛋白-1(MUC-1)。
2.1.3 双表型肝细胞癌(dual phenotype of hepatocellular carcinoma,DPHCC)[6]是肝细胞癌的一种特殊亚型,表现为形态学上典型的肝细胞癌可同时显著表达肝细胞癌和胆管癌的标志物,因具有双重表型特征而侵袭性更强[6,46],只能通过免疫组化检查才能做出亚型诊断。
2.2 生物学特性标志物 文献中时有提出与肝癌侵袭能力、复发风险和远期生存等生物学特性相关的免疫组化标志物[47],但实际应用意义还需要进一步验证。
建议10:现有肝癌标志物在诊断的特异性和敏感性上均存在某种程度的不足,须合理组合、客观评估,有时还需与其他组织特异性标志物联合使用,其主要目的是:(1)肝细胞性良、恶性肿瘤之间的鉴别;(2)肝细胞癌与肝内胆管癌以及肝脏其他特殊类型肿瘤之间的鉴别;(3)原发性肝癌与转移性肝癌之间的鉴别(B,Ⅰ)。
建议11:CD34免疫组化染色并不直接标记肝脏实质细胞,但可显示不同类型肝脏肿瘤的微血管密度和分布特点,如肝细胞癌为弥漫型、胆管癌为稀疏型、肝细胞腺瘤为斑片型、肝局灶性结节性增生为条索型等,有助于鉴别诊断(B,Ⅰ)。
3 分子病理诊断
肝癌分子分型是肝癌分子病理学研究发展的方向和趋势,目前文献中时有报道肝癌分子分型和分子预测标志物的检测方案[48],但其临床实际意义尚有待多中心和大样本研究的验证。
肝癌药物分子靶点检测的临床应用仍处于研究和开发之中,但一些临床试验结果的进一步验证值得期待[49]。
肝癌术后复发是严重制约肝癌远期疗效的瓶颈之一。肝癌克隆起源理论认为,肝癌存在单中心(单克隆性)和多中心(多克隆性)两种起源模式。理论上讲,单中心性复发性肝癌来自首次切除肝癌的残留癌细胞,更适合介入和靶向药物等综合治疗,而多中心性复发性肝癌在本质上属于新生肿瘤,更适合再次手术切除或肝移植[50];由于体内残留癌细胞具有长期“休眠”的生物学特性,即使是临床远期复发(术后>2年)的肝癌仍有可能是单中心性复发[51]。此外,也有学者提出了肝癌复发方式的组织学判断标准[52],但还需要分子克隆检测的验证。
肝癌克隆起源理论也同样适用于多结节性肝癌的发生。Finkelstein等[53]报道,多中心起源的多结节性肝癌患者肝移植术后生存期要明显好于单中心起源的多结节性肝癌,提示分子克隆检测可为肝移植受体的筛选以及预后评估提供参考依据。Gehrau等[54]还提出了一个肝癌诊疗路线图,其中对多结节性肝癌若经分子检测证实为多中心起源,可进入肝移植候选评估队列,如果是单中心起源,则侧重介入治疗或索拉非尼靶向药物治疗。
肝细胞腺瘤癌变风险的分子评估及对临床治疗模式的影响也已引起关注[55]。总之,围绕临床关切的问题开展肝癌分子病理诊断,有助于临床治疗模式的优化与更新[56]。
建议12:多结节性肝癌和复发性肝癌的克隆起源方式是临床制订个体化治疗方案和提高远期疗效的重要依据。为此,采用分子克隆检测的方法评估这类肝癌的克隆起源方式,可为临床制订个体化治疗方案提供客观的参考依据(B,Ⅰ)。
4 病理诊断报告
肝癌病理诊断报告应突出肝脏专科病理特点,注重回应临床对了解肝癌术后复发病理危险因素的关切。肝癌病理诊断报告一般由大体标本描述、显微镜下描述、免疫组化检查结果、其他特殊检查结果、典型病理照片以及病理诊断名称等部分组成,必要时还可以通过备注的方式,对临床需要引起重视的肿瘤重要生物学特征或病理学上还有待进一步鉴别诊断的病变等问题加以解释或补充说明。此外,为便于记录和统计临床和病理学参数,也可以在病理报告后附加清单式记录表格[57]。
附:病理诊断报告模式举例
1.大体所见:(1)肝右叶标本5.0cm×4.5cm×4.2cm,切面见2.6cm×2.2cm灰白色肿瘤,伴灶性出血坏死,周边包膜完整,周围肝组织呈大结节性肝硬化,未发现癌栓及卫星结节,肿瘤距手术切缘1.5cm;(2)肝左叶标本3.0cm×2.0cm×2.2cm,切面见肝硬化组织内有1个直径1.0cm×0.9cm灰白色结节,无包膜,与周围肝组织分界清楚。
2.镜下所见:(1)肝右叶肿瘤排列成细梁型结构,癌细胞多边形,细胞质丰富嗜酸性,细胞核圆形,轻度异型,癌组织与周围肝组织有移行,包膜内见1个MVI,近癌旁肝组织内见2个MVI;周围肝组织呈假小叶结构,可见1个由大细胞改变构成的异型增生灶,对周围肝组织有膨胀性挤压,远癌旁肝组织及切缘肝组织内未见肿瘤细胞。(2)肝左叶肿瘤排列成假腺管结构,癌细胞小立方形,核异型性不明显,肿瘤周边无包膜,与肝组织分界清楚(可附典型组织学照片)。
3.免疫组化检查结果:HepPar1阳性;GPC-3阳性;HBsAg阳性;CD34显示微血管弥漫分布;假腺管区域GPC-3阳性,CK19阴性。
4.特殊染色检查结果:Masson三色染色显示肝组织胶原纤维间隔形成,包绕假小叶;网状纤维染色显示假小叶网状支架塌陷。
5.分子病理学检查结果:肝左叶和肝右叶肿瘤之间的微卫星杂合性缺失类型出现显著性差异,提示为2个起源于不同克隆的原发性肿瘤(可另附分子病理学检查报告)。
6.病理诊断:(1)(肝右叶)小肝细胞癌,细梁型,Ⅱ级;(2)(肝左叶)小肝细胞癌,假腺管型,Ⅱ级;(3)MVI评级=M1;(4)大结节性肝硬化;(5)癌旁肝组织异型增生灶。
7.备注:本例2个肝癌结节均为原发,癌旁肝硬化组织内出现异型增生灶,提示存在肿瘤多中心起源的病理基础,请临床注意密切随访。
指导:吴孟超,第二军医大学东方肝胆外科医院;汤钊猷,复旦大学附属中山医院;刘彤华,北京协和医院
编审专家组成员(按姓氏拼音排序):步宏,四川大学华西医院病理科;陈杰,北京协和医院病理科;陈柯,安徽省立医院病理科;陈孝平,华中科技大学同济医学院附属同济医院肝胆外科;丛文铭,第二军医大学东方肝胆外科医院病理科;崔全才,北京协和医院病理科;郭德玉,第三军医大学西南医院病理科;胡锡琪,复旦大学上海医学院病理学系;黄波,辽宁省肿瘤医院病理科;纪元,复旦大学附属中山医院病理科;荚卫东,安徽省立医院肝外科;李强,天津医科大学第二医院肝外科;李珊珊,郑州大学第一附属医院病理科;李增山,第四军医大学西京医院病理科;廖芝玲,广西医科大学附属肿瘤医院病理科;刘彤华,北京协和医院病理科;刘秀峰,解放军81医院肿瘤内科;鲁昌立,四川大学华西医院病理科;孟斌,天津医科大学肿瘤医院病理科;孟凡青,南京大学医学院附属鼓楼医院病理科;秦叔逵,解放军81医院肿瘤内科;任国平,浙江大学医学院附属第一医院病理科;石怀银,解放军总医院病理科;孙青,山东大学附属千佛山医院病理科;汤钊猷,复旦大学附属中山医院肝癌研究所;文天夫,四川大学华西医院肝胆外科;吴孟超,第二军医大学东方肝胆外科医院肝外科;杨甲梅,第二军医大学东方肝胆外科医院肝外科;杨永平,解放军302医院肿瘤内科;叶胜龙,复旦大学附属中山医院肝内科;袁卫平,广西医科大学附属肿瘤医院肝胆外科;云径平,中山大学肿瘤防治中心病理科;曾韵洁,中山大学孙逸仙纪念医院病理科;张丽华,东南大学附属中大医院病理科;张志伟,华中科技大学同济医学院附属同济医院肝胆外科;周俭,复旦大学附属中山医院肝外科;周建华,中南大学湘雅医院病理科;赵爱莲,北京大学肿瘤医院病理科;赵景民,解放军302医院病理科;朱虹光,复旦大学附属华山医院病理科
执笔和资料整理:丛文铭,第二军医大学东方肝胆外科医院病理科;步宏,四川大学华西医院病理科;陈杰,北京协和医院病理科;董辉,朱玉瑶,冯龙海,第二军医大学东方肝胆外科医院病理科;陈骏,南京大学医学院附属鼓楼医院病理科
[1]Chinese Expert Consensus Statement Chinese Society of Liver Cancer (CSLC), Chinese Society of Clinical Oncology (CSCO), Liver Cancer Group, Chinese Society of Hepatology,et al. Experts consensus on pathological diagnosis of primary liver cancer[J]. J Clin Exp Pathol, 2010, 26(6): 645-647.[中国抗癌协会肝癌专业委员会, 中国抗癌协会临床肿瘤学协作专业委员会, 中华医学会肝病学分会肝癌学组, 等.原发性肝癌规范化病理诊断方案专家共识[J]. 临床与实验病理学杂志, 2010, 26(6): 645-647.]
[2]Koh C, Zhao X, Samala N,et al. AASLD clinical practice guide-lines: a critical review of scientific evidence and evolving recommendations[J]. Hepatology, 2013, 58(6): 2142-2152.
[3]William H, Ralph H, Timothy H,et al. Surgical pathology dissection: an illustrated guide[M]. New York: Springer, 2003: 7-9.
[4]Chinese Medical Association. Clinical operation norm: pathology[M]. Beijing: People' s Military Medical Press, 2004: 27-41.[中华医学会.临床技术操作规范•病理学分册[M]. 北京: 人民军医出版社, 2004: 27-41.]
[5]Bass BP, Engel KB, Gremk SR,et al. A review of preanalytical factors affecting molecular, protein, and morphological analysis of formalin-fixed, paraffin-embedded (FFPE) tissue: how well do you know your FFPE specimen[J]? Arch Pathol Lab Med, 2014, 138(11): 1520-1530.
[6]Lu XY, Xi T, Lau WY,et al. Hepatocellular carcinoma expressing cholangiocyte phenotype is a novel subtype with highly aggressive behavior[J]. Ann Surg Oncol, 2011, 18(8): 2210-2217.
[7]Cai SW, Yang SZ, Gao J,et al. Prognostic significance of mast cell count following curative resection for pancreatic ductal adenocarcinoma[J]. Surgery, 2011, 149(4): 576-584.
[8]Ying YH. Pathology of hepatocellular carcinoma[M]//Tang ZY. Primary liver cancer. Shanghai: Shanghai Science and Technology Press, 1981: 115-146.[应越英. 肝细胞肝癌的病理学[M]//汤钊猷. 原发性肝癌. 上海: 上海科学技术出版社, 1981: 115-146.]
[9]Ministry of Health of the People' s Republic of China. Diagnosis, management, and treatment of hepatocellular carcinoma ( V2011)[J]. J Clin Hepatol, 2011, 27(11): 1141-1159.[中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肝胆病杂志, 2011, 27(11): 1141-1159.]
[10] Nakanuma Y, Curado MP, Franceschi S,et al. Intrahepatic cholangiocareinoma[M]//Bosman FT, Carneire F, Hruban RH,et al. WHO Classification of Tumours of the Digestive System. 4th ed. Lyon: IARC Press, 2010: 217-227.
[11] Cong WM, Wu MC. Small hepatocellular carcinoma: current and future approaches[J]. Hepatol Int, 2013, 7(3): 805-812.
[12] Lu XY, Xi T, Lau WY,et al. Pathobiological features of small hepatocellular carcinoma: correlation between tumor size and biological behavior[J]. J Cancer Res Clin Oncol, 2011, 137(4): 567-575.
[13] Moribe T, Iizuka N, Miura T,et al. Methylation of multiple genes as molecular markers for diagnosis of a small, well-differentiated hepatocellular carcinoma[J]. Int J Cancer, 2009, 125(2): 388-397.
[14] Llovet JM, Chen Y, Wurmbach E,et al. A molecular signature to discriminate dysplastic nodules from early hepatocellular carcinoma in HCV cirrhosis[J]. Gastroenterology, 2006, 131(6): 1758-1767.
[15] Ueno S, Kubo F, Sakoda M,et al. Efficacy of anatomic resectionvsnonanatomic resection for small nodular hepatocellular carcinoma based on gross classification[J]. J Hepatobiliary Panereat Surg, 2008, 15(5): 493-500.
[16] Farinati F, Sergio A, Baldan A,et al. Early and very early hepatocellular carcinoma: when and how much do staging and choice of treatment really matter? A multi-center study[J]. BMC Cancer, 2009, 9: 33.
[17] Wu MC. Strengthening to diagnosis and treatment of hepatocellular carcinoma[J]. Natl Med J Chin, 2007, 87(30): 2089-2091.[吴孟超. 应重视小肝癌的诊断与治疗[J]. 中华医学杂志, 2007, 87(30): 2089-2091.]
[18] Theise ND, Curado MP, Franceschi S,et al. Hepatocellular carcinoma[M]//Bosman Fr, Cameire F, Hruban RH,et al. WHO Classification of Tumours of the Digestive System. 4th ed. Lyon: IARC Press, 2010: 205-216.
[19] Hu XQ. Histopathological staging and assessment of liver fibrosis in chronic hepatitis patients[J]. Chin J Hepatol, 2008, 16(3): 169-170.[胡锡琪. 慢性肝炎肝纤维化病理分期和评估[J]. 中华肝脏病杂志, 2008, 16(3): 169-170.]
[20] Desmet VJ, Gerber M, Hoofnagle JH,et al. Classification of chronic hepatitis: diagnosis, grading and staging[J]. Hepatology, 1994, 19(6): 1513-1520.
[21] Knodell RG, Ishak KG, Black WC,et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis[J]. Hepatology, 1981, 1(5): 431-435.
[22] Scheuer PJ. Classification of chronic viral hepatitis: a need for reassessment[J]. J Hepatol, 1991, 13(3): 372-374.
[23] Batts KP, Ludwig J. Chronic hepatitis. An update on terminology and reporting[J]. Am J Surg Pathol, 1995, 19(12): 1409-1417.
[24] Bedossa P, Poynard T. An algorithm for the grading of activity in chronic hepatitis C. The METAVIR Cooperative Study Group[J]. Hepatology, 1996, 24(2): 289-293.
[25] Ishak K, Baptista A, Bianchi L,et al. Histological grading and staging of chronic hepatitis[J]. J Hepatol, 1995, 22(6): 696-699.
[26] Chinese Society of Infectious Diseases and Parasitology, Chinese Society of Hepatology, Chinese Medical Association. Prevention and treatment of viral hepatitis[J]. Chin J Hepatol, 2000, 8(6): 324-329.[中华医学会传染病与寄生虫病学分会, 肝病学分会. 病毒性肝炎防治方案[J]. 中华肝脏病杂志, 2000, 8(6): 324-329.]
[27] International Consensus Group for Hepatocellular Neoplasia. Pathologic diagnosis of early hepatocellular carcinoma: a report of the international consensus group for hepatocellular neoplasia[J]. Hepatology, 2009, 49(2): 658-664.
[28] Di Tommaso L, Sangiovanni A, Borzio M,et al. Advanced precancerous lesions in the liver[J]. Best Pract Res Clin Gastroenterol, 2013, 27(2): 269-284.
[29] Toyosaka A, Okamoto E, Mitsunobu M,et al. Pathologic and radiographic studies of intrahepatic metastasis in hepatocellular carcinoma: the role of efferent vessels[J]. HPB Surg, 1996, 10(2): 97-103.
[30] Toyosaka A, Okmnoto E, Mitsunobu M,et al. Intrahepatic metastases in hepatocellular carcinoma: evidence for spreadviathe portal vein as an efferent vessel[J]. Am J Gastroenterol, 1996, 91(8): 1610-1615.
[31] Rodriguez-Peralvarez M, Luong TV, Andreana L,et al. A systematic review of microvascular invasion in hepatocellular carcinoma: diagnostic and prognostic variability[J]. Ann Surg Oncol, 2013, 20(1): 325-339.
[32] Eguchi S, Takatsuki M, Hidaka M,et al. Predictor for histological microvascular invasion of hepatocellular carcinoma: a lesson from 229 consecutive cases of curative liver resection[J]. World J Surg, 2010, 34(5): 1034-1038.
[33] Iguchi T, Shirabe K, Aishima S,et al. New pathologic stratification of microvascular invasion in hepatocellular carcinoma: predicting prognosis after living-donor liver transplantation[J]. Transplantation, 2014.[Epub ahead of print]
[34] Du M, Chen L, Zhao J,et al. Microvaseular invasion(MVI)is a poorer prognostic predictor for small hepatocellular carcinoma[J]. BMC Cancer, 2014, 14: 38.
[35] Roayaie S, Blume IN, Thung SN,et al. A system of classifying microvascular invasion to predict outcome after resection in patients with hepatocellular carcinoma[J]. Gastroenterology, 2009, 137(3): 850-855.
[36] Sumie S, Nakashima O, Okuda K,et al. The significance of classifying microvascular invasion in patients with hepatocellular carcinoma[J]. Ann Surg Oncol, 2014, 21(3): 1002-1009.
[37] Pawlik TM, Delman KA, Vauthey JN,et al. Tumor size predicts vascular invasion and histologic grade: implications for selection of surgical treatment for hepatocellular carcinoma[J]. Liver Transpl, 2005, 11(9): 1086-1092.
[38] Okusaka T, Okada S, Ueno H,et al. Satellite lesions in patients with small hepatocellular carcinoma with reference to clinicopathologic features[J]. Cancer, 2002, 95(9): 1931-1937.
[39] Lim C, Mise Y, Sakamoto Y,et al. Above 5 cm, size does not matter anymore in patients with hepatocellular carcinoma[J]. World J Surg, 2014, 38(11): 2910-2918.
[40] Shi M, Zhang CQ, Feng KT,et al. Micrometastasis distribution in liver tissue surrounding hepatocellular carcinoma[J]. Chin J Oncol, 2002, 4(3): 257-260.[石明, 张昌卿, 冯凯涛, 等. 肝细胞癌周围微小转移分布的研究[J] .中华肿瘤杂志, 2002, 4(3): 257-260.]
[41] Chiche L, Menahem B, Bazille C,et al. Recurrence of hepatocellular carcinoma in noncirrhotic liver after hepatectomy[J]. World J Surg, 2013, 37(10): 2410-2418.
[42] Menieoni RL, Komatsu S, Perdigao F,et al. Recurrent hepatocellular carcinoma: A Western strategy that emphasizes the impact of pathologic profile of the first resection[J]. Surgery, 2014. [Epub ahead of print]
[43] Rackey DC, Caldwell SH, Goodman ZD,et al. Liver biopsy[J]. Hepatology, 2009, 49(3): 1017-1044.
[44] Cong WM, Dong H, Xian ZH. Tumors of the liver and intrahepatic bile duct system[M]//Wu BQ, Liu YF. Immunohistochemical pathologic diagnosis. 2nd ed. Beijing: Beijing Science and Technology Press, 2013: 334-345.[丛文铭, 董辉, 冼志红. 肝脏和肝内胆管系统肿瘤[M]//吴秉铨, 刘彦仿. 免疫组织化学病理诊断. 2版. 北京: 北京科学技术出版社, 2013: 334-345.]
[45] Ordonez NG. Arginase-l is a Hovel immunohistochemical marker of hepatocellular differentiation[J]. Adv Anat Pathol, 2014, 21(4): 285-290.
[46] Govaere O, Komuta M, Berkem J,et al. Keratin 19: a key role player in the invasion of human hepatocellular carcinomas[J]. Gut, 2014, 63(4): 674-685.
[47] Xia L, Huang W, Tian D,et al. Upregulated FoxM1 expression induced by hepatitis B virus X protein promotes tumor metastasis and indicates poor prognosis in hepatitis B virus-related hepatocellular carcinoma[J]. J Hepatol, 2012, 57(3): 600-612.
[48] Roessler S, Budhu A, Wang XW. Deciphering cancer heterogeneity: the biological space[J]. Front Cell Dev Biol, 2014, 2: 12.
[49] Yang X, Zhang XF, Lu X,et al. MicroRNA-26a suppresses allgiogenesis in human hepatocellular carcinoma by targeting hepatocyte growth factor-cMet pathway[J]. Hepatology, 2014, 59(5): 1874-1885.
[50] Wang B, Xia CY, Lau WY,et al. Determination of clonal origin of recurrent hepatocellular carcinoma for personalized therapy and outcomes evaluation: a new strategy for hepatic surgery[J]. J Am Coll Surg, 2013, 217(6): 1054-1062.
[51] Zhu YY, Gu YJ, Lu XY,et al. The clonal characteristics of late recurrent hepatocellular carcinoma after resection: a study of 2 cases[J]. Chin J Oncol, 2014, 36(6): 450-452.[朱玉瑶, 顾怡瑾, 陆新元, 等. 二例术后远期复发性肝细胞癌的克隆特点分析[J]. 中华肿瘤杂志, 2014, 36(6): 450-452.]
[52] Matsumoto Y, Fujii H, Matsuda M,et al. Multicentric occurrence of hepatocellular carcinoma: diagnosis and clinical significance[J]. J Hepatobiliary Pancreat Surg, 2001, 8(5): 435-440.
[53] Finkelstein SD, Marsh W, Demetris AJ,et al. Microdisseetion-based allelotyping discriminatesde novotumor from intrahepatic spread in hepatocellular carcinoma[J]. Hepatology, 2003, 37(4): 871-879.
[54] Gehrau R, Mas V, Archer KJ,et al. Molecular classification and clonal differentiation of hepatocellular carcinoma: the step forward for patient selection for liver transplantation[J]. Expert Rev Gastroenterol Hepatol, 2011, 5(4): 539-552.
[55] Liau SS, Qureshi MS, Praseedom R,et al. Molecular pathogenesis of hepatic adenomas and its implications for surgical management[J]. J Gastrointest Surg, 2013, 17(10): 1869-1882.
[56] Cong WM, Wu MC. New ideas for molecular pathological diagnosis of liver cancer and new strategy for clinical treatment[J]. Natl Med J Chin, 2014, 94(20): 1521-1523.[丛文铭, 吴盂超. 肝癌分子病理诊断新思路与临床治疗新策略[J]. 中华医学杂志, 2014, 94(20): 1521-1523.]
[57] Washington MK, Berlin J, Branton PA,et al. Protocol for the examination of specimens from patients with carcinoma of the intrahepatic bile ducts[J]. Arch Pathol Lab Med, 2010, 134(4): e14-e18.
R735.7
A
0577-7402(2015)11-0865-08
10.11855/j.issn.0577-7402.2015.11.03
丛文铭,E-mail:wmcong@smmu.edu.cn
