电针联合饮食控制对胰岛素抵抗模型大鼠 InsR和 P90rsk蛋白表达的影响
2015-06-28唐念珍唐成林唐思诗袁海洲高睿琦
唐念珍,唐成林*,唐思诗,杨 辉,张 毅,田 源,袁海洲,曹 净,高睿琦
(1.重庆医科大学中医药学院,重庆400016;2.重庆医科大学第一临床学院,重庆400016)
电针联合饮食控制对胰岛素抵抗模型大鼠 InsR和 P90rsk蛋白表达的影响
唐念珍1,唐成林1*,唐思诗2,杨 辉3,张 毅1,田 源1,袁海洲1,曹 净1,高睿琦1
(1.重庆医科大学中医药学院,重庆400016;2.重庆医科大学第一临床学院,重庆400016)
目的 研究电针联合饮食控制对胰岛素抵抗模型大鼠InsR和P90rsk蛋白表达的影响,探讨其增强胰岛素抵抗模型大鼠对胰岛素敏感性的机制。方法 SD雄性大鼠70只,随机分为普食组(n=10)和高脂高糖组(n=60),分别给予普通饮食及高脂高糖饮食。8周后选取40只成功造模的大鼠随机分为:HFHCD 1、HFHCD 2、EA 1、EA 2组(n=10)。HFHCD 1组和EA 1组高脂高糖饮食,HFHCD 2组和EA 2组普食。EA组针刺1次/d,20 min/次,共14 d。观察大鼠体质量、血糖和胰岛素变化情况,Western blot检测各组大鼠InsR和P90rsk的蛋白表达量。结果 InsR和P90rsk蛋白表达:HFHCD组较CD组明显降低(P<0.01),EA组较HFHCD组明显升高(P<0.01),HFHCD 2组较HFHCD 1组、EA 2组较EA 1组均明显升高(P<0.01)。结论 电针联合饮食控制能升高InsR和P90rsk蛋白表达水平,从而恢复胰岛素信号的正常传导 ,增强胰岛素敏感性。
针灸疗法 ;饮食控制;胰岛素抵抗;InsR;P90rsk
胰岛素抵抗(Insulin resistance,IR)是指生理剂量的胰岛素所产生的效应低于其正常量产生的生理效应。研究[1]证实,IR是肥胖、2型糖尿病、代谢综合征、冠心病等疾病的病理基础。胰岛素受体(Insulin Receptor,InsR)是胰岛素信号转导通路的重要因子,胰岛素首先要与其结合才能激活其下游效应因子,其数量的减少和(或)活性的降低都会影响胰岛素信号转导通路的正常传导,降低胰岛素的生理效应,导致胰岛素抵抗[2]。核糖体S6蛋白激酶(Ribosomal S6 kinase,P90rsk)是丝裂原激活蛋白激酶的下游底物 ,可被其磷酸化而激活 ,进而磷酸化糖原合成酶激酶-3(GSK-3),糖原合成 ,血糖降低[3]。目前中医采用电针治疗本病已较为多见,而对其治疗机制研究较少,故本实验对比观察电针联合饮食控制干预对IR模型大鼠InsR和P90rsk蛋白表达的影响,探讨其控制增强IR模型大鼠对胰岛素敏感性的机制。
1 材料与方法
1.1 动物分组与模型建立 70只清洁级雄性SD大鼠 ,4周龄 ,体质量(90±10)g,由重庆医科大学实验动物中心提供,医学动物许可证号:SCXK(渝)2012- 0002。随机选取10只为普食组(common diet group,CD,n=10),余下60只为高脂高糖组(high-fat and high-carbohydrate diet group,HFHCD,n=60)。饲料配方为:100 g高脂高糖饲料=60 g普通基础饲料+25 g蔗糖+15 g猪油[4]。从第5周开始 ,每周CD组和HFHCD组大鼠采血1次,检测FPG、INS,并计算ISI=1/(空腹血糖×空腹胰岛素)[5]。8周后 ,与CD组比较,FPG、INS显著升高(P<0.05),ISI显著下降(P<0.05)为IR模型大鼠造模成功的标准,最终得到模型大鼠44只。从中随机选取40只分为高脂高糖1组(HFHCD 1),高脂高糖2组(HFHCD 2),电针1组(electroacupuncture 1,EA 1),电针2组(electroacupuncture 2,EA 2),n=10。CD组、HFHCD 2组、EA 2组普食喂养,HFHCD 1组、EA 1组高脂高糖饲料喂养。
1.2 试剂与仪器 主要试剂:葡萄糖测定试剂盒(上海荣盛生物药业公司);大鼠胰岛素ELISA试剂盒(美国R&D公司);Ⅰ抗:InsR抗体和P90rsk抗体(上海sab公司);Ⅱ抗:辣根过氧化物酶标记抗体(北京中杉生物公司)。主要仪器:Gel Doc 2000凝胶成像分析系统(美国BlO-Rad);DYY-6C电泳仪(北京六一仪器厂);DU640核酸蛋白分析仪(美国Backman公司);华佗牌针灸针(苏州医疗用品厂有限公司);华佗牌SDZ-Ⅱ型电针仪(苏州医疗用品厂有限公司)。
1.3 针刺方法 针刺双侧后三里、三阴交(均斜刺5 mm),胃脘下俞(斜刺3 mm),同侧后三里和胃脘下俞电刺激20 min,连续治疗14 d。电针参数[6]:疏密波,疏波频率4 Hz,密波频率20 Hz,3 mA。穴位定位[7]:后三里位于后肢膝关节后外侧 ,在腓骨小头下约5 mm;三阴交位于后肢内踝尖直上10 mm;胃脘下俞位于背部第8胸椎棘突下,旁开5 mm。其余3组以同等条件固定20 min,无治疗。
1.4 标本采集 大鼠禁食过夜,腹腔注射10%水合氯醛(0.3 mL/100 g)进行麻醉,注射器直接刺入心脏取血2~3 mL,3 000 r/min离心10 min,取上层血清置于-20℃冰箱待测。用空气栓塞法处死大鼠,迅速分离股四头肌置于液氮罐中,转移至-80℃冰箱中待测。
1.5 指标检测
1.5.1 称量大鼠体质量 每周固定时间由同一人员称量各组大鼠体质量并记录。
1.5.2 葡萄糖氧化酶法测定血糖浓度 取3支洁净的试管分别标记为Ⅰ管 (空白管)、Ⅱ管 (标准管)、Ⅲ管 (测定管),各管先加入酶酚混合试剂3 mL,然后Ⅰ管加蒸馏水0.02 mL,Ⅱ管加葡萄糖标准应用液0.02 mL,Ⅲ管加血清0.02 mL。充分混匀后置于37℃水浴15 min,在波长505 nm下测定Ⅱ管和Ⅲ管的吸光度值 (A)。计算方法 :血清葡萄糖(mmol/L) = (AⅢ/AⅡ) ×5。
1.5.3 酶联免疫吸附法检测空腹胰岛素浓度 提前20 min将浓缩洗涤液用蒸馏水稀释20倍后备用。按照表1所示加入各内容物。然后盖上封板膜,混匀后在37℃下温育60 min。揭掉封板膜,倒掉液体 ,用配置好的洗涤液重复洗板5次。每孔再加入显色液A、B各50 μL,混匀后37℃避光显色10 min。最后每孔再加入终止液50 μL,震荡混匀后在450 nm波长下测定吸光度(OD值),以空白孔调零,根据标准品浓度及对应的OD值计算样品浓度。见表1。
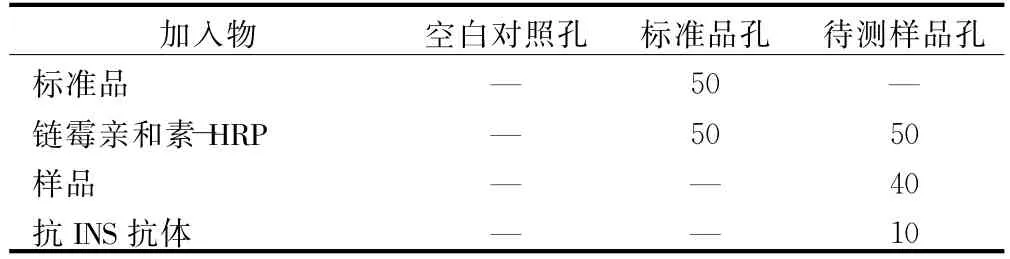
表1 酶联免疫吸附法加样表 μL
1.5.4 Western Blot检测InsR和P90rsk蛋白表达量取股四头肌约40 mg,加入配制好的缓冲液0.4 mL,充分匀浆搅碎,冰上裂解,离心后取上清;配制标准蛋白液,测定蛋白浓度;加入缓冲液100 μL,煮沸6 min。根据蛋白浓度计算出所需上样量为50 μg,电泳,转膜。将转好的PVDF膜置于95%乙醇中固定后自然晾干,1%PBST洗5 min,放入5%脱脂奶粉中封闭,37℃恒温摇床下4 h;加I抗体(1∶1 000),37℃恒温摇床下3 h,1%PBST洗3次;加 HRP标记的二抗(1∶1 000),室温1 h,1%PBST洗3次;用化学发光法检测,在暗室中使X线片爆光,显影,定影,并扫入凝胶成像系统进行图像分析,以目的条带与内参条带的灰度比值代表InsR和P90rsk在标本中的蛋白表达水平。
1.6 统计学方法 数据结果以均数±标准差(¯x±s)表示,采用SPSS 19.0统计软件处理实验数据,以单因素方差分析进行多组间的比较,采以Duncan检验比较多组间的均数,以 P<0.05为差异有统计学意义。
2 实验结果
2.1 各组大鼠体质量的比较 见表2。
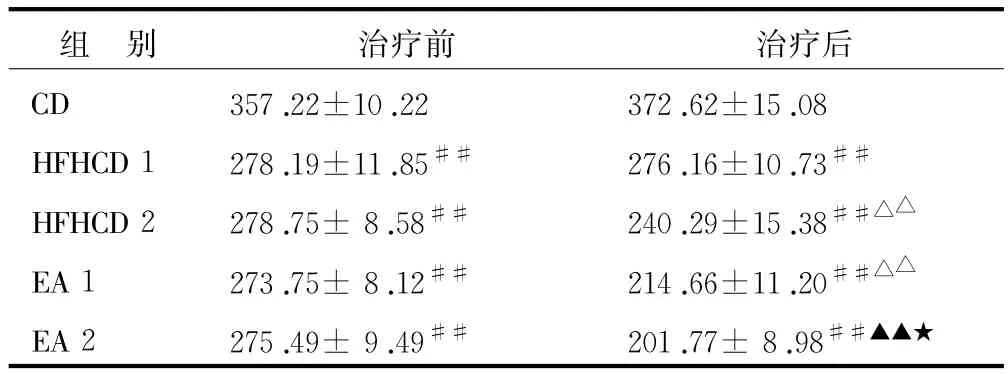
表2 电针治疗前后胰岛素抵抗模型大鼠体质量变化的比较(¯x±s,n=10)g
2.2 电针对大鼠FPG、INS、ISI的影响 见表3。

注 :与CD组比较 ,##P<0.01;与 HFHCD 1组比较 :△△P<0.01;与HFHCD 2组比较 ,▲▲P<0.01;与EA 1组比较 :★★P<0.01
2.3 电针对大鼠骨骼肌InsR和P90rsk蛋白表达的影响 见表4,图1。
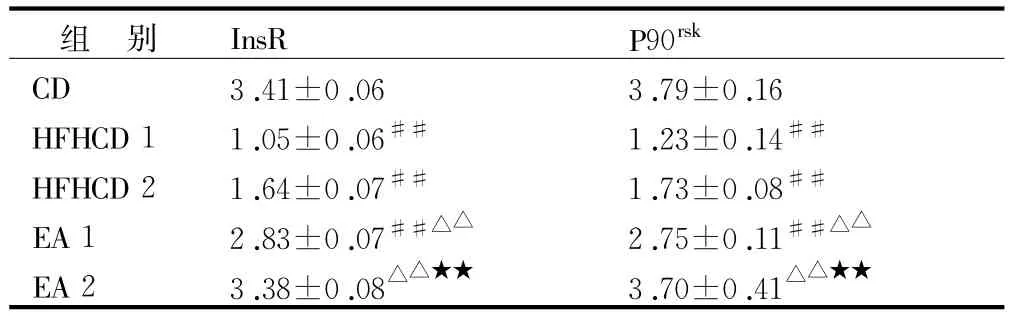
表4 电针联合饮食控制对胰岛素抵抗模型大鼠InsR和P90rsk蛋白表达的影响比较(¯x±s,n=10)
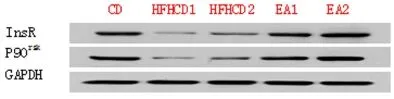
图1 电针联合饮食控制对胰岛素抵抗模型大鼠InsR和P90rsk蛋白表达的影响比较
3 讨论
胰岛素的正常生理效应主要是通过两条信号途径来实现的,一是IR-IRS-PI3K途径,另一条是MAPK途径。胰岛素与其受体InsR结合后,可激活Grb2/SOS,活化RAS蛋白,使MAPK得以激活,进而使其下游底物P90rsk活化,其可促使葡萄糖转运子4(GLUT4)通过易位作用使葡萄糖转移到细胞膜上,使其被摄取利用,血糖降低;P90rsk还可磷酸化GSK-3而使其失活,糖原合成酶恢复活性而促使糖原合成 ,血糖降低[8-10]。
电针可以降低血糖水平,增强机体对胰岛素的敏感性[11],调节胰岛素的分泌 ,降低血脂 ,减少肝脂肪堆积和变性 ,阻止胰腺功能恶化[12]。本课题组前期研究[13]也已证实 ,电针可影响IR-IRS-PI3K途径的传导,为更进一步完善电针改善胰岛素抵抗的机制,故本实验通过观测MAPK途径的主要效应因子InsR和P90rsk蛋白表达水平的变化,探讨电针改善胰岛素抵抗的机制。
FPG、INS、ISI结果显示,连续高脂高糖饲料喂养8周后,HFHCD组大鼠体内INS较CD组明显升高(P<0.05),而其FPG却并未显著降低,说明大鼠机体对胰岛素的敏感性降低,而治疗干预后EA组较HFHCD组FPG、INS均显著降低,说明机体对胰岛素的敏感性得以提升。InsR和P90rsk蛋白表达量结果显示,机体发生IR后其表达量显著降低,即HFHCD组显著低于CD组(P<0.05),造成葡萄糖转运障碍、糖原合成减少 ,使血糖升高,而电针治疗和(或)饮食控制对其表达量的影响十分显著,即EA组显著高于HFHCD组(P<0.05),从而改善了骨骼肌葡萄糖的转运,以及增加了糖原的合成量,使血糖降低。
综上所述,电针联合饮食控制能够增加机体对胰岛素的敏感性,改善胰岛素抵抗状态,其机制之一可能是通过提高InsR和P90rsk蛋白表达水平,从而达到其治疗作用。
[1]MOHAN V,SANDEEP S,DEEPA R,et al.Epidemiology of type 2 diabetes:Indian scenario[J].The Indian Journal of Medical Research,2007,125(3):217-230.
[2]SUN J,XU N,YI W,et al.Effect of Acupuncture on Expressions of InsR-β mRNA and Protein in the Liver of Rats with Insulin Resistance[J].Journal of Acupuncture and Tuina Science,2009,7:196-199.
[3]戚智锋,李俊发 .核糖体S6蛋白激酶的生物学特性和功能[C]//中国生理学会论文汇编第三期,北京:中国生理学会 ,2006.
[4]王艳军 ,孙巍巍 ,张丽霏 ,等 .胰岛素抵抗大鼠肌肉中IRS-1、P70S6K的表达[J].中国现代医学杂志 ,2009,19(11):1617-1619.
[5]李光伟 .检测人群胰岛素敏感性的一项新指数[J].中华内科杂志 ,1993,32(10):656-660.
[6]郜婕 ,唐成林 ,刘仁建 ,等 .不同强度电针对肥胖大鼠附睾脂肪细胞内质网应激的影响[J].中国病理生理杂志 ,2013,29(2):354-357.
[7]李忠仁 .实验针灸学[M].北京 :中国中医药出版社 ,2003:255-257.
[8]王艳军 .PKB、GSK、P70S6K在胰岛素抵抗大鼠中的表达[D].沈阳:中国医科大学,2007.
[9]李梅.针刺调节胰岛素抵抗模型大鼠IRS-1、IRS-2和GLUT4的实验研究[D].广州:广州中医药大学,2011.
[10]ZISMAN A,PERONI O D,ABEL E D,et al.Targeted disruption of the glucose transporter 4 selectively in muscle causes insulin resistance and glucose intolerance[J].Nature Medicine,2000,6(8):924-928.
[11]CHANG S L,LIN K J,LIN R T,et al.Enhanced insulin sensitivity using electroacupuncture on bilateral Zusanli acupoints(ST 36)in rats[J].Life Sciences,2006,79(10):967-971.
[12]王静芝,王华 ,周焕娇,等 .电针对胰岛素抵抗大鼠下丘脑磷脂酰肌醇3激酶及磷脂酰肌醇3激酶催化亚基蛋白表达的影响[J].针刺研究 ,2014,39(1):46-51.
[13]唐念珍 ,唐成林,杨辉,等 .电针对胰岛素抵抗模型大鼠GLUT4和GSK-3β mRNA表达的影响[J].中国组织化学与细胞化学杂志 ,2014,23(5):394-400.
Effect of electroacupunctrue and alimentary control on content of InsR and P90rskprotein in insulin resistance rat
TANG Nianzhen1,TANG Chenglin1*,TANG Sishi2,YANG Hui3ZHANG Yi1,TIAN Yuan1,YUAN Haizhou1,CAO Jing1,GAO Ruiqi1
(1.Chinese Medical College,Chongqing Medical Universiity,Chongqing 400016,China;2.The First Clinical College,Chongqing Medical Universiity,Chongqing 400016,China;)
Objective To investigate the effect of electroacupunctrue and alimentary controlon strengthening mechanism of insulin sensitivity on the content of InsR and P90rskprotein in insulin resistance rat.Methods Seventy SD rats were randomly divided into common diet group(n=10)and high-fat and high-carbohydrate diet group(n=60).Forty rats of insulin resistance in high-fat and high-carbohydrate diet group were chosen and divided into HFHCD 1 group,HFHCD 2 group,EA 1 group and EA 2 group(n=10 each).Electroacupunctrue was applied for 20 min once daily for 14 days.The changes of body weight,blood glucose and insulin were detected.The expression of InsR and P90rskprotein in insulin resistance rat was determined by real time fluorescence quantitative PCR.Results Expression of InsR and P90rskprotein:HFHCD was significantly lower than that of CD(P<0.01),EA was significantly higher compared with HFHCD(P<0.01),HFHCD2 was significantly higher compared with HFHCD1(P<0.01),EA2 was significantly higher compared with EA1(P<0.01).Conclusion Electroacupunctrue and alimentary control can increase the expression of InsR and P90rskprotein,and increased glycogen synthesis,and restore insulin sensitivity,and improvement of insulin resistance.
electroacupunctrue;alimentary control;insulin resistance;InsR;P90rsk
R245.3
A
2095-6258(2015)04-0676-04
2015-02-28)
国家自然科学基金“按摩改善受损肌肉组织微循环重构及有氧代谢相关酶活性变化促进急性肌肉损伤临床康复机理研究”(81273870)。
唐念珍(1989-),女 ,硕士研究生 ,主要从事针灸减肥研究。
*通信作者:唐成林,男,教授,电话-13452083746,电子信箱-CYTCL996@163.com
10.13463/j.cnki.cczyy.2015.04.006
