布拉氏酵母菌散预防抗生素相关性腹泻的临床分析
2015-06-27吴小勇陆洪侠杨海霞吴红艳
吴小勇,陆洪侠,杨海霞,吴红艳
(1.陕西省安康市石泉县医院,陕西 安康725200;2.西安交通大学附属第一医院,陕西 西安710061)
布拉氏酵母菌散预防抗生素相关性腹泻的临床分析
吴小勇1,陆洪侠1,杨海霞1,吴红艳2
(1.陕西省安康市石泉县医院,陕西 安康725200;2.西安交通大学附属第一医院,陕西 西安710061)
目的 探讨布拉氏酵母菌(SB)对儿童抗生素相关性腹泻(AAD)的预防作用。方法 将2014年1月至12月来自陕西省安康市石泉县医院儿科住院诊治为支气管炎和肺炎的患儿180例,随机分为观察组(90例)和对照组(90例),两组均给予静脉抗生素应用及对症支持治疗,观察组在开始使用抗生素时即口服布拉氏酵母菌散剂,对照组未予以布拉氏酵母菌散剂。比较两组患儿AAD发生率、大便次数及腹泻持续时间。结果 观察组21例(23.3%)发生AAD,对照组30例(33.3%)发生AAD,两组患儿AAD发生率差异有统计学意义(χ2=4.078,P<0.05);治疗组AAD患儿腹泻持续时间(3.19±0.68)d,对照组AAD患儿腹泻持续时间(5.24±0.79)d,两组比较差异有统计学意义(t=-10.115,P<0.05)。结论 布拉氏酵母菌不仅能有效预防AAD的发生率,而且能够缩短婴幼儿AAD的腹泻持续时间。
布拉氏酵母菌;预防;抗生素相关性腹泻;儿童
抗生素相关性腹泻(antibiotic associated diarrhea,AAD)是指应用抗生素后发生的,与抗生素有关的且没有其它原因可以解释的腹泻,也包括抗生素本身的不良反应所导致的腹泻,分为金黄色葡萄球菌肠炎、假膜性小肠结肠炎、真菌性肠炎[1]。本研究通过给住院呼吸道感染患儿在抗生素治疗同时口服布拉氏酵母菌散剂,来探讨布拉氏酵母菌(SB)对儿童抗生素相关性腹泻的预防和治疗作用。
1 资料与方法
1.1 研究对象
选择陕西省安康市石泉县医院儿科2014年1至12月诊治的支气管炎和肺炎的患儿,诊断标准参照《诸福棠实用儿科学》第7版。入选标准:①年龄6月~8岁住院儿童,需应用抗生素治疗的;②入院时大便外观性状和次数无异常;③大便镜检无异常。
排除标准:①入院时即存在腹泻或入院48h内出现腹泻者;②存在其他基础疾病或病情危重者;③长期接受免疫抑制剂治疗者;④院内出现腹泻但经实验室检查证实为轮状病毒等继发感染者;⑤未完成治疗而要求出院者;⑥因糖皮质激素对消化道屏障的削弱作用,经静脉使用了甲强龙等糖皮质激素者。
1.2 病例分组
进行抗生素治疗的呼吸道感染患儿180例,出生时情况均无异常,生后发育情况同同龄儿,其中肺炎127例,支气管炎53例,男102例,女78例。接受广谱抗生素治疗>7天,给药途径均为静脉点滴,但在实验前未使用过布拉氏酵母菌。将其随机分为两组,观察组90例,对照组90例,两组患儿性别、年龄、病情、抗生素使用情况等均无统计学差异(均P>0.05),具有可比性。
1.3 方法
观察组90例,疗程7~10d者42例,11~15d者48例;对照组90例,疗程7~10d者47例,11~15d者43例。两组均给予静脉抗生素应用及对症支持治疗,种类包括青霉素类、头孢菌素类、大环内酯类,支持对症治疗即解热、化痰、平喘、止咳等治疗。观察组在静脉使用抗生素同时,给予口服布拉氏酵母菌散剂(商品名),[每袋含0.25g(1亿活菌),注册证号S20100086]。1~6个月婴儿0.125g/qd,>6个月~1岁0.125g/bid,>1~3岁0.25g/bid,连续服用7d。出现腹泻后继续服用,观察期间禁用其他益生菌制剂;对照组仅给予抗感染和肺炎相关支持对症治疗,病例发生腹泻后,不用布拉氏酵母菌散剂和其他益生菌,仅予补充电解质、补液、纠酸等对症处理,并予蒙脱石散、消旋卡多曲等口服。
1.4 观察指标
观察患儿在观察疗程内(7d)大便次数及性状,脱水的情况,发热、呕吐等全身情况的变化,AAD发生率、腹泻程度以及腹泻持续天数。确诊为AAD者进行大便常规、大便培养化验,大便呈蛋花汤样者进行轮状病毒检测以排除轮状病毒性肠炎。
1.5 预防效果评价标准
预防效果评价标准:显效:治疗7d,大便性状及次数恢复正常,无发热、呕吐、乏力等临床症状;有效:治疗7d,大便性状好转,次数减少,体温趋于正常,呕吐及乏力等症状基本消失;无效:治疗7d,大便次数增多,大便性状无好转,体温继续升高,呕吐及乏力等症状无好转及改善。总有效率=(总例数-无效例数)/总例数×100%。
1.6 统计学方法
使用SPSS 19.0统计软件对观察数据资料进行分析,两组腹泻的发生率、腹泻程度以及治疗效果的比较采用χ2检验,腹泻持续天数的比较采用t检验,检验水准为P<0.05,表示差异具有统计学意义。
2 结果
2.1 患儿病情缓解情况
观察组:大便每天7~10次者15例,>10次者6例,水样便13例,粘液便8例,6例伴脱水体征,4例合并发热、呕吐症状。经7d治疗,大便每天7~10次者7例,>10次者1例。对照组:大便每天7~10次者23例,>10次者7例,水样便18例,粘液便12例,8例伴脱水体征,6例合并发热、呕吐症状。经7d治疗,大便7~10次者6例,>10次者8例。
2.2 治疗效果比较
与对照组相比,观察组发生AAD的几率低于对照组;观察组显效率、有效率均高于对照组,总有效率比较,两者有统计学差异(χ2=4.078,P<0.05),见表1。
表1 治疗效果比较[n(%)]
Table 1 Comparison of treatment effect[n(%)]
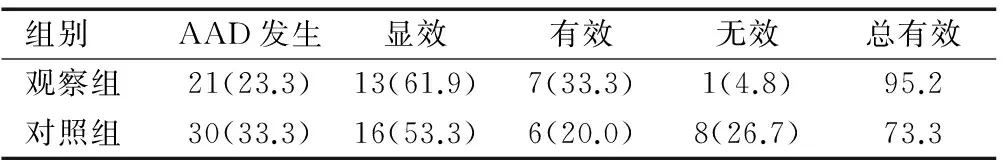
组别AAD发生显效有效无效总有效观察组21(23.3)13(61.9)7(33.3)1(4.8)95.2对照组30(33.3)16(53.3)6(20.0)8(26.7)73.3
2.3 腹泻持续时间比较
与对照组相比,观察组腹泻持续天数较对照组缩短,两者有统计学差异(t=-10.115,P<0.01)见表2。



组别例数腹泻持续时间(d)观察组21(23.3)3.19±0.68对照组30(33.3)5.24±0.79
3 讨论
3.1 我国目前抗生素相关性腹泻的现状
据统计,呼吸系统疾病,尤其是社区获得性肺炎,是儿童住院的最常见原因,也是5岁以下儿童死亡的首位病因[2]。在治疗呼吸道疾病中抗生素药物普遍使用,虽然取得了一定的疗效,挽救了患儿的生命,但也产生了一系列不容忽视的问题,其常见的副反应中AAD受到越来越多的重视。
AAD的发生机制可能为:厌氧菌活性受抗生素抑制,糖类代谢降低,多糖发酵减少,未经发酵的多糖滞留于肠道引起渗透性腹泻;肠道正常定置菌群受抗生素破坏,条件致病菌过度繁殖;抗生素直接损害肠黏膜肠上皮纤毛,降低细胞内酶活性[3]。研究显示使用广谱抗生素的患儿AAD发生率高达1l%~40%[4]。
3.2 微生态制剂的应用和机制
近年来,应用微生态制剂是减少AAD发生的一个有效措施,其通过调节肠道菌群平衡而起到预防作用,益生菌可促进肠道正常菌群平衡、直接抑制病原菌生长、分泌抗致病菌毒素蛋白和增强肠道免疫屏障功能,从而减少腹泻天数、减轻脱水程度[5]。有关研究证实,益生菌能够明显降低AAD的发生率,其中真菌类益生菌制剂可能对预防AAD的作用最明显[6]。在国外临床研究证实SB可有效预防儿童AAD的发生,但是国内尚没有大规模的有关SB预防儿童AAD的研究[7]。
SB在预防和治疗AAD方面具有多种机制:①拮抗毒素作用:有关研究显示布拉氏酵母菌能够能够拮抗难辨梭菌毒素和大肠杆菌脂多糖[8];②抗菌活性:SB不仅能够直接抑制致病菌生长,还能够增强肠上皮细胞间的紧密连接,减少病原菌的入侵[6],以减少病原体的移位,通过细胞壁甘露聚糖直接吸附细菌,减少细菌对肠上皮细胞的攻击,保护肠上皮细胞间紧密连接;③促进肠道正常菌群平衡。SB对正常微生物菌群没有影响,还能够使肠道内的菌群更快地恢复正常水平,达到平衡状态[7];④代谢活性:增加肠道短链脂肪酸,改变肠道pH,有利于正常肠功能的恢复;⑤酶活性:刺激产生蛋白质和能量,合成多胺类物质(精胺和亚精胺),加速肠上皮细胞成熟;提高刷状缘双糖酶(蔗糖、乳糖、麦芽糖酶)的活性,促进粘膜再生修复,促进病毒性腹泻的恢复;⑥刺激和调节免疫功能:SB能够增加肠粘膜代谢,刺激肠粘膜分泌SlgA,提高肠道的免疫功能;⑦抗炎活性:SB可抑制致病微生物的生长繁殖、抑制其对粘膜细胞的粘附和侵袭;刺激肠道粘膜分泌SlgA和其它免疫球蛋白,增强肠道免疫屏障功能;促进粘膜再生修复。
3.3 布拉氏酵母菌的优点
SB是一种真菌类微生态制剂,对人类无致病性,它不仅可以暂时性的充当胃肠道中的益生菌,维持或重建胃肠道内的微生态平衡,而且对致病微生物还有较强的抑制生长繁殖,释放短肽蛋白钝化,中和、降解细菌毒素,保护胃肠道黏膜上皮细胞免受致病微生物的侵袭[9]。
SB与其它微生态制剂相比具有多种优点,它与细菌不发生遗传物质传递;抗生素不能与其真菌的核蛋白体结合,不会影响其核酸合成,具有天然耐抗生素的特点,可与抗生素同时服用,不会被胃酸、胆汁和各种消化酶所破坏,常温保存不影响疗效,安全无副作用,通过其促进肠道正常菌群平衡,重建肠道微生态及分泌糖蛋白对抗毒素,促进SIgA分泌,增强肠道免疫屏障,减少炎症介质合成等作用,从而有效地降低了抗生素相关性腹泻的发生率,提高治疗效果,缩短了患儿住院时间。
本次临床应用SB预防AAD结果显示,使用抗生素同时,正确使用SB,与对照组比较,腹泻发生率降低,持续时间缩短,腹泻严重程度也明显减轻,使用期间未见不良反应出现,使用安全。本研究对AAD的观察时间仅限于住院期间(一般在1周内),但AAD可发生于使用抗生素后2个月内,因此,SB对AAD的远期影响作用,还有待进一步研究。
[1]王卫平.儿科学[M].8版北京:人民卫生出版社,2013:257.
[2]中华医学会儿科学分会呼吸学组,《中华儿科杂志》编辑委员会.儿童社区获得性肺炎管理指南(2013修订)(上)[J].中华儿科杂志,2013,51(10):745-752.
[3]王晓冬,胡新房.布拉氏酵母菌对婴幼儿抗生素相关性腹泻的防治作用[J].中国保健营养(上旬刊),2013,23(6):3178.
[4]李云芳,黄开宇.布拉氏酵母菌预防婴儿抗生素相关性腹泻临床分析[J].温州医学院学报,2013,43(4):254-256.
[5]Freeman J, Bauer M P, Baines S D,etal.The changing epidemiology of Clostridium difficile infections[J]. Clin Microbiol Rev, 2010,23(3):529-549.
[6]Louie T J,Miller M A,Mullane K M,etal. Fidaxomicin versus Vancomycin for Clostridium difficile Infection[J].N Engl J Med,2011,364(5):422-431.
[7]李文丽,刘文恩.艰难梭菌相关性腹泻诊疗进展[J].国际检验医学杂志,2010,31(10):1119-1121.
[8]Lane J A, Mehra R K, Carrington S D,etal.The food glycome:A source of protection against pathogen colonization in the gastrointestinal tract[J].Int J Food Microbiol,2010,142(1-2):1-13.
[9]张胜安.布拉氏酵母菌对小儿急性腹泻的治疗作用及对细胞免疫功能的影响[J].中国生化药物杂志,2012,33(5):662-664.
[专业责任编辑:刘黎明]
Clinical analysis of Saccharomyces boulardii in prevention of infant antibiotic associated diarrhea
WU Xiao-yong1, LU Hong-xia1, YANG Hai-xia1, WU Hong-yan2
(1.HospitalofShiquanCountry,ShaanxiAnkang725200,China;2.TheFirstAffiliatedHospitalofMedicalCollege,Xi’anJiaotongUniversity,ShaanxiXi’an710061,China)
Objective To explore the prevention of antibiotic associated diarrhea (AAD) by Saccharomyces boulardii (SB) in infants.Methods There were 180 cases of bronchitis and pneumonia from pediatrics department of Hospital of Shiquan Country in the period of January to December in 2014. They were randomly divided into treatment group (90 cases) and control group (90 cases) with intravenous antibiotics and support therapy. The treatment group was given oral SB at the beginning of antibiotics use, while the control group did not take SB. Two groups were compared in terms of the incidence of AAD,defecate frequency and duration of diarrhea. Results There were 21 cases (23.3%) and 30 cases (33.3%) suffering AAD in the treatment group and the control group, respectively, and the difference in AAD incidence was significant (χ2=4.078,P<0.05). The duration of AAD was 3.19±0.68d in the treatment group and 5.24±0.79d in the control group with significant difference between two groups (t=-10.115,P<0.05).Conclusion BS can prevent AAD in infants effectively, and it also can shorten the duration of AAD.
Saccharomyces boulardii (SB); prevention; antibiotic associated diarrhea (AAD); infants
2015-03-03
吴小勇(1972-),男,主治医师,主要从事儿科疾病的诊治。
吴红艳,副主任医师。
10.3969/j.issn.1673-5293.2015.03.055
R725.7
A
1673-5293(2015)03-0557-02
