P2X2受体在匹罗卡品致慢性癫痫发作大鼠海马组织中表达增高*
2015-06-24宋鹏辉李钢琴黄昭昭关秀军邓学军
刘 艳, 宋鹏辉, 李钢琴, 黄昭昭, 关秀军, 胡 敬, 邓学军△
1武汉市第八医院神经内科,武汉 430010
2华中科技大学同济医学院附属协和医院神经内科,武汉 430022
P2X2受体在匹罗卡品致慢性癫痫发作大鼠海马组织中表达增高*
刘 艳1, 宋鹏辉2, 李钢琴1, 黄昭昭1, 关秀军1, 胡 敬2, 邓学军2△
1武汉市第八医院神经内科,武汉 430010
2华中科技大学同济医学院附属协和医院神经内科,武汉 430022
目的 通过研究匹罗卡品致癫痫大鼠海马组织中P2X2受体(嘌呤受体)的表达变化,探讨其在颞叶癫痫发病中的作用机制。方法 应用氯化锂-匹罗卡品腹腔注射建立大鼠颞叶癫痫模型,并予以P2X2受体拮抗剂亮蓝G(Brilliant Blue G,BBG)腹腔注射,应用Western blot及Real-time PCR技术检测大鼠海马组织P2X2受体的表达,免疫组化技术检测各组大鼠海马组织中谷氨酸(glutamate,GLU)表达水平。结果 Western blot及Real-time PCR结果显示:慢性自发性癫痫发作组中P2X2表达明显增高(P<0.05),BBG干预组表达减低P<0.05)。免疫组化检测显示:GLU在BBG干预组较慢性自发性发作组中释放减少(P<0.05),且与BBG剂量呈负相关性。结论 P2X2受体通路可能参与颞叶癫痫的发病过程,并有望成为新一代治疗颞叶癫痫的药物靶点。
颞叶癫痫, P2X2受体, 亮蓝G, 谷氨酸
癫痫是中枢神经系统常见疾病之一,尽管目前已有多种抗癫痫药物应用于临床,但仍有三分之一的癫痫患者出现复发情况。颞叶癫痫是成人癫痫类型中最易复发的,约80%患者的癫痫发作未能完全控制[1]。
ATP是一种广泛分布于中枢神经系统的兴奋性神经递质,通过与相应受体结合而发挥多种生物学功能。ATP受体包括促离子型的P2X受体和促代谢型的P2Y受体[23]。P2X受体的所有亚型均在中枢神经系统内表达,其中,P2X2受体多表达于神经元细胞[4]。作为突触传递的中间部分,P2X受体不仅参与调节神经递质的释放及突触可塑性的调节,也可参与神经胶质细胞之间及神经元与神经胶质细胞之间的联系[5],但其是否参与慢性癫痫发作尚未可知。本实验采用匹罗卡品致痫模型,检测慢性自发性癫痫发作大鼠海马组织中P2X2受体及谷氨酸(glutamate,GLU)的表达,旨在阐明P2X2受体在慢性癫痫大鼠海马组织的变化及其可能的作用机制。
1 材料与方法
1.1 实验动物
本实验研究符合华中科技大学实验动物管理条例的相关规定,并获得华中科技大学实验动物伦理委员会批准。在实验研究过程中,尽最大努力为实验动物创造最舒适的环境并减少实验动物在实验操作中所承受的痛苦。本实验使用SD雄性大鼠90只,体重范围为200~250 g,均来源于华中科技大学同济医学院实验动物学部。饲养环境标准为:温度维持在24~25℃,湿度维持在50%~60%,人为创造12 h昼夜交替,并保证充足的饮用水以及饲料供应。
1.2 实验试剂
主要试剂与材料:氯化锂(Sigma-Aldrich公司);盐酸匹罗卡品(Sigma-Aldrich公司);硫酸阿托品针剂(购自上海禾丰制药有限公司);安定针剂(购自天津制药有限责任公司);10%水合氯醛(购自武汉协和医院药剂科);兔抗P2X2受体一抗(美国Abcam公司);亮蓝G(BBG,Sigma-Aldrich公司);氯化锂粉剂以及盐酸匹罗卡品粉剂均采用生理盐水(购自青岛华仁药业有限公司)溶解后,于室温避光保存。Nondrop2000微量分光光度计(Thermo公司);实时荧光定量PCR仪(ABI公司)。
1.3 大鼠颞叶癫痫动物模型构建
1.3.1 实验分组及模型构建 SD雄性大鼠90只,随机选取6只腹腔注射生理盐水为正常对照组,进行癫痫模型制作的大鼠共84只,分批给予大鼠腹腔注射氯化锂溶液预处理(127 mg/kg),17.5 h后,腹腔注射硫酸阿托品(1 mg/kg),30 min后,腹腔注射匹罗卡品水溶液(15 mg/kg)。4只于注射药品时死亡,余80只分批建立颞叶癫痫模型,依其行为学改变确定癫痫鼠模型,共有63只(75.0%)大鼠出现急性癫痫发作,急性期内大鼠未见进食,其中13只因未能及时终止而死亡;44只诱发癫痫持续状态的大鼠在24 h后进入潜伏期,行24 h视频监测,最终确定出现慢性自发性痫性发作的大鼠28只(33.3%),随机分为4组:癫痫模型组(注射生理盐水)、BBG 50 mg/kg组、BBG 100 mg/kg组、BBG 200 mg/kg组(每组7只),依组别给予相应药物2周。
1.3.2 行为学观察 癫痫发作严重程度参照Racine分级标准划分为5个等级:①咀嚼运动,即面部肌肉抽搐;②规律性点头运动;③前肢的阵挛运动;④四肢的阵挛运动以及站立不稳;⑤大鼠旋转、全身阵挛及左右摇晃跌倒。模型建立成功的标准为大鼠发作等级必须达到≥4级的分级标准。若大鼠癫痫发作严重程度<4级,则按30 min的时间间隔以质量分数为15 mg/kg的标准再次注射匹罗卡品溶液。经4次注射匹罗卡品后(总剂量为60 mg/kg),大鼠仍未达到≥4级的发作,则不再注射。成功诱发癫痫持续状态的大鼠,在其癫痫持续状态持续1 h后,以腹腔注射安定(10 mg/kg)终止癫痫持续状态[6]。
1.4 实验方法
1.4.1 脑电图监测 大鼠麻醉后,常规固定四肢于木板上,按常规方法检测脑电图。
1.4.2 Western blot检测P2X2受体 取各组冷冻海马组织块常规裂解提取蛋白,采用二喹啉甲酸(BCA)试剂盒测定蛋白浓度,以每孔20μg的上样量行聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,湿法转膜至PVDF膜,脱脂牛奶封闭1 h后,以兔抗P2X2受体一抗4℃孵育过夜,TBST漂洗(10 min ×3次),以辣根过氧化物酶标记的二抗(武汉谷歌生物有限公司)室温孵育2 h,TBST洗膜,ECL显影,以β-actin为内参拍照分析。
1.4.3 Real-time PCR检测P2X2受体 取约100 mg冰冻大鼠海马组织提取RNA,测定RNA浓度及纯度(A260/280在1.80~1.95之间),逆转录得到cDNA模板后,以β-actin作为内参,按照PCR试剂盒SYBR GreenⅠ的操作说明行cDNA扩增,采用2-ΔΔCt法进行PCR数据分析[78]。同一实验重复3次,取其平均值。引物序列如下:P2X2 receptor F: TCTGGGACTACGAGAC-GCCTAA;R:CGAAGTAAAGCAGGATGAGAAGC;β-actin F:TGCTATGTTGCCCTAGACTTCG;R:GTTGGCATAGAGGTCTTTACGG。
1.4.4 免疫组织化学技术检测谷氨酸 大鼠脑组织石蜡切片采用梯度乙醇常规脱蜡,修复抗原,0.01 mol/L PBS缓冲液漂洗(5 min×3次),0.3% H2O2溶液封闭内源性过氧化物酶活性(15 min),山羊血清封闭(20 min,室温),兔抗谷氨酸一抗(1∶500)4℃孵育过夜,使用PBS缓冲液代替一抗作为阴性对照,PBS漂洗后二抗室温孵育40 min。免疫组化染色采用SABC法,DAB显色,苏木精复染。每张切片在相同放大倍数(×200)、相同光强度下拍摄,经灰度调节后用Image-Pro plus 6.0测量切片上阳性反应物的平均吸光度值。用平均吸光度值表示阳性颗粒表达强度。
1.5 统计学分析
数据输入SPSS 19.0数据处理软件,计量资料以均数±标准差表示,多组间均数比较采用单因素方差(AVONA)分析,两两比较采用SNK检验,以P<0.05为差异有统计学意义。
2 结果
2.1 脑电图记录
选用水合氯醛为镇静剂来麻醉大鼠,以行头皮脑电图。大鼠经腹腔注射水合氯醛后,束缚固定于操作台上,2枚针灸针作为电极,插入与颞叶相对的头皮处(位于内耳门前方0.65 cm,中线旁0.4 cm),参考电极置于两眼外眦连线之间的皮下。脑电图信号经0.53 Hz及30 Hz的频率滤波后,输入脑电信号采集系统。正常对照组的脑电图波形主要以α波为主,并伴有低幅度的β波及少量的δ波,几乎未捕捉到棘波发放。慢性自发性发作组大鼠的脑电图出现较为规律的棘波发放,其频率多集中于28 Hz,波幅不高于200μV。BBG干预组的脑电图特点为在各个簇状棘波发放的波形后存在平直线性波形(图1)。
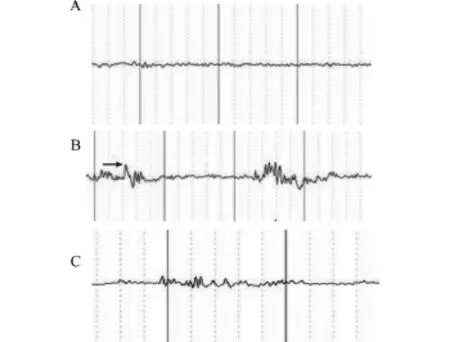
图1 典型脑电图记录Fig.1 Typical electroencephalogram record of rats
2.2 行为学观察
共90只SD雄性大鼠,6只为正常对照组,腹腔注射匹罗卡品后,与对照组相比,大鼠出现明显的行为学异常,包括口部运动、点头运动、湿狗样抖动,采用BBG干预后,大鼠慢性自发性发作频率有所减少、癫痫样发作程度减弱,本实验未进行具体发作次数统计。
2.3 Western blot检测
Western blot结果示,慢性自发性癫痫发作组P2X2受体蛋白表达较正常对照组明显增多(P<0.05),BBG干预后,P2X2受体表达减低,且与BBG剂量呈负相关,见图2。
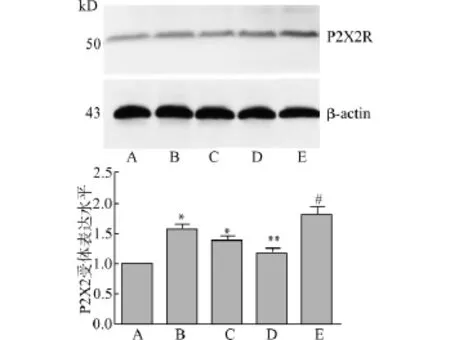
图2 Western blot检测大鼠海马组织中P2X2受体表达Fig.2 Detection of P2X2 receptor expression in rat hippocampus by Western blotting
2.4 Real-time PCR检测
PCR结果显示在慢性自发性发作组中,P2X2基因表达量明显高于对照组(P<0.05),而BBG干预组中,P2X2基因表达量降低,且与BBG剂量呈负相关,见图3。
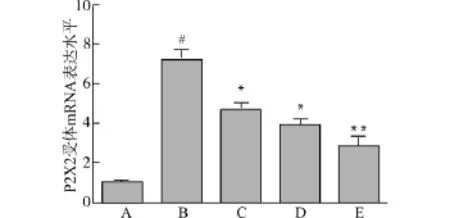
图3 RT-PCR检测大鼠海马组织中P2X2受体mRNA表达Fig.3 Detection of P2X2 receptor mRNA in rat hippocampus by RT-PCR
2.5 免疫组化染色
大鼠海马组织谷氨酸免疫组化染色显示:慢性自发性发作组海马组织CA1、CA3区谷氨酸水平明显高于对照组(P<0.05),在BBG干预组中,该部位的谷氨酸水平则显著下降,且与BBG的剂量呈负相关,见图4。
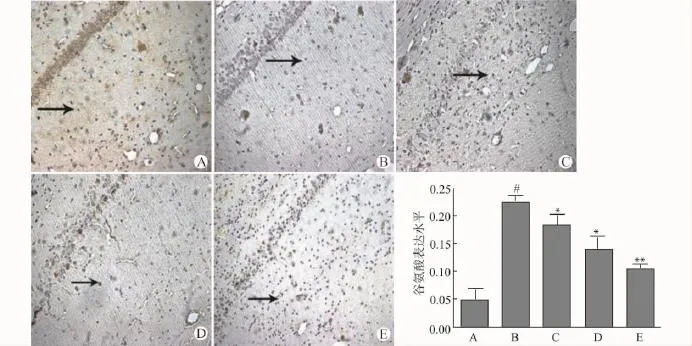
图4 免疫组化检测海马组织CA1、CA3区域谷氨酸表达(×200)Fig.4 Immunohistochemical staining for GLU in CA1 and CA3 regions in rat hippocampus(×200)
3 讨论
癫痫是一种由神经元异常放电所引起的以反复痫性发作为特征的疾病,颞叶癫痫则是临床上最常见的难治性癫痫[9]。在众多的癫痫造模中,因腹腔注射氯化锂-匹罗卡品能从症状及病理改变上高度模拟人颞叶癫痫,如,出现慢性自发性发作、海马区神经元丢失和星形胶质细胞聚集等[10],兼之具有简单可行、对动物所造成的痛苦较小等优势而被广泛应用于实验研究。颞叶癫痫的发生与脑组织形态、功能异常密不可分,发病机制涉及海马硬化、苔藓纤维出芽、皮质发育畸变、胶质细胞过度增生、神经元微环境紊乱[1113]等。目前研究认为,匹罗卡品致痫机制主要有二:离子通道障碍致使神经元持续去极化[14]和兴奋性谷氨酸通路异常[15]。谷氨酸是中枢神经系统内最重要的一种兴奋性神经递质,谷氨酸的释放呈现显著钙离子依赖性,其与抑制性神经递质γ-氨基丁酸的平衡在维持脑微环境中起着重要作用,细胞外谷氨酸的过度蓄积不仅可导致神经元兴奋性增高,进而出现神经元异常放电[16],而且谷氨酸与突触后膜上的谷氨酸受体结合后则能够激活Na+、Ca2+进一步内流,最终导致钙超载而引发神经元死亡[17]。因此,谷氨酸的表达变化也一直是癫痫研究领域的热点,如何减低癫痫患者脑内谷氨酸的含量或是谷氨酸受体的敏感性,进而保护神经元,对癫痫治疗药物的研究有着重要的指导意义。
ATP是一种重要的细胞能源物质,参与调节机体多种生物学功能。P2X受体属于配体离子门控通道,在外周及中枢神经系统内广泛分布,ATP作为一种兴奋性神经递质,能通过与P2X受体结合发挥多种调节功能[18]。但病理条件下,如发生脑缺氧、脑缺血、脑外伤或癫痫发作[1920]时,内源性ATP释放致使细胞外液ATP浓度急剧升高,激活P2X受体后引起细胞膜上阳离子通道(K+、Na+、Ca2+)开放、胞膜通透性增加,阳离子大量内流,产生内向跨膜电流,使细胞去极化,参与神经信号的产生及传导、突触可塑性调节、神经递质分泌[21]等,而这些电生理及神经递质分泌的异常等与癫痫的发病密切相关。已有研究报道,P2X受体的不同亚型在癫痫发作中均有变化,这提示其可能通过多种机制参与了癫痫的发病、进展,如P2X7受体在匹罗卡品致癫痫大鼠神经元及神经胶质细胞中表达增高[2223],而应用抗P2X7受体抗体则有抗癫痫发作的作用,尽管在细胞实验中,并没有直接检测到抗P2X7受体抗体能够影响痫样放电,但发现抗P2X1及抗P2X3受体抗体均可影响癫痫放电[24]。P2X受体拮抗剂则被证实有一定的神经保护作用,有的还有延缓神经衰老疾病的功能[2526],苏拉明是一种常用的P2X受体拮抗剂,可渗透血脑屏障,减轻脑缺血所致的损伤,产生神经保护作用[27]。由此得知,P2X拮抗剂在抗癫痫药物研究领域的应用前景广阔。
P2X2受体在神经元上的表达丰富,大脑皮质、海马组织、僵核、尾状核及黑质致密部等均可检测到P2X2受体的表达[28],提示其在维持神经功能方面有重要作用。在该研究中,我们采用腹腔注射匹罗卡品建立慢性自发性癫痫模型,检测发现癫痫鼠海马区域P2X2受体、谷氨酸的表达明显增高,使用P2X2受体阻断剂BBG后,P2X2受体表达明显减低,癫痫大鼠的癫痫发作频率及程度均有所减轻,同时,免疫组化染色提示,谷氨酸的含量有所减低,且与BBG浓度呈显著负相关。由此我们得出,P2X2受体参与了颞叶癫痫的发病过程,且其拮抗剂有一定的抗癫痫作用,其中机制可能与阻断P2X2后,细胞内外离子流发生变化有关,并最终使得突触间隙兴奋性神经递质谷氨酸的释放减少,但具体P2X2通过何种机制影响谷氨酸的释放而参与癫痫发病,及其是否能对神经元发挥直接保护作用仍需进一步研究。
[1] Elger C E,Schmidt D.Modern management of epilepsy:a practical approach[J].Epilepsy Behav,2008,12(4):501-539.
[2] Kang T C,An S J,Park S K,et al.P2X2 and P2X4 receptor expression is regulated by a GABAA receptor-mediated mechanism in the gerbil hippocampus[J].Mol Brain Res,2003,116(1/2):168-175.
[3] Klaft Z J,Schulz S B,Maslarova A,et al.Extracellular ATP differentially affects epileptiform activity via purinergic P2X7 and adenosine A1 receptors in naive and chronic epileptic rats[J].Epilepsia,2012,53(11):1978-1986.
[4] Ulmann L,Levavasseur F,Avignone E,et al.Involvement of P2X4 receptors in hippocampal microglial activation after status epilepticus[J].Glia,2013,61(8):1306-1319.
[5] Magni G,Merli D,Verderio C,et al.P2Y receptor antagonists as anti-allodynic agents in acute and sub-chronic trigeminal sensitization:Role of satellite glial cells[J].Glia,2015,63(7):1256-1269.
[6] Erakovic V,Zupan G,Varljen J,et al.Lithium plus pilocarpine induced status epilepticus--biochemical changes[J].Neurosci Res,2000,36(2):157-166.
[7] Pfaffl M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Res,2001,29(9):e45.
[8] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-delta delta C(T))method[J].Methods,2001,25(4):402-408.
[9] Lewis D V.Losing neurons:selective vulnerability and mesial temporal sclerosis[J].Epilepsia,2005,46(Suppl.7):39-44.
[10] Curia G,Longo D,Biagini G,et al.The pilocarpine model of temporal lobe epilepsy[J].J Neurosci Methods,2008,172(2):143-157.
[11] Kandratavicius L,Ruggiero R N,Hallak J E,et al.Pathophysiology of mood disorders in temporal lobe epilepsy[J].Rev Bras Psiquiatr,2012,34(Suppl.2):S233-S245.
[12] Braakman H M,Vaessen M J,Jansen J F,et al.Frontal lobe connectivity and cognitive impairment in pediatric frontal lobe epilepsy[J].Epilepsia,2013,54(3):446-454.
[13] van der Hel W S,van Eijsden P,Bos I W,et al.In vivo MRS and histochemistry of status epilepticus-induced hippocampal pathology in a juvenile model of temporal lobe epilepsy[J].NMR Biomed,2013,26(2):132-140.
[14] Clifford D B,Olney J W,Maniotis A,et al.The functional anatomy and pathology of lithium-pilocarpine and high-dose pilocarpine seizures[J].Neuroscience,1987,23(3):953-968.
[15] Ormandy G C,Jope R S,Snead O C 3rd.Anticonvulsant actions of MK-801 on the lithium-pilocarpine model of status epilepticus in rats[J].Exp Neurol,1989,106(2):172-180.
[16] Chapman A G.Glutamate and epilepsy[J].J Nutr,2000,130(4):1043-1045.
[17] Swamy A H,Patel N L,Gadad P C,et al.Neuroprotective activity of pongamia pinnata in monosodium glutamate-induced neurotoxicity in rats[J].Indian J Pharm Sci,2013,75(6): 657-663.
[18] Jindrichova M,Zemkova H.Purinergic P2X family and specific features of the P2X7 subtype[J].Cesk Fysiol,2013,62(2):40-46.
[19] Saul A,Hausmann R,Kless A,et al.Heteromeric assembly of P2X subunits[J].Front Cell Neurosci,2013,250(7):1-20.
[20] Huang P,Zou Y,Zhong X Z,et al.P2X4 forms functional ATP-activated cation channels on lysosomal membranes regulated by luminal p H[J].J Biol Chem,2014,289(25):17658-17667.
[21] Booth J W,Tam F W,Unwin R J.P2 purinoceptors:Renal pathophysiology and therapeutic potential[J].Clin Nephrol,2012,78(2):154-163.
[22] Dona F,Ulrich H,Persike D S,et al.Alteration of purinergic P2X4 and P2X7 receptor expression in rats with temporallobe epilepsy induced by pilocarpine[J].Epilepsy Res,2009,83(2/3):157-167.
[23] Choi H K,Ryu H J,Kim J E,et al.The roles of P2X7 receptor in regional-specific microglial responses in the rat brain following status epilepticus[J].Neurol Sci,2012,33(3):515-525.
[24] Waszkielewicz A M,Gunia A,Szkaradek N,et al.Ion channels as drug targets in central nervous system disorders[J].Curr Med Chem,2013,20(10):1241-1285.
[25] Helms N,Kowalski M,Illes P,et al.Agonist antagonist interactions at the rapidly desensitizing P2X3 receptor[J].PLoS One,2013,8(11):e79213.
[26] Hochhauser E,Cohen R,Waldman M,et al.P2Y2 receptor agonist with enhanced stability protects the heart from ischemic damage in vitro and in vivo[J].Purinergic Signal,2013,9(4):633-642.
[27] Kharlamov A,Jones S C,Kim D K.Suramin reduces infarct volume in a model of focal brain ischemia in rats[J].Exp Brain Res,2002,147(3):353-359.
[28] Mizuno M S,Crisma A R,Borelli P,et al.Distribution of the P2X2 receptor and chemical coding in ileal enteric neurons of obese male mice(ob/ob)[J].World J Gastroenterol,2014,20(38):13911-13919.
(2015-03-22 收稿)
Increased Expression of P2X2 Receptor in Hippocampus of Rats with Pilocarpine-induced Spontaneous Recurrent Seizure
Liu Yan1,Song Penghui2,Li Gangqin1et al
1Department of Neurology,The Eighth Hospital of Wuhan,Wuhan 430010,China
2Department of Neurology,Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430022,China
Objective To investigate expression of P2X2 receptor in lithium-pilocarpine-treated rats and the possible role it played in temporal lobe epileptis(TLE).Methods TLE rat model was established by lithium-pilocarpine intraperitoneal injection.Then,brilliant blue G(BBG),a specific P2X2 receptor antagonist was injected intraperitoneally to the TLE rats.The expression of P2X2 receptor and P2X2 receptor mRNA in hippocampus was detected by Western blotting and RT-qPCR respectively,while the level of glutamate(GLU)in hippocampus was assessed by immunohistochemistry.Results The expression of P2X2 receptor in spontaneous recurrent seizure group was significantly increased(P<0.05),while the expression of P2X2 receptor in the rats treated with BBG was significantly decreased(P<0.05),concomitantly,a parallel result was investigated in the expression of P2X2 receptor mRNA(P<0.05).Furthermore,GLU was also significantly reduced in the BBG group as compared with spontaneous recurrent seizure group(P<0.05),and it was negatively correlated with the dose of BBG.Conclusion P2X2 receptor may play a critical role in the development of TLE,and could be a potential therapeutic target for the treatment of TLE.
temporal lobe epileptic; P2X2 receptor; brilliant blue G; glutamate
R742.1
10.3870/j.issn.1672-0741.2015.04.006
*武汉市卫计委临床医学科研项目(No.WX14A09)
刘 艳,女,1971年生,主任医师,E-mail:miss8670@126.com
△通讯作者,Corresponding author,E-mail:dengxuejun1965@126.com
