重组腺病毒Ad-PTEN-EGFP抗肿瘤的实验研究*
2015-06-24陈志雄马红梅
陈志雄, 黄 琼, 陶 琳, 马红梅
武汉大学人民医院1老年病科2眼科,武汉 430060
重组腺病毒Ad-PTEN-EGFP抗肿瘤的实验研究*
陈志雄1, 黄 琼2, 陶 琳1, 马红梅1
武汉大学人民医院1老年病科2眼科,武汉 430060
目的 探讨Ad-PTEN-EGFP对裸鼠肺癌种植瘤的体内杀伤作用及机制。方法 构建裸鼠肺癌种植瘤模型,将Ad-PTEN-EGFP注射裸鼠体内,观察肿瘤体积变化,进行肿瘤组织的常规病理检查、原位凋亡染色及免疫组化染色,检查治疗后各组裸鼠肿瘤组织中有关基因的表达情况。结果 与对照组相比,治疗组肿瘤组织生长速度明显减慢,肿瘤组织体积较对照组明显缩小(P<0.05),且随腺病毒治疗剂量的升高而更为明显;原位凋亡染色法检测肿瘤组织,发现治疗组凋亡细胞明显增多(P<0.05),且随腺病毒治疗剂量的升高而更为明显(P<0.05)。此外还发现,治疗后肿瘤组织或血清中的Survivin、NF-κB和PI3K表达水平明显下降(均P<0.05),呈负相关性,且随腺病毒治疗剂量的升高而更为明显(P<0.05)。结论 Ad-PTEN-EGFP能明显抑制肿瘤组织的生长,其作用机制与促进肿瘤细胞凋亡,调节相关基因表达水平有一定联系。
肺癌; 基因治疗; PTEN基因; 腺病毒
PTEN基因是一种重要的肿瘤抑制基因,以前又被研究人员称为MMAC1/TEP1,经过多年研究发现,该基因位于染色体10q23处。在这个基因组区域中,杂合性缺失现象常常出现在许多肿瘤中[1]。在患有常染色体显性相关疾病的患者中,如Castleman病(CD)、Lhermitte-Duclos病(LDD)等,目前已经在80%以上这类疾病患者基因组中检测到了PTEN基因突变的现象[2]。研究人员发现,在PTEN基因已经突变的杂合型小鼠中,高度不典型增生这种特殊的现象常常出现,而出现这种特殊现象的小鼠中,不同组织起源肿瘤的发生频率也比较高。上述研究结果证实:在肿瘤抑制过程中,PTEN基因起着重要的作用[35]。通过前期实验,我们成功构建了含PTEN抑癌基因的重组腺病毒Ad-PTEN-EGFP,并通过体外实验,将重组腺病毒Ad-PTEN-EGFP转染肺癌A549细胞。因此,本实验拟构建动物模型,从体内方面探讨重组腺病毒Ad-PTEN-EGFP治疗肺癌的机制,为进一步将PTEN基因应用于临床实验奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 细胞株 人肺腺癌细胞株A549,购自武汉大学医学院肿瘤研究所。
1.1.2 重组腺病毒 本课题组前期制备及保存的Ad-PTEN-EGFP[6];Ad-EGFP由本实验室保存。
1.2 试剂
RPMI1640和小牛血清为Gibco公司产品;TUNEL试剂盒购自武汉博士德生物技术公司;抗Survivin、NF-κB、PI3 K和PTEN抗体购自深圳中杉生物公司,Caspase-3、Caspase-9、TGF-β1和PTEN ELISA检测试剂盒均购自深圳晶美公司。
1.3 实验动物
Balb/c裸鼠20只,雄性,4周龄,体重15~20 g,购自众磊(北京)生物科技发展有限公司,饲养于同济医学院实验动物学部(SPF级),饲养6~7 d后开始实验。
1.4 实验方法
1.4.1 细胞培养 人肺腺癌A549细胞为武汉大学医学院肿瘤研究所保存细胞。在5%CO2,37℃条件下的细胞培养箱内培养,培养液为含10%小牛血清的RPMI1640。
1.4.2 肺癌皮下种植瘤裸鼠动物模型的制作 将A549细胞培养至对数生长期,用0.25%胰酶、EDTA消化贴壁的细胞,离心收集细胞,用1%的PBS洗涤3次,用PBS将细胞密度调整为2×107细胞/m L。在裸鼠右侧近腋下腹部皮下注射100μL的细胞溶液(2×106个细胞)。观察和检测种植瘤的生长速度,如果有肿块出现,则癌细胞种植成功。
1.4.3 动物分组及治疗方法 根据肿瘤体积及瘤重各组匹配的原则,将20只裸鼠分为4组,使各组之间无明显差异性(P>0.05)。重组腺病毒Ad-PTEN-EGFP高剂量治疗组(5只):瘤体内注射重组腺病毒Ad-PTEN-EGFP病毒纯化液,隔日1次,连续皮下注射5次,注射量为1×109pfu/50μL。重组腺病毒Ad-PTEN-EGFP低剂量治疗组(5只):瘤体内注射重组腺病毒Ad-PTEN-EGFP病毒纯化液,隔日1次,连续皮下注射5次,注射量为5×108pfu/50μL。Ad-EGFP组(5只):瘤体内注射腺病毒Ad-LacZ病毒纯化液,隔日1次,连续皮下注射5次,注射量为5×108pfu/50μL。PBS组(5只):瘤体内注射PBS,隔日1次,连续皮下注射5次,注射量为50μL。
1.4.4 疗效观察 分别在治疗第0,2,4,7,9,11,13天,测量各组动物肿瘤组织的最大径和最小径,计算肿瘤体积:肿瘤体积(mm3)=πab2/6(a:最大径,b:最小径)。重组腺病毒Ad-PTEN-EGFP注射治疗结束后,比较治疗组与对照组肿瘤的体积及重量,并行病理学检查。
1.4.5 组织标本取材 在重组腺病毒治疗结束后的第3天处死裸鼠,取血留血清,—70℃冰箱贮存,无菌条件下取出肿瘤,用浓度为4%的多聚甲醛溶液将肿瘤组织固定,并进行石蜡切片及苏木精-伊红(HE)染色和免疫组化染色,观察免疫组化结果和检测各项指标。
1.5 病理检查
1.5.1 原位凋亡染色(TUNEL) 实验方法按试剂盒说明书操作,在显微镜下观察切片染色情况,随机选取每张切片中5个高倍视野观察并计数100个细胞及阳性细胞,计数阳性细胞占总细胞数的百分比。
1.5.2 免疫组化染色检测Survivin、NF-κB、PI3K的表达 主要步骤如下:①组织切片按乙醇浓度梯度常规脱蜡至水。②用新鲜蒸馏水与双氧水配制成3%H2O2,室温条件下放置10 min,用来灭活组织中的内源性酶,然后用蒸馏水清洗3次。③热修复抗原,将组织切片浸泡到0.02 mol/L浓度的PBS中(p H 7.2),电炉加热至沸腾后断电,间隔时间为10 min,冷却后用0.1 mol/L浓度的PBS洗涤2次。④用正常山羊血清封闭液封闭组织切片,室温条件下放置30 min,去除残留的多余液体。⑤将适当稀释的一抗(1∶150)滴加在切片上,要覆盖住整个切片,4℃条件下过夜孵育,0.1 mol/L浓度的PBS清洗3次,2 min/次。⑥将生物素化二抗滴加在切片上,覆盖住整个切片,37℃条件下孵育30 min,0.1 mol/L浓度的PBS清洗3次,3 min/次。⑦滴加几滴SABC试剂,37℃条件下孵育30 min,0.1 mol/L浓度的PBS清洗4次,5 min/次。⑧DAB显色,在室温条件下和显微镜观察的条件下控制DAB显色的时间,出现阳性反应可用蒸馏水洗涤以终止DAB显色反应。⑨用苏木精复染。⑩封片。
每次实验中均设空白对照(磷酸盐缓冲液)和阴性对照(正常兔血清取代一抗)。定量分析采用HPIAS-1000型高清晰度彩色病理图文报告分析系统,在普通显微镜下,计算整个肿瘤组织中,阳性面积占总面积的百分比(%),每张切片均随机选取5个视野,求平均值。
1.6 统计学处理
采用SPSS 13.0统计分析软件进行处理,计量资料组间均数比较采用t检验,计数资料组间比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 构建人肺腺癌动物模型
注射肺癌细胞1周左右可见裸鼠皮下注射部位出现结节状组织,随时间延长,该组织可继续生长,有时还可见有增大的肿瘤瘤体破溃和出血。
2.2 重组腺病毒Ad-PTEN-EGFP肿瘤内注射对肺癌裸鼠皮下种植瘤的抑瘤效果
皮下接种Balb/c裸鼠肺腺癌A549细胞,大概7 d后,肉眼可发现有明显的皮下肿瘤形成。经重组腺病毒Ad-PTEN-EGFP注射后,裸鼠的肿瘤组织体积增长速度明显减慢,而其他两个对照组裸鼠肿瘤组织生长仍然较快。1周后我们可以发现Ad-PTEN-EGFP治疗组的肿瘤组织较其他对照组均明显缩小(P<0.01),且第11天时高剂量治疗组与低剂量治疗组比较,肿瘤体积也明显缩小(P<0.05),Ad-EGFP组肿瘤体积增长较PBS组稍缓,但差异无统计学意义(P>0.05)。见表1。
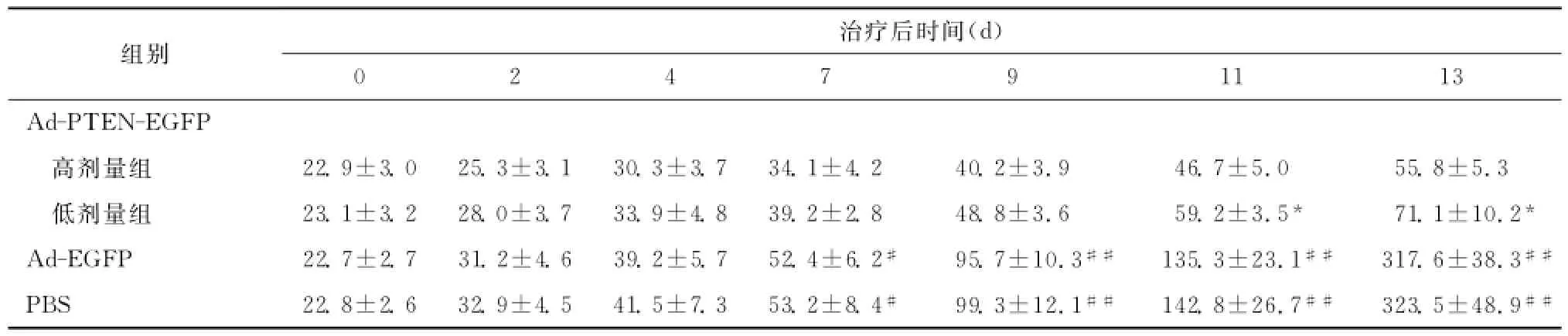
表1 各组肿瘤体积变化情况及比较(¯x±s,mm3)Table 1 Comparison of tumor volume in different groups and different time points(¯x±s,mm3)
重组腺病毒Ad-PTEN-EGFP治疗结束后,将各组裸鼠种植瘤称重,Ad-PTEN-EGFP高剂量治疗组为(0.38±0.10)g;Ad-PTEN-EGFP低剂量治疗组为(0.63±0.16)g;Ad-EGFP组为(1.48± 0.32)g;PBS组为(1.54±0.37)g。高剂量和低剂量Ad-PTEN-EGFP治疗组肿瘤重量明显较其余两组小(均P<0.01),且高剂量治疗组与低剂量治疗组比较,肿瘤重量也明显减少(P<0.05)。
2.3 各组肿瘤组织苏木精-伊红染色
在Ad-EGFP组和PBS组中,苏木精-伊红染色可见裸鼠肿瘤细胞核大,核仁清楚,不规则的分裂象,纤维间隔可在肿瘤组织内发现;而高剂量和低剂量治疗组中,大量的肿瘤组织坏死可在肿瘤组织中发现,纤维组织代替坏死的肿瘤细胞。见图1。

图1 各组肿瘤组织病理切片图(苏木精-伊红染色,×400)Fig.1 Pathological section of tumor tissues(HE Staining,×400)
2.4 重组腺病毒Ad-PTEN-EGFP治疗对肿瘤细胞凋亡的影响
经TUNEL染色检测发现,重组腺病毒Ad-PTEN-EGFP高剂量治疗组凋亡率为(31.4± 4.5)%,Ad-PTEN-EGFP低剂量治疗组凋亡率为(20.8±4.2)%,两个治疗组均明显高于PBS组(4.4±1.7)%、Ad-EGFP组(5.8±1.8)%(P<0.01),且高剂量治疗组与低剂量组比较,凋亡率也明显增高(P<0.05)。见图2。

图2 各组裸鼠肿瘤TUNEL法检测凋亡(×400)Fig.2 Detection of apoptosis of tumor cells in nude mice by TUNEL method(×400)
2.5 PTEN对裸鼠肿瘤组织中Survivin、NF-κB、PI3K表达的影响
检测PTEN基因表达是否影响Survivin、NF-κB、PI3K在肿瘤组织中的表达,以及对上述指标的表达是否具有相关性。结果发现,高剂量和低剂量治疗组PTEN基因表达明显升高(均P<0.01),肿瘤组织中Survivin、NF-κB、PI3 K表达明显下降(均P<0.01),且高剂量治疗组各指标均明显低于低剂量治疗组(均P<0.05)。结果发现,PTEN与Survivin、NF-κB、PI3K表达呈负相关性(均P<0.05),见表2,图3~6。

表2 重组腺病毒Ad-PTEN-EGFP对裸鼠肿瘤组织Survivin、NF-κB、PI3K表达的影响(%,¯x±s)Table 2 The influence of recombinant adenovirus Ad-PTEN-EGFP on expression of Survivin,NF-κB and PI3K in tumor tissues of nude mice(%,¯x±s)

图3 各组裸鼠肿瘤SP法检测PTEN(SP,×400)Fig.3 Detection of PTEN in tumor tissues of nude mice by SP method(SP staining,×400)
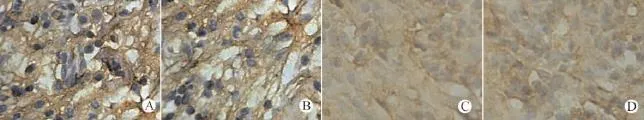
图4 各组裸鼠肿瘤SP法检测Survivin(SP,×400)Fig.4 Detection of survivin in tumor tissues of nude mice by SP method(SP staining,×400)
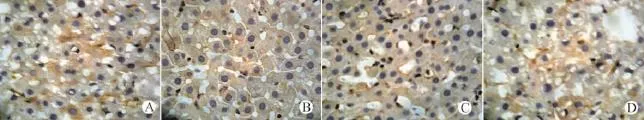
图5 各组裸鼠肿瘤SP法检测NF-κB(SP,×400)Fig.5 Detection of NF-κB in tumor tissues of nude mice by SP method(SP staining,×400)
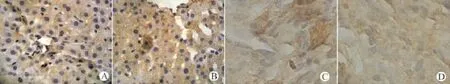
图6 各组裸鼠肿瘤SP法检测PI3K(SP,×400)Fig.6 Detection of PI3K in tumor tissues of nude mice by SP method(SP staining,×400)
3 讨论
肺癌是威胁人类健康的主要恶性肿瘤之一,在世界范围内肺癌死亡率呈上升趋势。如何建立可靠而且稳定的肺腺癌动物模型,这是进行体内试验及开展新疗法的基础。通过参考以往的国内外研究,本实验采用A549肺腺癌细胞注射裸鼠建立肺腺癌动物模型。
在过去十年中,人们已经研究了大量的有关细胞凋亡作用机制,及其在肿瘤发生中的作用。通过对细胞凋亡的作用机制,肿瘤细胞逃避细胞凋亡现象,以及肿瘤细胞抗药性机制的大量研究,促进了肿瘤靶向治疗的深入发展。通过TUNEL染色,本研究证实:与其它两组比较,含PTEN基因的重组腺病毒治疗组中,肿瘤组织的凋亡细胞呈明显增加(P<0.01);且与低剂量组比较,高剂量组肿瘤组织的凋亡细胞也明显增加(P<0.05)。
Survivin是目前科研人员能够克隆出的分子量最小的IAP家族成员,与凋亡抑制因子Bcl-2蛋白的组织结构不同,它仅仅由1个阻断细胞凋亡的分子组成,但是它抑制细胞凋亡的生理作用却大大超过Bcl-2家族的作用[79]。Survivin抗凋亡作用已被大量的研究结果所证实,它不仅通过阻断线粒体细胞色素C在体内的释放,还与下游凋亡效应因子Caspase-3和Caspase-7相结合,进而对其活性产生直接的抑制作用,而且它还能通过与纺锤体纤维之间的相互结合,起到间接抑制Caspase对纺锤体的水解作用,这样就有利于保护有丝分裂细胞器的完整性,从而抑制细胞发生凋亡现象[1012]。PTEN则是一种重要的抑癌基因,可通过PI3K/Akt途径将Survivin的表达水平上调而导致它的失活,使它能够发挥抑制肿瘤组织生长和血管内皮细胞发生凋亡的作用,促进肿瘤细胞大量增殖,血管快速生长和保持稳定状态,这样更有利于肿瘤组织的生长和侵袭作用。PTEN基因的失活和Survivin基因的过表达都是肺癌发生发展和发生远处转移的关键之处,与肺癌的不良生物学行为和不良预后有着密切的联系。本研究中,Survivin与PTEN表达呈显著负相关(P<0.05),此结果表明Survivin和PTEN在肺癌的发生、发展中均起着重要的作用。
核转录因子NF-κB是科研人员在浆细胞和成熟B细胞中发现的一种蛋白,这种蛋白能与免疫球蛋白κ轻链内含有增强子的特异性序列相结合,所以被人们命名为κB[13]。它在真核生物中广泛存在,属于一个多肽亚单位组成的蛋白家族,目前相关研究结果认为,它与机体免疫过程,肿瘤组织的发生发展,细胞发生凋亡现象以及人类的胚胎发育等大多数事件有着十分密切的联系。本研究采用免疫组织化学方法,发现肿瘤组织细胞质与胞核中NF-κB的蛋白表达均为阳性,此结果与国内外报道一致[1416],其原因可能是细胞受到各种因素的刺激作用,诱导了NF-κB在细胞内的活化,NF-κB进入细胞核以后,与细胞核内特定的DNA片段相互结合。本实验研究结果显示,NF-κB与PTEN之间呈负相关关系,提示二者可能在肺癌的发生发展中有一定的作用。
PI3K则是许多人类生命活动中关键的信号分子,PI3K介导的信号转导通路调节了细胞的分裂、分化、凋亡等各种生理活动。PI3K是一种胞内磷脂酰激酶,被刺激活化以后,可产生位于细胞质膜上的第二信使PI3,PI3与Akt相互结合以后可以促进其发生激活,从而引起肿瘤细胞的大量增生[1718]。另外,Bertram等[19]研究也证实,PI3 K还可能通过抑制Fas的凋亡过程而抵抗细胞的凋亡过程。人体大部分肿瘤组织内都缺乏PTEN基因的表达。而PTEN可以使PI3K的脂类产物PI-3,4-P2、PI-3,4,5-P3的3位脱磷酸下调,通过PI3 K-PKB通路而对细胞生长与存活现象进行控制[2021]。在本研究中PI3K和PTEN呈负相关关系,此结果提示PTEN基因表达的缺失促进了PI3 K的过表达,从而引起PI3K活性的释放,进而激活了下游的Akt,最终刺激细胞的生长发育和生存信号在体内的传递过程。Lee[22]研究认为对PI3K途径进行有效阻碍可以特异性地抑制NSCLC细胞的大量增殖。
往肿瘤内注射重组腺病毒Ad-PTEN-EGFP,可以使裸鼠皮下移植瘤的生长速度(体积、重量)明显减慢,本研究发现,PTEN基因表达上升可以使肿瘤组织或血清的Survivin、NF-κB、PI3K表达明显下调(均P<0.01),呈负相关性(均P<0.05),提示本实验构建的含PTEN基因的重组腺病毒Ad-PTEN-EGFP对肺癌具有潜在的治疗价值,为进一步的研究和应用奠定了良好的基础。
[1] Davis N M,Sokolosky M,Stadelman K,et al.Deregulation of the EGFR/PI3K/PTEN/Akt/m TORC1 pathway in breast cancer:possibilities for therapeutic intervention[J].Oncotarget,2014,5(13):4603-4650.
[2] Gray I C,Stewart L M,Phillips S M,et al.Mutation and expression analysis of the putative prostate tumor suppressor gene PTEN[J].Br J Cancer,1998,78(10):1296-1300.
[3] Xu W T,Yang Z,Lu N H.et al.Roles of PTEN(phosphatase and tensin homolog)in gastric cancer development and pro-gression[J].Asian Pac J Cancer Prev,2014,15(1):17-24.
[4] Molinari F,Frattini M.Functions and regulation of the PTEN gene in colorectal cancer[J].Front Oncol,2014,16(3):326-329.
[5] Hopkins B D,Hodakoski C,Barrows D,et al.PTEN function: the long and the short of it[J].Trends Biochem Sci,2014,39(4):183-190.
[6] Chen Z,Yang J.Growth suppression of human lung cancer cells and implanted tumors by adenovirus-mediated transfer of the PTEN gene[J].J Huazhong Univ Sci Technolog[Med Sci],2010,30(2):149-154.
[7] Athanasoula K C,Gogas H,Polonifi K,et al.Survivin beyond physiology:orchestration of multistep carcinogenesis and therapeutic potentials[J].Cancer Lett,2014,347(2):175-182.
[8] Nevala H,Karenko L,Vakeva L,et al.Proapoptotic and antiapoptotic markers in cutaneous T-cell lymphoma skin infiltrates and lymphomatoid papulosis[J].Br J Dermatol,2001,145(6):928-937.
[9] Mobahat M,Narendran A,Riabowol K,et al.Survivin as a preferential target for cancer therapy[J].Int J Mol Sci,2014,15(2):2494-2516.
[10] Guindalini C,Santa R,Machado M,et al.Monitoring survivin expression in cancer:implications for prognosis and therapy[J].Mol Diagn Ther,2013,17(6):331-342.
[11] La Casse E C,Baird S,Korneluk R G,et al.The inhibitors of apoptosis(IAPs)and their emerging role in cancer[J].Oncogene,1998,17(25):3247-3259.
[12] Samarasinghe R M,Gibbons J,Kanwar R K,et al.Nanotechnology based platforms for survivin targeted drug discovery[J].Expert Opin Drug Discov,2012,7(11):1083-1092.
[13] Urbano P C,Soccol V T,Azevedo V F,et al.Apoptosis and the FLIP and NF-kappa B proteins as pharmacodynamic criteria for biosimilar TNF-alpha antagonists[J].Biologics,2014,31(8):211-220.
[14] Huang S,Pettaway C A,Uehara H,et al.Blockade of NF-kappaB activity in human prostate cancer cells is associated with suppression of angiogenesis,invasion,and metastasis[J].Oncogene,2001,20(31):184-188.
[15] Pateras I,Giaginis C,Tsigris C,et al.NF-κB signaling at the crossroads of inflammation and atherogenesis:searching for new therapeutic links[J].Expert Opin Ther Targets,2014,18(9):1089-1101.
[16] Tokunaga F.Linear ubiquitination-mediated NF-κB regulation and its related diseases[J].Seikagaku,2013,85(6):414-422.
[17] Matsuoka T,Yashiro M.The Role of PI3K/Akt/m TOR signaling in gastric carcinoma[J].Cancers(Basel),2014,6(3): 1441-1463.
[18] 尹盟盟,崔玉荣,王璐,等.PI3K/Akt信号通路调控胚胎干细胞的自我更新和多向分化潜能的研究进展[J].生理学报,2014,66(2):223-230.
[19] Bertram J,Peacock J W,Tan C,et al.Inhibition of the phosphatidylinositol 3’-kinase pathway promotes autocrine Fas-induced death of phosphatase and tension homologue-deficient prostate cancer cells[J].Cancer Res,2006,66(9):4781-4788.
[20] Massacesi C,di Tomaso E,Fretault N,et al.Challenges in the clinical development of PI3K inhibitors[J].Ann N Y Acad Sci,2013,1280(12):19-23.
[21] 曾凡杞,廖明,张志云,等.腺病毒介导的SOCS1对模拟银屑病小鼠模型的影响[J].华中科技大学学报:医学版,2014,43(2):223-226,253.
[22] Lee H Y.Molecular mechanisms of deguelin-induced apoptosis in transformed human bronchial epithelial cells[J].Biochem Pharmacol,2004,68(6):1119-1124.
(2014-09-23 收稿)
Anti-tumor Effect of Recombinant Adenovirus Ad-PTEN-EGFP
Chen Zhixiong1,Huang Qiong2,Tao Lin1et al
1Department of Geriatrics,2Department of Ophthalmology,Renmin Hospital of Wuhan University,Wuhan 430060,China
Objective To determine the efficacy and mechanism of Ad-PTEN-EGFP as therapeutic protocol for lung cancer in vivo in nude mice.Methods The model of lung implantation tumor in nude mice was established.The tumor volume changes were observed after Ad-PTEN-EGFP was injected to the nude mice,then the routine pathological examination,situ apoptosis staining and immunohistochemical staining of tumor tissue were performed.The levels of genes in tumor tissues of nude mice were determined after treatment.Results As compared with the control group,the growth rate of tumor and tumor size in treatment group was significantly decreased(P<0.05)in a dose-dependent manner.The apoptotic cells in the treatment group were significantly increased by situ apoptosis staining of tumor tissues(P<0.05)in a dose-dependent manner.In addition,the levels of Survivin,NF-κB and PI3 K were significantly decreased in tumor tissues and serum after treatment(P<0.05)in a dosedependent manner.Conclusion Ad-PTEN-EGFP can significantly inhibit the growth of tumor tissues,which is related with promoting apoptosis of tumor cell gene and regulating relevant gene expression.
lung carcinoma; gene therapy; PTEN gene; adenovirus
R734.2
10.3870/j.issn.1672-0741.2015.04.005
*湖北省自然科学基金资助项目(No.2012FKB04450)
陈志雄,男,1970年生,副主任医师,E-mail:191902185@qq.com
