二硫化碳对大鼠睾丸组织氧化损伤及p53调控细胞凋亡的影响*
2015-06-24黎丽茜陈国元
王 为, 黄 浩, 黎丽茜, 陈 联, 陈国元△
1华中科技大学同济医学院公共卫生学院劳动卫生与环境卫生学系,武汉 4300302华中科技大学同济医学院临床医学专业2009级八年制,武汉 430030
二硫化碳对大鼠睾丸组织氧化损伤及p53调控细胞凋亡的影响*
王 为1, 黄 浩2, 黎丽茜2, 陈 联2, 陈国元1△
1华中科技大学同济医学院公共卫生学院劳动卫生与环境卫生学系,武汉 4300302华中科技大学同济医学院临床医学专业2009级八年制,武汉 430030
目的 探讨二硫化碳(carbon disulfide,CS2)对大鼠睾丸组织氧化损伤及p53调控细胞凋亡的影响及可能的分子机制。方法 清洁级SD雄性大鼠24只,随机分为4组,即空白对照组(Ⅰ)、低浓度组(Ⅱ)、中浓度组(Ⅲ)、高浓度组(Ⅳ),CS2染毒浓度分别为0、50、250和1 250 mg/m3。静式吸入染毒,每周5 d,每天2 h,共10周,空白对照组仅吸入新鲜空气。染毒结束后记录大鼠体重、睾丸脏器系数、精子计数和精子活动率;苏木精-伊红(HE)染色观察其形态学改变;原位末端转移酶标记技术(TUNEL)法检测大鼠睾丸组织细胞凋亡情况;化学比色法测量大鼠睾丸组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)含量;Western blot法检测p53、PARP、Bax和Bcl-2蛋白表达含量。结果 各CS2染毒组的大鼠体重、睾丸脏器系数、精子相对计数及精子活动率均低于空白对照组(均P<0.05);随着CS2染毒浓度的增加,大鼠睾丸组织形态损伤更加明显,中、高浓度组的凋亡指数明显大于空白对照组(均P<0.05),抗氧化酶SOD和GSH-Px活性呈下降趋势而脂质过氧化分解产物MDA则明显上升(P<0.05,P<0.01);Western blot检测结果显示,各CS2染毒组p53蛋白表达含量上升(P<0.01),PARP蛋白仅在高浓度组有明显降低(P<0.05),而Bax与Bcl-2蛋白各自呈上升和下降趋势,中、高浓度组Bax与Bcl-2蛋白含量与空白对照组比较差异有统计学意义(P<0.05,P<0.01)。结论 氧化应激和p53参与了CS2诱导的大鼠睾丸组织细胞凋亡。
二硫化碳; 细胞凋亡; 氧化应激; p53; 生殖毒性
二硫化碳(carbon disulfide,CS2)是常用的有机溶剂和工业原料,主要用于粘胶纤维生产。研究表明,长期接触CS2可造成神经系统、心血管系统以及生殖系统等危害[1]。近年来其对男(雄)性生殖系统的影响也被广泛认知,主要表现为性功能障碍、生殖器萎缩、内分泌激素紊乱及精子生成和活力的降低等[2]。当机体处于氧化应激(oxidative stress)状态时,活性氧(reactive oxygen species,ROS)生成量大于机体清除能力,可导致机体脂质过氧化水平升高,DNA氧化损伤及蛋白质表达异常等,引起细胞损伤并将启动细胞凋亡机制清除过度损伤的细胞[3]。而p53在ROS诱导细胞凋亡过程中发挥重要作用[4]。因此,本实验旨在研究氧化应激与p53蛋白在CS2诱导大鼠睾丸组织细胞凋亡中的作用,为CS2对男(雄)性生殖系统损伤的作用机制提供科学依据。
1 材料与方法
1.1 实验材料
CS2(上海四试赫维化工有限公司),原位末端转移酶标记技术(Td T-mediated d UTP nick-end labeling,TUNEL)细胞凋亡检测试剂盒(Roche公司),超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程研究所),p53、Bcl-2、Bax抗体(Santa Cruz Biotechnology),PARP抗体(Cell Signaling Technology),β-actin抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔/鼠Ig G(武汉谷歌生物科技有限公司),HRP化学发光液(北京天根生化科技有限公司)。有机玻璃染毒柜(同济医学院研制),台式低温离心机(Eppendorf公司),酶联免疫检测仪(Bio-Tek公司),722S可见分光光度计(上海精密科学仪器有限公司),电泳槽和垂直电泳仪(Bio-Rad公司),荧光化学发光凝胶成像系统(Syngene公司)。
1.2 实验方法
1.2.1 动物分组及染毒 清洁级健康SD雄性大鼠24只,4~5周龄,体重(150±10)g,由同济医学院实验动物学部提供,动物使用许可证编号: 4209800122。实验动物经检疫1周后随机分为4组,即空白对照组(Ⅰ)、低浓度组(Ⅱ)、中浓度组(Ⅲ)、高浓度组(Ⅳ),染毒浓度分别为0、50、250和1 250 mg/m3。采用静式吸入染毒,每周5 d,每天2 h,共10周,空白对照组在其他条件相同的情况下吸入空气。每周对各组大鼠体重进行称重并记录,观察实验动物进食、粪便等有无异常情况。
1.2.2 脏器称重及精子计数 染毒结束后称量各组大鼠体重,断颈处死大鼠,剖开腹腔取出睾丸,称量睾丸重量,脏器称重后用4%多聚甲醛固定,剩余新鲜组织置于-80℃冰箱保存。取一侧附睾按照Mahmoud等[56]方法在37℃生理盐水中采用“纵1+横2”方式剪3刀,静置约5 min让精子自由游出,得到精子悬液。取适量混悬液,用0.5%甲醛溶液生理盐水稀释固定后滴于Neubauer型血球计数板上,在200倍的光学显微镜下观察计数1 mm2面积上精子个数,并换算为每100 mg附睾重量精子相对总数,计算精子活动率(精子活动率=活动精子数/精子总数×100%)。
1.2.3 苏木精-伊红(hematoxylin and eosin,HE)染色 常规石蜡切片,脱蜡处理:二甲苯(Ⅰ)5 min,二甲苯(Ⅱ)5 min,无水乙醇5 min,90%乙醇2 min,70%乙醇2 min,蒸馏水2 min。脱蜡后的切片用苏木精染液染色5 min,流水冲洗。1%盐酸乙醇分化30 s,自来水浸泡15 min,伊红染色2 min后脱水、透明及封片。于200倍光学显微镜下观察并拍照。
1.2.4 TUNEL检测 常规石蜡切片脱蜡、水化,蛋白酶K工作液常温下处理20 min,PBS漂洗3次。严格按照TUNEL细胞凋亡检测试剂盒操作方法配制TUNEL反应混合液,加50μL反应混合液滴于切片上,避光37℃湿盒孵育60 min,PBS漂洗3次。HRP抗荧光素抗体37℃湿盒避光孵育30 min,PBS漂洗3次,二氨基联苯胺(diaminobenzidine,DAB)显色5~10 min,PBS漂洗3次,苏木精复染细胞核数秒,流水冲洗,脱水、透明及封片。于200倍光学显微镜下观察并拍照,棕色颗粒为TUNEL阳性即凋亡细胞。
1.2.5 氧化损伤检测 适量睾丸组织置于预冷的生理盐水中机械匀浆,制成10%的组织匀浆液,2 500 r/min离心10 min,取上清液待测。严格按照试剂盒所提供的方法进行操作,采用化学比色法测定SOD、GSH-Px活力和MDA含量。
1.2.6 Western blot检测蛋白含量 适量大鼠睾丸组织置于预冷的Western及IP细胞裂解液中充分研磨匀浆,离心后获取上清,用蛋白定量试剂盒检测总蛋白浓度,并将各组蛋白浓度统一,用Western blot方法检测蛋白表达水平。SDS-PAGE电泳结束后,将蛋白转移至PVDF膜上,室温下5%脱脂牛奶封闭1 h。相应蛋白抗体用5%脱脂牛奶1∶1 000稀释并4℃孵育过夜,TBST洗膜3次,每次5 min。HRP标记的羊抗兔/鼠IgG用5%脱脂牛奶1∶2 000稀释并在常温下孵育1 h,TBST洗膜3次,每次5 min,使用HRP化学发光液检测,置于荧光化学发光凝胶成像系统下曝光显影,并使用该系统自带分析软件Gene Tools计算相对吸光度值。
1.3 统计学分析
计量资料表示为¯x±s,组间均数差异采用SPSS 13.0统计软件对数据进行单因素方差分析(one-way ANOVA),检验水准为α=0.05。
2 结果
2.1 CS2对大鼠体重、睾丸脏器系数及精子计数的影响
由表1可见,随着CS2染毒浓度的增加,各染毒组大鼠体重均出现明显下降(P<0.05);睾丸脏器系数呈下降趋势,中、高浓度组的睾丸脏器系数与空白对照组比较差异有统计学意义(P<0.05);各CS2染毒组的精子相对计数与空白对照组比较,差异均有统计学意义(P<0.05);而精子活动率只在中、高浓度组下降比较明显,与空白对照组比较差异有统计学意义(均P<0.05)。
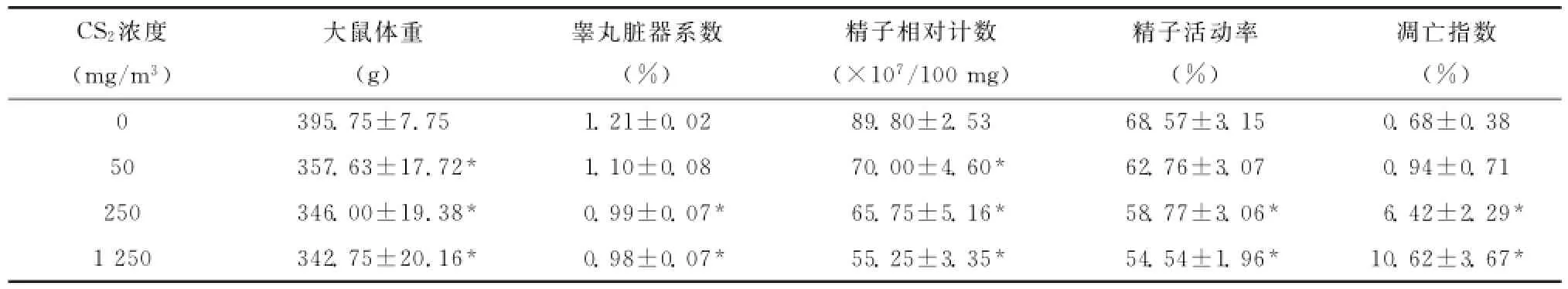
表1 CS2染毒对雄性大鼠体重、睾丸脏器系数、精子活动率及凋亡指数的影响(¯x±s,n=6)Table 1 Effects of CS2on body weight,organ coefficient,sperm motility and apoptotic index in the male rats(¯x±s,n=6)
2.2 CS2对大鼠睾丸组织形态学的影响
图1A可见,空白对照组曲细精管呈圆形或椭圆形,结构完整饱满,支持细胞及各级生精细胞排列规则紧密,管腔内含有大量精子。与空白对照组比较,低浓度组大鼠睾丸组织曲细精管无明显变化,而CS2中、高浓度组发现,睾丸曲细精管萎缩,管腔间隙增宽,间质增生,生精上皮变薄,生精细胞明显减少,各级生精细胞排列紊乱、连接松散,部分管腔可见大量生精细胞脱落。
2.3 CS2对大鼠睾丸组织细胞凋亡的影响
空白对照组及各CS2染毒组均有凋亡发生,空白对照组和低浓度组中只见极少量的凋亡细胞;随CS2染毒浓度增加,中、高浓度组的凋亡细胞数量明显高于空白对照组(图1B)。各CS2染毒组凋亡指数也呈上升趋势,中、高浓度组凋亡指数与空白对照组比较差异有统计学意义(均P<0.05),见表1。
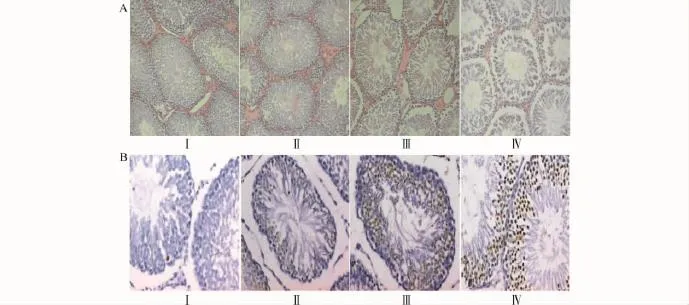
图1 CS2对大鼠睾丸组织形态学及细胞凋亡的影响Fig.1 Effects of CS2on HE staining and TUNEL of testis tissues in the rats
2.4 CS2对大鼠睾丸组织SOD、GSH-Px活性和MDA含量的影响
各组睾丸组织中SOD、GSH-Px活性及MDA含量变化见表2。随着CS2染毒浓度增加,各CS2染毒组大鼠睾丸组织SOD与GSH-Px活性呈下降趋势,而MDA含量则呈上升趋势,与空白对照组相比差异有统计学意义(P<0.05,P<0.01)。

表2 CS2对大鼠睾丸组织SOD、GSH-Px活性和MDA含量的影响(¯x±s,n=6)Table 2 Effects of CS2treatment on activities of SOD and GSH-Px,and MDA level in rat’s testes(¯x±s,n=6)
2.5 CS2对大鼠睾丸组织相关凋亡蛋白表达的影响
与空白对照组比较,各CS2染毒组p53蛋白表达含量均明显增加,中、高浓度组p53蛋白含量有显著提升(均P<0.01)(图2A)。随着CS2染毒浓度的增加,PARP蛋白含量呈下降趋势,但只有高浓度组与空白对照组比较差异有统计学意义(P<0.05)(图2B)。图2C与图2D显示,Bax蛋白含量呈上升趋势而Bcl-2蛋白含量呈下降趋势,中、高浓度组的Bax,Bcl-2蛋白含量与空白对照组比较差异有统计学意义(P<0.05,P<0.01)。
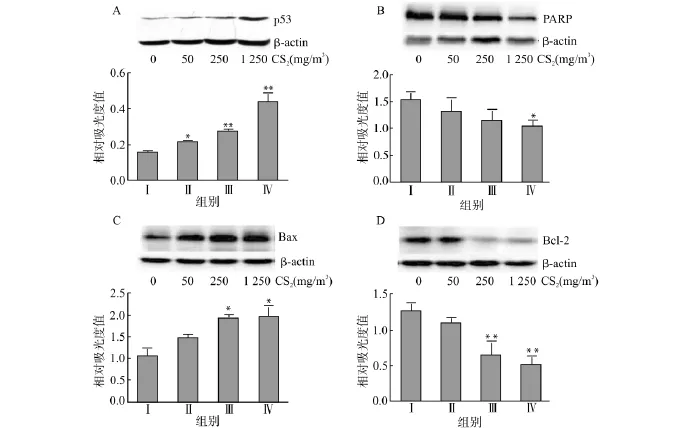
图2 大鼠睾丸组织p53、PARP、Bax及Bcl-2蛋白相对表达水平Fig.2 Relative expression levels of p53,PARP,Bax and Bcl-2 proteins in rat’s testes
3 讨论
CS2作为有机溶剂在工业生产中被广泛应用,已有大量流行病学研究表明长期接触一定浓度的CS2可导致男工性功能障碍、精液质量下降及子代流产率增加等[79]。蔡世雄等[10]在雄性小鼠吸入CS2实验发现,10和100 mg/m3CS2吸入组的精子畸变率都显著高于对照组。Tepe等[11]报道600 mg/LCS2吸入染毒能够导致异常的性行为、精子数量减少以及血清睾酮水平的降低。本研究发现,中、高浓度CS2染毒组大鼠体重、睾丸脏器系数及精子活动率出现较为明显的下降,与文献报道基本一致;HE染色结果显示,CS2可导致大鼠睾丸组织间质水肿,曲细精管内也出现生精细胞层次和数目减少,排列紊乱、疏松,各级精母细胞从生精上皮脱落,影响精子的发生。以上结果表明,CS2对大鼠生长发育、生殖系统发育及精子发生等均有损害作用。同时TUNEL法检测大鼠睾丸组织细胞凋亡结果显示,随着CS2染毒浓度的增加,中、高浓度组凋亡指数明显增加。因此,我们有理由相信CS2导致男(雄)性生殖系统损伤与细胞凋亡有关。
细胞凋亡是一种有别于坏死的细胞程序性死亡,涉及一系列基因的激活、蛋白表达及调控等。大量研究表明,活性氧自由基引发的脂质过氧化很可能是外源性化合物对机体造成损伤的分子机制之一[12]。当体内活性氧产生超过机体抗氧化能力时,可导致组织脂质过氧化水平升高,引起DNA氧化损伤及蛋白质表达异常,进一步诱发细胞凋亡[1314]。MDA是脂质过氧化物的分解产物之一,可反映机体组织内脂质过氧化的速率和程度,并间接反映细胞氧化损伤的程度。SOD和GSH-Px是体内主要的抗氧化酶,SOD能够歧化O2-形成H2O2,消除超氧阴离子毒性;GSH-Px能够催化脂质过氧化物转变为相应的醇类,同时能够催化H2O2转变为H2O和O2。本研究发现,CS2染毒使大鼠睾丸组织中SOD和GSH-Px活性下降,MDA含量升高,说明了CS2诱导大鼠睾丸组织发生脂质过氧化以及组织内抗氧化酶活性的减弱,当机体无法扭转氧化应激状态时,细胞凋亡随即发生。
肿瘤抑制因子p53是一种转录因子,同时作为基因毒性应激感受器,在调控基因表达和对细胞生存的调节方面发挥极其重要的作用。众多研究表明活性氧在多条通路上参与了p53信号通路转导[1517],而最常见的就是自由基直接攻击核酸分子引起DNA损伤[18],并通过转录激活p53从而增强自身稳定性和DNA结合活力。激活的p53将进一步活化众多凋亡因子促进细胞凋亡。有文献表明p53在过氧化氢诱导的细胞凋亡中发挥重要作用[19],而在过氧化氢处理过的细胞中,基因手段消除p53功能有助于增加细胞存活率[2021],这提示我们在氧化应激导致的细胞凋亡中p53有着不可忽视的作用。多聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)是一种DNA修复酶,参与调节DNA的修复、基因组完整性的维持及在转录复制分化水平上各种蛋白质的表达,同时是细胞凋亡Caspases活化后的剪切底物。最近研究发现,DNA损伤发生后细胞核内的p53受到PARP的多聚核糖基化修饰,无法向核外转运而在核内积累[22],PARP在调节p53转运出核这一过程中起到关键作用。因此,p53信号通路诱导的细胞凋亡中,PARP受到其下游Caspases酶的剪切,同时PARP对p53转运出核起到调控作用。Bcl-2家族在细胞凋亡中主要是对线粒体外膜的完整性进行调节,当众多凋亡因子结合p53后被激活转录表达,Bax基因表达增高而对Bcl-2基因则抑制其表达[23]。大量文献指出,Bax/Bcl-2的比例对于细胞凋亡极其关键,高Bax/Bcl-2将启动线粒体通路的细胞凋亡[2426]。本实验采用Western blot对大鼠睾丸组织p53、PARP、Bax和Bcl-2蛋白进行检测,结果发现p53、Bax蛋白表达呈上升趋势而PARP、Bcl-2蛋白表达呈下降趋势,说明p53和PARP参与了CS2诱导的细胞凋亡,而上调Bax/Bcl-2比例可能是CS2诱导细胞凋亡机制之一。
综上所述,我们可以认为CS2作用于大鼠睾丸组织时发生氧化应激产生大量自由基,而体内抗氧化系统能力减弱无法全部清除,自由基对组织和细胞直接造成毒性作用,如:大鼠体重、睾丸脏器系数、精子活动率下降,大鼠睾丸组织形态学损伤以及凋亡指数增加等。而CS2所诱导的细胞凋亡与p53信号通路、Bcl-2家族蛋白表达有关。
[1] Beauchamp R J,Bus J S,Popp J A,et al.A critical review of the literature on carbon disulfide toxicity[J].Crit Rev Toxicol,1983,11(3):169-278.
[2] 邓菁,季佳佳,赵艳芳,等.二硫化碳对男性生殖系统的毒性研究进展[J].环境与职业医学,2007,24(6):636-639.
[3] Chandra J,Samali A,Orrenius S.Triggering and modulation of apoptosis by oxidative stress[J].Free Radic Biol Med,2000,29(3/4):323-333.
[4] Bragado P,Armesilla A,Silva A,et al.Apoptosis by cisplatin requires p53 mediated p38 alpha MAPK activation through ROS generation[J].Apoptosis,2007,12(9):1733-1742.
[5] Mahmoud A M,Depoorter B,Piens N,et al.The performance of 10 different methods for the estimation of sperm concentration[J].Fertil Steril,1997,68(2):340-345.
[6] Lee W M,Tsang A Y,Wong P Y.Effects of divalent and lanthanide ions on motility initiation in rat caudal epididymal spermatozoa[J].Br J Pharmacol,1981,73(3):633-638.
[7] Vanhoorne M,Comhaire F,De Bacquer D.Epidemiological study of the effects of carbon disulfide on male sexuality and reproduction[J].Arch Environ Health,1994,49(4):273-278.
[8] Patel K G,Yadav P C,Pandya C B,et al.Male exposure mediated adverse reproductive outcomes in carbon disulphide exposed rayon workers[J].J Environ Biol,2004,25(4):413-418.
[9] Ma J Y,Ji J J,Qing D,et al.The effects of carbon disulfide onmale sexual function and semen quality[J].Toxicol Ind Health,2010,26(6):375-382.
[10] 蔡世雄,黄美媛,王贻嘉,等.二硫化碳对雄性小鼠生殖细胞作用的实验研究[J].卫生研究,1988,17(5):1-4.
[11] Tepe S J,Zenick H.The effects of carbon disulfide on the reproductive system of the male rat[J].Toxicology,1984,32(1):47-56.
[12] 武阳,常青,杨旭.不同浓度甲醛致大鼠肝细胞DNA氧化损伤作用[J].环境科学学报,2009,29(11):2415-2419.
[13] Kujoth G C,Hiona A,Pugh T D,et al.Mitochondrial DNA mutations,oxidative stress,and apoptosis in mammalian aging[J].Science,2005,309(5733):481-484.
[14] Ott M,Gogvadze V,Orrenius S,et al.Mitochondria,oxidative stress and cell death[J].Apoptosis,2007,12(5):913-922.
[15] Cardaci S,Filomeni G,Rotilio G,et al.Reactive oxygen species mediate p53 activation and apoptosis induced by sodium nitroprusside in SH-SY5Y cells[J].Mol Pharmacol,2008,74(5):1234-1245.
[16] Chowdhury R,Chowdhury S,Roychoudhury P,et al.Arsenic induced apoptosis in malignant melanoma cells is enhanced by menadione through ROS generation,p38 signaling and p53 activation[J].Apoptosis,2009,14(1):108-123.
[17] Yan W,Chen X.GPX2,a direct target of p63,inhibits oxidative stress-induced apoptosis in a p53-dependent manner[J].J Biol Chem,2006,281(12):7856-7862.
[18] Agarwal A,Said T M.Oxidative stress,DNA damage and apoptosis in male infertility:a clinical approach[J].BJU Int,2005,95(4):503-507.
[19] Kitamura Y,Ota T,Matsuoka Y,et al.Hydrogen peroxide-induced apoptosis mediated by p53 protein in glial cells[J].Glia,1999,25(2):154-164.
[20] Yin Y,Terauchi Y,Solomon G G,et al.Involvement of p85 in p53-dependent apoptotic response to oxidative stress[J].Nature,1998,391(6668):707-710.
[21] Buschmann T,Yin Z,Bhoumik A,et al.Amino-terminal-derived JNK fragment alters expression and activity of c-Jun,ATF2,and p53 and increases H2O2-induced cell death[J].J Biol Chem,2000,275(22):16590-16596.
[22] Kanai M,Hanashiro K,Kim S H,et al.Inhibition of Crm1-p53 interaction and nuclear export of p53 by poly(ADP-ribosyl)ation[J].Nat Cell Biol,2007,9(10):1175-1183.
[23] Miyashita T,Krajewski S,Krajewska M,et al.Tumor suppressor p53 is a regulator of Bcl-2 and Bax gene expression in vitro and in vivo[J].Oncogene,1994,9(6):1799-1805.
[24] 何乐亚,魏欣,徐丰,等.G0/G1期异时相Cyclin B1的表达对细胞凋亡的影响[J].华中科技大学学报:医学版,2013,42(1):38-41.
[25] Sakinah S A,Handayani S T,Hawariah L P.Zerumbone induced apoptosis in liver cancer cells via modulation of Bax/Bcl-2 ratio[J].Cancer Cell Int,2007,7(4):1-11.
[26] Gao M,Zhang W C,Liu Q S,et al.Pinocembrin prevents glutamate-induced apoptosis in SH-SY5Y neuronal cells via decrease of bax/bcl-2 ratio[J].Eur J Pharmacol,2008,591(1-3):73-79.
(2015-03-16 收稿)
Effects of Carbon Disulfide on Oxidative Stress and p53 mediated Apoptosis of Rat’s Testes
Wang Wei1,Huang Hao2,Li Liqian2et al
1Department of Occupational and Environmental Health,School of Public Health,2Eight-year Program of Clinical Medicine,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective To investigate effects of carbon disulfide(CS2)on oxidative stress and p53-mediated apoptosis in male rat’s testes,and explore its possible molecular mechanisms.Methods Twenty-four SD male rats were randomly divided into four groups:control group(Ⅰ),low-concentration group(Ⅱ),medium-concentration group(Ⅲ)and high-concentration group(Ⅳ).Three treatment groups were exposed to CS2at different concentrations(50,250,1250 mg/m3)by inhalation for 10 weeks,with 2 h per day,5 days per week.Rats of control group inhaled fresh air.Body weight,organ index,sperm count and sperm motility were recorded 10 weeks after CS2treatment.Histopathological changes of the testes were observed by HE staining.TUNEL was used to detect apoptosis of the testes.SOD,GSH-Px activities and MDA level were measured by chemical colorimetry in the rats.Also,we used Western blotting to detect the p53,PARP,Bax and Bcl-2 proteins levels in each group.Results Body weight,organ index,sperm count and sperm motility were decreased in CS2treatment groups,compared with the control group(P<0.05).The histopathological changes of the testes became more serious with the increase of CS2concentration.The apoptosis index was significantly higher in middle and high concentration groups than in control group(P<0.05).Meanwhile,activities of SOD and GSH-Px were significantly decreased,and MDA level was significantly increased(P<0.05,P<0.01).Western blotting showed that the level of p53 was significantly increased in CS2treatment groups(P<0.01).the level of PARP was declined significantly in high-concentration group(P<0.05).There were significant differences in the levels of Bax and Bcl-2 between medium and high concentration groups and the control group(P<0.05,P<0.01).Conclusion
Oxidative stress and p53 are involved in CS2induced apoptosis in rat’s testes.
carbon disulfide; apoptosis; oxidative stress; p53; reproductive toxicity
R588.1
10.3870/j.issn.1672-0741.2015.04.002
*国家自然科学基金资助项目(No.81172637)
王 为,男,1989年生,硕士研究生,E-mail:wangeternal@126.com
△通讯作者,Corresponding author,E-mail:guoychen@163.com
