广西不同地区喜树嫩叶中喜树碱含量测定*
2015-06-24秦庆芳粟本超
秦庆芳,粟本超
(1.广西壮族自治区柳州食品药品检验所,柳州 545006;2.广西生态工程职业技术学院,柳州 545004)
广西不同地区喜树嫩叶中喜树碱含量测定*
秦庆芳1,粟本超2
(1.广西壮族自治区柳州食品药品检验所,柳州 545006;2.广西生态工程职业技术学院,柳州 545004)
目的 对广西不同土质和海拔喜树嫩叶中的喜树碱含量进行分析比较。方法 采用高效液相色谱(HPLC)法测定喜树碱含量。色谱条件:色谱柱Agilent Eclipse XDB C18(4.6 mm×250 mm,5 μm);流动相:乙腈-水(27:73);流速:1.0 mL· min-1,检测波长:254 nm;柱温25 ℃;进样量:10 μL。结果 在20 min内完成对喜树嫩叶中喜树碱的色谱分析,且主成分峰与相邻的色谱峰之间分离度均>2.0;喜树碱的线性范围为0.074 35~0.743 5 μg(r=1),平均加样回收率96.48%(n=9)。喜树碱含量(单株)比较,生长在海拔500~1 000 m的喜树中喜树碱含量最高;石山生长的喜树中喜树碱含量大于土山。结论 该方法简便,快速,准确,可用于测定喜树嫩叶中喜树碱的含量。
喜树嫩叶;喜树碱;含量测定
喜树(CamptothecaacuminataDecne.)嫩叶为珙桐科植物喜树的干燥嫩叶,主要分布在长江流域及西南各省[1]。喜树碱(camptothecin,CPT)是喜树全株中含有的一种吲哚生物碱[2],具有显著的抗癌活性,是迄今发现唯一一种专门通过抑制拓扑异构酶I发挥细胞毒性的天然植物活性成分[3]。由于CPT溶解度低,对人体毒、副作用大,暂无临床应用价值[4],但通过对其进行结构修饰或直接筛选与结构相类似的衍生物,既能保持其原有的抗癌活性,又能提高其溶解度,减少毒副反应,具有很高的临床应用价值[5]。目前CPT-11、拓扑替康(topotecan,TPT)等喜树碱衍生物已被美国食品和药品管理局(Food and Drug Administration,FDA) 批准用于临床治疗癌症[6]。喜树各器官中CPT的含量存在较大差异,早期研究认为,果实中CPT含量高。近年研究表明,喜树嫩叶为富含CPT的器官,可以达到植株地上部分平均含量的4倍[7-8],而且最佳的是广西产喜树嫩叶 (含量1.69‰)[9]。以叶片为原料不仅采集方便、受季节影响小,而且合理的采集量还能减少对资源和环境的破坏。
笔者在本实验中以CPT含量为标准,用HPLC法测定广西12个县47批喜树单株嫩叶中CPT含量,分析影响CPT含量的因素,以期为筛选广西喜树碱优质种质资源提供科学依据。
1 仪器与试药
1.1 仪器 Agilent 1100高效液相色谱仪(二极管阵列检测器);超纯水器(Molecular),超声波发生器(SK8200HP)。电子分析天平(METTLER TOLEDO,型号:XS205,XP26,感量分别为0.1 mg和0.001 mg)。
1.2 试药 喜树嫩叶来自广西兴安县3个单株(单株编号:XA1~XA3下同)、灵川县1个单株(LC1)、永福县2个单株(YF1和YF2)、天峨县3个单株(TE1~TE3)、南丹县5个单株(ND1~ND5)、东兰县5个单株(DL1~DL5)、隆林县新州镇4个单株(LLa1~LLa4)、隆林县德峨乡9个单株(LLb1~LLb9)、凌云县2个单株(LY1和LY2)、西林县4个单株(XL1~XL4)、金秀县2个单株(JX1和JX2)、田林县3个单株(TL1~TL3)、德保县2个单株(DB1和DB2)共12个县13个采集点的47个单株,采样点为树高约2 m处某一侧枝从顶芽往下50 cm范围内的所有叶片。以上所有的喜树单株均经广西生态工程职业技术学院苏付保教授鉴定为喜树。喜树碱对照品(批号:100532-200401,含量:100%)来自中国食品药品检定研究院。乙腈、乙醇、甲醇、丙酮等试剂均为色谱纯,水为超纯水。
2 方法与结果
2.1 色谱条件 色谱柱:Agilent Eclipse XDB C18(4.6 mm×250 mm,5 μm),柱温:25 ℃ 流速:1.0 mL·min-1,检测波长:254 nm,进样量:10 μL。
2.2 对照品和供试品的制备 样品前处理:将样品放在干燥的室内自然风干,用高速中药粉碎机粉碎,过4号筛网(65目,筛孔内径250 μm),置于40 ℃干燥箱中干燥12 h,放冷,放入干燥器中备用。
供试品溶液:取上述粉碎干燥的样品0.5 g,精密称定,置10 mL量瓶,加入60%乙醇溶液约9 mL,50 ℃下超声提取10 min,取出,放冷,用60%乙醇溶液稀释至刻度,摇匀,滤过,取续滤液,即得。
对照品储备溶液制备:取喜树碱对照品7.435 mg精密称定,置100 mL量瓶,加60%乙醇溶液至刻度,摇匀,即得。
2.3 专属性实验 分别取“2.2”项对照品溶液、供试品溶液各10 μL,注入高效液相色谱仪,照”2.1”项色谱条件测定。结果表明,供试品溶液色谱图中均有与喜树碱保留时间相同的吸收峰,见图1。
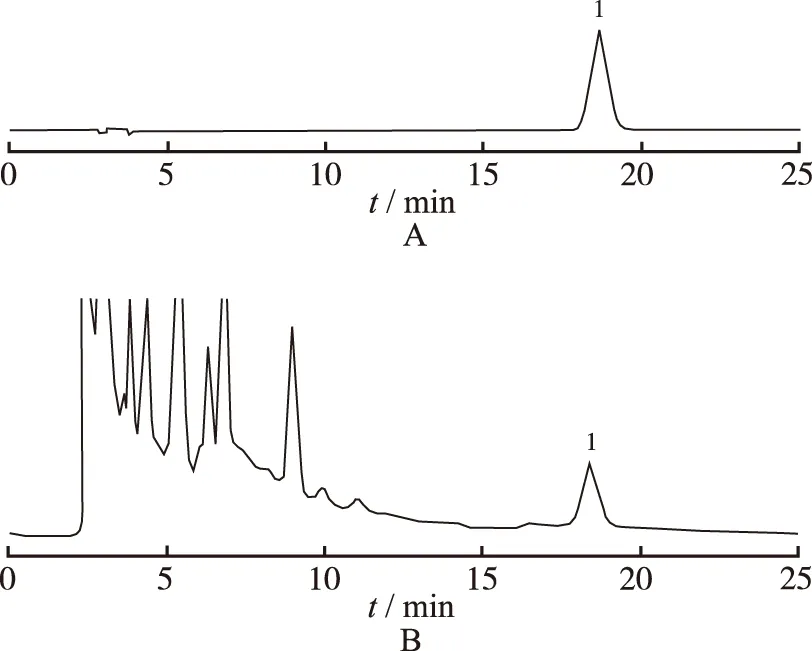
1.喜树碱
图1 喜树碱对照品(A)和喜树嫩叶样品(B)HPLC图谱
2.4 线性关系考察 分别精密吸取“2.2”项所配制的对照品储备液1,3,5,7,9,10 mL置于10 mL量瓶,用60%乙醇溶液分别稀释并定容,摇匀,即得系列浓度对照品溶液。按照上述色谱条件分别取系列浓度的对照品溶液进样分析,每份溶液重复进样3 次, 取3次峰面积的平均值。得峰面积(Y)与喜树碱进样量(X,μg)的线性回归方程为:Y=4 826.3X-50.84,r=1.000 0。
2.5 精密度实验 精密吸取“2.2”项所配制的对照品储备溶液10 μL,按照上述色谱条件连续进样6次,测定峰面积,RSD为0.18%,说明仪器精密度较好。
2.6 重复性实验 取DB1样品6份,按照“2.2”项方法制备供试品溶液,按上述色谱条件进样,测定峰面积,计算得喜树碱的平均含量为1.287‰,RSD为0.56%,说明重复性良好。
2.7 稳定性实验 将DB1供试品溶液,分别静置0,4,8,12,16 h后进样测定峰面积,RSD为0.6%。说明稳定性好。
2.8 加样回收率实验 精密称取已测知喜树碱含量(JX1)的同一批样品0.25 g,共9份,3份为一组,每组分别精密加入“2.2”项对照品储备液2.8,3.5,4.2 mL混合,按“2.2”项方法制备所需溶液,按上述色谱条件进样,测定峰面积,每份溶液重复进样3次,计算平均回收率和RSD。结果平均回收率96.48%,RSD为0.4%,说明回收率好。
2.9 样品含量测定与分析 精密称取样品粉末各0.5 g, 分别按照“2.2”项方法制成供试品溶液。取各供试品溶液10 μL,按“2.1”项色谱条件进样,测定峰面积,每份溶液重复进样3 次。用回归方程计算各样品中CPT的含量,结果见表1。

表1 样品测定结果
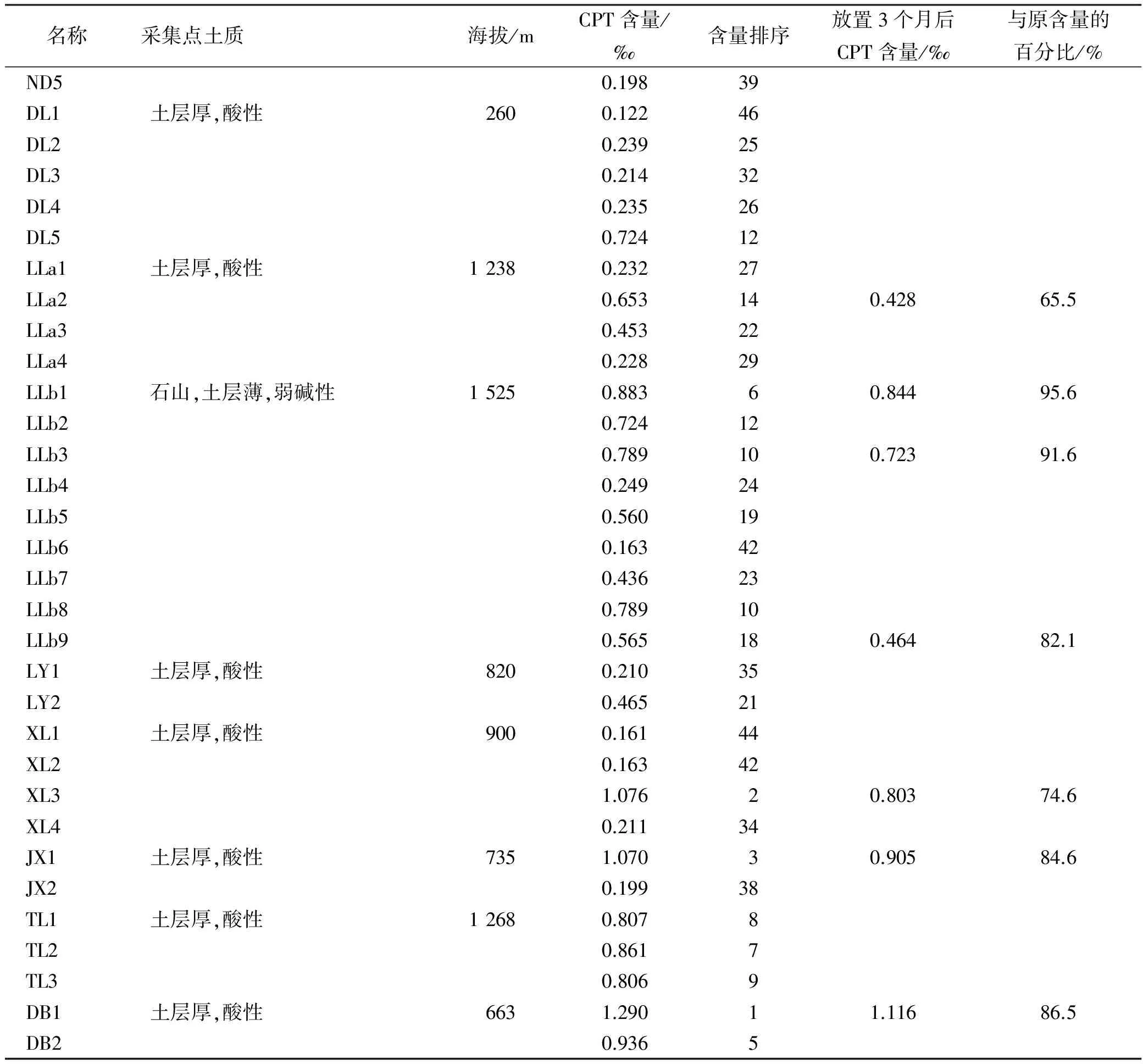
续表1
由表1可知,排名前5名的单株中有4株分布在海拔500~1 000 m,分别排在1,2,3和5位。可见,海拔影响CPT的含量,在广西分布在500~1 000 m单株CPT含量较高。另外,比较LLa系列和LLb系列可知, LLb系列9个单株中有4株(占44.44%)排名进入前15名,而LLa系列4个单株中仅1株(占25.00%)排名进入前15名,排在14位。可见,土质影响CPT的含量,生长在石山上的单株CPT含量高于生长在土山上的单株。
2.10 喜树嫩叶稳定性考察 将10批已知CPT含量的阴干喜树嫩叶在室温下避光放置3个月后,按“2.2”项制备供试品溶液,按“2.1”项色谱条件进样,测定峰面积,每份溶液重复进样3 次。用回归方程计算各样品中CPT含量,并与原来含量比较,结果见表1。10批样品CPT含量平均下降16.2%,最高下降达34.5%。说明喜树嫩叶中CPT在室温条件下很不稳定。
3 讨论
3.1 提取方法的选择 本实验对样品的提取溶剂[不同浓度(40%,60%,70%,80%,100%)的甲醇、乙醇、丙酮]、提取温度(20,30,40,50,60 ℃)和提取时间(5,10,20,30,50 min)进行了考察研究,结果表明用60%乙酸50 ℃超声提取10 min最佳。
3.2 检测波长的选择 取喜树碱对照品溶液,在200~400 nm波长范围内扫描,结果喜树碱在254 nm处有最强吸收,大量研究也以254 nm作为喜树碱的检测波长[8-17]。因此,本实验选用254 nm作为紫外检测器的检测波长。
3.3 流动相的选择 本实验在参考文献[8-17]中的流动相和比例,均不能达到满意的效果的情况下,考察了乙腈-水和甲醇-水不同梯度配比的流动相系统,结果表明:流动相为乙腈-水(27:73)时喜树碱与相邻峰的分离度均达2.0,且喜树碱峰的理论板数>5 000。
3.4 样品干燥方法选择 由于CPT对光和热不稳定[18],因此喜树嫩叶放置后会导致CPT含量降低。因自然风干样品干燥程度不一样,故参考文献[14],选择40 ℃低温干燥12 h的样品干燥方法。以避免其含量降低并且达到样品干燥的目的。
从47批单株的测定结果看出,喜树碱含量有明显差异。海拔影响喜树碱的含量,在广西分布在500~1 000 m的单株喜树碱含量较高。土质影响喜树碱的含量,生长在石山上的单株喜树碱含量高于生长在土山上的单株。另外,喜树嫩叶中CPT不稳定,含量容易下降,采集好嫩叶后应尽快提取。
[1] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1983:144.
[2] WALL M E,WANI M C,COOK C E, et al.Plant antitumor agents.The isolation and structure of camptothecin, a novel alkaloidal leukemia and tumor inhibitor fromCamptothecaacuminata[J].J Am Chem Soc,1966,88(16):3888-3890.
[3] HSIANG Y H,HERIZBENG R,HECHT S,et al.Camptothecin induces protein-Linked DNA breaks via mammalian DNA topoisomerase I[J].J Biol Chem,1985,260(27):14873-14878.
[4] 冯建灿,张玉洁,谭运德,等.喜树与喜树碱开发利用进展[J].林业科学,2000,36(5):100-108.
[5] GIOVANELLA B C.Topoismerase I Inhibitors [A].Cancer Therapeutics: Experimental and Clinical Agent s ( B.teicher Humanaeds1 )[C].1997:137-152.
[6] POTMESIL M,PINEDO H.Camptothecins: New anticancer agents[M].Boca Raton: CRC Press,2000:67-112.
[7] 王洋,于涛,张玉红,等.从喜树叶中碱法提取喜树碱新工艺[J].中草药,2001,32(10):882-884.
[8] LIU Z,CARPENTER S B,BOURGEOIS W J,et al.Variations in the secondary metabolite camptothecin in relation to tissue age and season inCamptothecaacuinata[J].Tree Physiology,1998,18(4):265- 270.
[9] 阎秀峰,王洋,于涛,等.喜树叶中喜树碱含量的高效液相色谱分析[J].分析测试学报,2002,21(2):15-17.
[10] 方旭东,陈绍宇.喜树碱含量的测定方法研究[J].天津化工,2011,25(2):46-48.
[11] 苏青,黄瑞松,周芳礼,等.HPLC对广西不同采收期喜树果中喜树碱成分动态积累的研究[J].广西医科大学学报,2011,28(5):678-680.
[12] 王玲丽,马沛勤,刘文哲.HPLC法测定喜树幼枝中喜树碱的含量[J].药物分析杂志,2008,28(9):1535-1537.
[13] 李红英,向极钎,曾凡忠,等.不同时间采摘的喜树嫩叶中喜树碱含量的HPLC分析[J].安徽农业科学,2009,37(13):5825,5827.
[14] 李嘉,黄瑞松,黄建猷,等.不同干燥方法对喜树果中喜树碱含量的影响[J].广西医学,2006,28(11):1699-1701.
[15] 郭勇,林桂芸,孙雁霞,等.喜树叶片中喜树碱含量的季节变化研究[J].西南农业学报,2006,19(1):143-145.
[16] 李红英,龙澜,李亚杰,等.喜树嫩叶中喜树碱的HPLC提取方法的选择[J].湖北民族学院学报(自然科学版),2012,30(2):139-141.
[17] 孙雁霞,邬晓勇,王跃华,等.喜树碱提取方法研究[J].成都大学学报(自然科学版),2008,27(2):89-91.
[18] 刘展眉,崔英德,方岩雄.自然光和热对闭环(E环)喜树碱稳定性的影响[J].广东化工,2005,32(7):3-4,7.
DOI 10.3870/yydb.2015.03.028
2014-01-16
2014-02-20
*2008年度广西教育厅科研项目(200809MS127);2012年广西教育厅高等教育教学改革工程项目(NO.2012JCA363)
秦庆芳(1971-),女,广西桂林人,副主任药师,学士,研究方向:食品药品检测及质量标准研究。E-mail:465764508@qq.com。
粟本超(1971-),男,广西桂林人,副教授,硕士,研究方向:植物有效成分提取分离与鉴定。E-mail:sbch_1971@126.com。
R286;R927.1
B
1004-0781(2015)03-0388-04
