富亮氨酸胶质瘤失活1蛋白抗体阳性边缘系统脑炎7例临床分析
2015-06-24唐鹤飞刘玉坤张然邵晓秋王新高张星虎张在强
唐鹤飞 刘玉坤 张然 邵晓秋 王新高 张星虎 张在强
富亮氨酸胶质瘤失活1蛋白抗体阳性边缘系统脑炎7例临床分析
唐鹤飞 刘玉坤 张然 邵晓秋 王新高 张星虎 张在强
目的 总结富亮氨酸胶质瘤失活1蛋白(LGI1)抗体阳性边缘系统脑炎临床特点及免疫治疗反应,以提高对该病的认识。方法 分析2012-03-2014-07在天坛医院神经内科就诊的7例LGI1抗体阳性边缘系统脑炎患者的临床、实验室检查资料,总结不同治疗方案患者的预后。结果 7例患者以精神行为异常、认知功能下降、颞叶癫痫为主要临床表现。均行脑脊液检查,其中4例常规、生化正常,3例表现为蛋白轻度升高。3例患者出现顽固性低钠血症。所有患者肿瘤标志物、影像学筛查均未发现肿瘤,副肿瘤抗体(抗-Hu、-Yo、-Ri、-Ma2)阴性。4例脑电图检查异常,表现为局灶性癫痫样放电或节律减慢。4例MRI检查Flair及T2序列可见颞叶内侧高信号病灶。7例患者经免疫调节治疗预后良好。结论 LGI1抗体阳性边缘系统脑炎以认知功能下降、癫痫发作为主要临床表现,常伴有低钠血症,极少伴有肿瘤;病灶累及颞叶内侧为主,T2或Flair序列为高信号;具有较好的免疫治疗效果,及时的诊断及治疗有助于患者的恢复。
抗富亮氨酸胶质瘤失活1蛋白;边缘叶脑炎;副肿瘤综合征,神经系统
自身免疫突触脑炎(autoimmune synaptic encepahlitis,ASE)临床症状包括癫痫、记忆力障碍、精神行为异常、意识下降等。ASE是一类体内存在抗神经元表面或突触蛋白抗体的疾病,如电压门控钾通道抗体,其中最常见类型为抗富亮氨酸胶质瘤失活1蛋白(LGI1)抗体。这部分患者一般不伴发恶性肿瘤,对免疫治疗效果好[1-3]。本研究总结7例LGI1抗体阳性边缘系统脑炎患者的临床表现、影像学和电生理检查以及治疗反应特点,以期加深对此病的认识,减少误诊。
1 对象和方法
1.1 对象 回顾性分析2012-03-2014-07在天坛医院被诊断为LGI1抗体阳性边缘系统脑炎患者7例,其中男5例,女2例,年龄34~56岁,平均(45.9±6.9)岁。7例治疗后症状均好转。
1.2 方法 对7例患者的临床表现、实验室检查〔所有患者均行血清及脑脊液抗N-甲基-D-天冬氨酸(NMDA)受体、LGI1、突触素相关蛋白2(CASPR2)等神经元表面或突触蛋白相关抗体检测,经典副肿瘤抗体(抗-Hu、-Yo、-Ri)及病毒(单纯疱疹病毒、巨细胞病毒、风疹病毒等)抗体检测〕、磁共振、脑电图、免疫治疗的反应及预后进行分析。
2 结果
2.1 临床表现 首发症状以认知功能下降发病4例,癫痫发作起病2例,精神行为异常发病1例。临床表现认知功能下降5例,主要为近记忆力下降;精神行为异常4例;癫痫发作4例,其中面-臂肌张力障碍发作(FBDS)1例;睡眠障碍3例;自主神经功能障碍2例,表现为体位性低血压、便秘、尿潴留;疼痛2例;神经性肌强直1例;视听幻觉1例。
2.2 实验室检查 7例患者均行脑脊液检查,其中4例常规、生化正常,3例表现为蛋白轻度升高,白细胞数均正常。所有患者血清LGI1抗体阳性,脑脊液LGI1抗体阳性5例。所有患者经典副肿瘤抗体(抗-Hu,-Yo,-Ri,-Ma2)阴性,肿瘤标志物、肿瘤影像学筛查均未发现肿瘤,病毒抗体阴性。顽固性低钠血症3例。脑电图检查结果显示异常4例,其中3例可见癫痫样异常放电,1例可见局灶性节律减慢。所有患者均行核磁检查,4例在Flair及T2序列可见颞叶内侧高信号病灶,其中2例为双侧。4例患者进行影像学复查随访,其中1例随访30个月,发病后1周,可见左侧颞叶斑片状长T1、长T2信号,Flair序列高信号病灶,可见小片状强化;发病后3个月 双侧海马肿胀,T2及Flair高信号病灶,未见明显异常强化;发病后18个月双侧海马萎缩,左侧为主,未见信号异常,无明显强化;病后30个月双侧海马萎缩(图1)。
2.3 治疗及预后 单一糖皮质激素治疗4例,联合治疗(激素联合丙种球蛋白)3例,免疫调节治疗均有效。癫痫发作、认知功能下降、精神行为异常、自主神经功能障碍等临床症状均明显改善。4例随访患者均无肿瘤迹象。其中2例痊愈,1例激素治疗有效患者,4个月后激素减量过程中再次出现认知功能障碍加重及精神症状,联合免疫球蛋白治疗症状缓解,仅遗留轻度认知功能障碍,表现为近记忆力下降,无癫痫发作,日常生活能力恢复至病前状态。1例随访30个月,遗留轻度认知功能障碍,有颞叶癫痫发作,但发作次数明显减少,口服抗癫痫药物有效。
3 讨论
LGI1抗体阳性边缘系统脑炎是近年来才被认识的一种自身免疫性疾病。LGI1为突触前膜分泌的糖蛋白,通过控制突触前的KV.1通道及突触后的α-氨基羟甲基恶唑丙酸受体(AMPAR)进而影响突触的传递[4]。在患者的血清及脑脊液中可发现抗LGI1抗体。免疫介导的LGI1损害常侵犯颞叶内侧导致记忆障碍和癫痫发作。由于对免疫治疗效果较好,及时诊断该病具有重要意义。
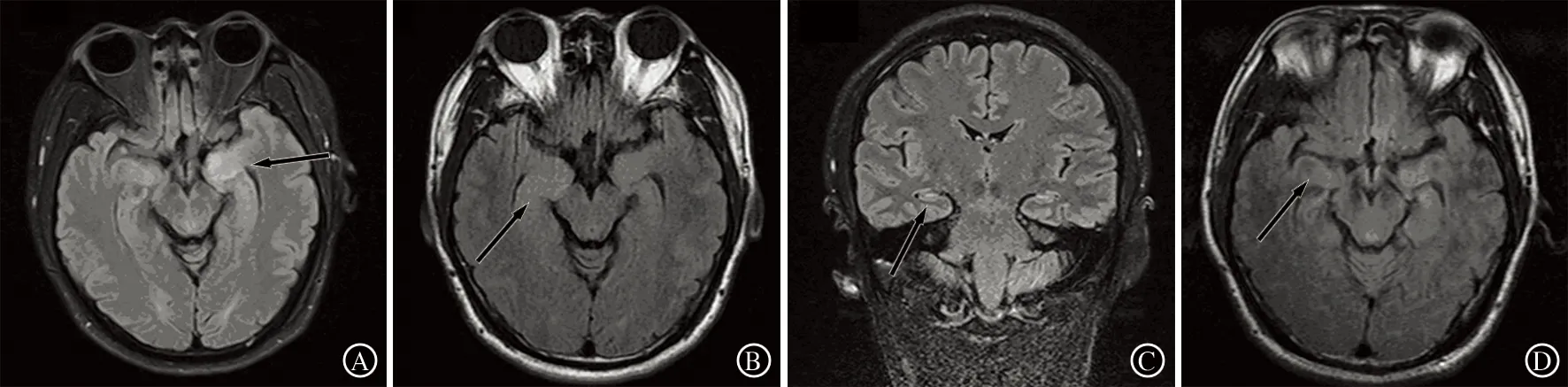
A:患者发病后1周,左侧颞叶高信号病灶(箭头所示);B:发病后3个月,双侧海马高信号病灶,伴肿胀(箭头所示);C:发病后18个月,双侧海马萎缩(箭头所示);D:发病后30个月,双侧海马萎缩(箭头所示)
图1 某例患者头MRI检查结果(Flair序列)
LGI1抗体阳性边缘系统脑炎发病率占自身免疫突触脑炎的30%左右[5]。发病的平均年龄为57岁(44~79岁),65%为男性[6],单向病程为主[4, 7],且有自发缓解倾向[8]。本组患者前驱症状有头痛、恶心呕吐、发热、上呼吸道感染等,很容易误诊为病毒脑炎。临床表现以亚急性起病的认知功能下降为主要表现。认知功能障碍中最突出的表现是近记忆力下降,定向力障碍。其他表现还包括精神行为异常、自主神经功能异常、睡眠障碍、慢性疼痛、神经性肌强直等。本组患者另一个突出的临床特点是癫痫发作,可表现为颞叶癫痫、全身强直阵挛发作等。还可表现为毛发运动癫痫、以胸痛为表现的部分性癫痫发作等非典型表现[9]。具有诊断意义的发作类型是FBDS,表现为短暂的,少于3 s的累及面、肩膀、手臂不自主运动。FBDS与LGI1抗体阳性边缘系统脑炎高度相关,且多为首发表现,40%患者会出现。目前普遍认为FBDS是张力性癫痫发作[10-11],对抗癫痫药物反应差,免疫调节治疗有效。
LGI1抗体阳性边缘系统脑炎患者脑脊液检查多为轻度炎性反应改变伴有轻中度蛋白升高[6]。低钠血症在LGI1抗体阳性边缘系统脑炎中比较常见,60%~80%的患者可出现,并且通常表现为难以纠正的顽固性低钠血症。大多数病例属于抗利尿激素分泌不当综合征。本研究患者均未发现肿瘤证据。大部分LGI1抗体阳性边缘系统脑炎患者不存在恶性肿瘤,少数(约5%)仍可见胸腺瘤、小细胞肺癌或前列腺癌。对于合并肿瘤的患者,LGI1抗体与肿瘤的关系尚不清楚[7]。
多数患者头部MRI的T2及Flair序列上可显示双侧海马区高信号,少数患者仅显示一侧海马区信号异常或MRI正常。除颞叶内侧最常被累及外,基底节区也可受累[4]。本研究患者累及颞叶内侧为主,早期可见海马肿胀伴有增强,恢复期可见海马萎缩及硬化。脑电图可以表现为一侧或双侧癫痫样放电或局灶性慢波活动。脑电图检查对本病的诊断缺少特异性[11]。癫痫样放电往往位置较深,头皮脑电图常无异常放电,蝶骨电极可以提高诊断的阳性率。
目前一线的免疫治疗方法包括糖皮质激素、免疫球蛋白或者血浆置换。对于复发患者,可以考虑二线药物如利妥昔单抗或环磷酰胺[5]。由于报道的病例数还很少,目前尚无推荐的标准免疫治疗方案,包括治疗方式选择、治疗时间等。Shin等认为联合治疗组预后优于单一治疗组,早期治疗预后好。本病复发少见,常见于药物减量过程中,联合治疗可减少复发[4]。本病总体预后良好,有自愈倾向[8]。从目前随访情况看,本组患者免疫调节治疗均有效,复发患者联合治疗仍有效,远期预后尚待随诊观察。
对于急性起病的记忆减退、FBDS、低钠血症以及影像学提示边缘系统受累的患者,应想到LGI1抗体阳性边缘系统脑炎的可能。由于该病对免疫治疗效果通常较好,应尽早检测抗LGI1抗体并给予相应的免疫治疗。
[1]Lai M, Huijbers MG, Lancaster E, et al. Investigation of LGI1 as the antigen in limbic encephalitis previously attributed to potassium channels: a case series[J]. Lancet Neurol, 2010,9(8):776-785.
[2]郑艺明, 孙葳, 王朝霞,等. 富亮氨酸胶质瘤失活1蛋白自身抗体相关边缘性脑炎1例[J]. 北京大学学报(医学版), 2014, (04): 646-649.
[3]金丽日, 柳青, 任海涛, 等. 富亮氨酸胶质瘤失活1蛋白抗体阳性边缘系统脑炎一例临床特点[J]. 中华神经科杂志, 2013,46(7):461-464.
[4]Shin YW, Lee ST, Shin JW, et al. VGKC-complex/LGI1-antibody encephalitis: clinical manifestations and response to immunotherapy[J]. J Neuroimmunol, 2013,265(1-2):75-81.
[5]Lancaster E, Martinez-Hernandez E, Dalmau J. Encephalitis and antibodies to synaptic and neuronal cell surface proteins[J]. Neurology, 2011,77(2):179-189.
[6]Ramanathan S, Mohammad SS, Brilot F, et al. Autoimmune encephalitis: recent updates and emerging challenges[J]. J Clin Neurosci, 2014,21(5):722-730.
[7]Vincent A, Bien CG, Irani SR, et al. Autoantibodies associated with diseases of the CNS: new developments and future challenges[J]. Lancet Neurol, 2011,10(8):759-772.
[8]Szots M, Marton A, Kover F, et al. Natural course of LGI1 encephalitis: 3-5 years of follow-up without immunotherapy[J]. J Neurol Sci, 2014,343(1-2):198-202.
[9]Rocamora R, Becerra JL, Fossas P, et al. Pilomotor seizures: An autonomic semiology of limbic encephalitis?[J]. Seizure, 2014, 23(8):670-673.
[10]Andrade DM, Tai P, Dalmau J,et al. Tonic seizures: a diagnostic clue of anti-LGI1 encephalitis?[J].Neurology, 2011, 76(15):1355-1357.
[11]Irani SR, Michell AW, Lang B, et al. Faciobrachial dystonic seizures precede Lgi1 antibody limbic encephalitis[J]. Ann Neurol, 2011,69(5):892-900.
(本文编辑:时秋宽)
Clinical analysis of 7 patients with leucine-rich glioma inactivated-1 protein antibody positive limbic encephalitis
TANGHefei,LIUYukun,ZHANGRan,SHAOXiaoqiu*,WANGXigao,ZHANGXinghu,ZHANGZaiqiang.
*DepartmentofNeurology,BeijingTiantanHospital,CapitalMedicalUniversity, 100050Beijing,China
SHAO Xiaoqiu, Email: Shaoxiaoqiu2000@aliyun.com
Objective We summarize the clinical features and immunotherapeutic response of leucine-rich glioma inactivated -1 protein(LGI1) antibody positive limbic encephalitis to deepen the understanding of this disease. Methods We analyzed the clinical features of 7 patients who were admitted to Tiantan hospital from March 2012 to July 2014, and observed the prognosis of different treatments. Results Seven patients mainly presented with psychiatric symptoms, memory loss, and epilepsy. Of the 7 patients who underwent cerebrospinal fluid(CSF) examination, 4 were found to have normal CSF tests while 3 had mildly increased protein concentrations. Three of the 7 patients were found to have hyponatremia. Screening for malignant tumors of the chest and abdomen revealed normal findings. Paraneoplastic antibodies (anti-Hu,-Yo,-Ri,-Ma2) were negative in all the 7 patients. Four electroencephalographs showed slow wave activity or epileptic form discharges. Magnetic resonance imaging(MRI) was normal or showed T2WI and flair-phase high signal in the medial temporal lobes. All patients treated with immunomodulatory therapy had favorable outcomes. Conclusions Most patients develop the classic syndrome of limbic encephalitis and is distinguishable from other limbic encephalitis because of hyponatremia, a weak association with cancer. T2 or flair MRI scans mainly show high signals in the medial temporal lobes. Anti-LGI1 encephalitis is a kind of treatable condition. And timely diagnosis and treatment may yield a favorable prognosis.
leucine-rich glioma inactivated-1 protein antibody; limbic encephalitis; paraneoplastic syndromes,nervous system
10.3969/j.issn.1006-2963.2015.02.008
100050 北京首都医科大学附属北京天坛医院神经内科(唐鹤飞、邵晓秋、王新高、张星虎、张在强);辽宁省葫芦岛市连山区人民医院(刘玉坤);河北省承德市中心医院神经内科(张然)
邵晓秋,Email:Shaoxiaoqiu2000@aliyun.com
R512.3
A
1006-2963 (2015)02-0188-03
2014-08-01)
