头孢曲松钠减轻水通道蛋白4抗体对星形胶质细胞的毒性作用
2015-06-24李义沙任玉腾任士卿
李义沙 任玉腾 任士卿
头孢曲松钠减轻水通道蛋白4抗体对星形胶质细胞的毒性作用
李义沙 任玉腾 任士卿
目的 探讨头孢曲松钠在水通道蛋白4(AQP4)抗体诱导的星形胶质细胞损伤中的作用以及机制。方法 常规体外培养新生SD大鼠大脑皮质细胞,将培养的细胞分为4组,分别加入健康人血清(对照组)、AQP4抗体阳性患者血清、头孢曲松钠+AQP4抗体阳性血清以及单纯头孢曲松钠。细胞培养24 h后采用免疫组织化荧光染色观察不同组星形胶质细胞数目的变化,采用比色法测定上清液谷氨酸浓度以及免疫印迹分析谷氨酸转运体-1(GLT-1)蛋白表达水平。结果 和对照组比较,AQP4抗体阳性血清组星形胶质细胞数目和谷氨酸转运体-1(GLT-1)蛋白表达明显减少,上清液谷氨酸浓度明显增高(均P<0.01),而单纯头孢曲松钠组仅显著增加GLT-1蛋白表达(P<0.01),并不影响星形胶质细胞数目和谷氨酸水平(P>0.05);和AQP4抗体阳性组比较,头孢曲松钠+AQP4抗体阳性血清组星形胶质细胞数目和GLT-1蛋白表达增加,上清液谷氨酸浓度明显下降(P<0.01)。结论 头孢曲松钠可能通过上调星形胶质细胞GLT-1表达、减少细胞外液谷氨酸水平发挥减轻AQP4抗体对体外培养的大鼠脑皮质星形胶质细胞的毒性作用。
视神经脊髓炎;水通道蛋白4;头孢曲松;谷氨酸;谷氨酸转运体1;星形胶质细胞
视神经脊髓炎(NMO)是一种自身免疫性炎性脱髓鞘性中枢神经系统疾病。随着研究进展,越来越多的证据支持水通道蛋白-4(AQP4)抗体在NMO发病机制中发挥重要作用。AQP4抗体和星形胶质细胞突触膜上的AQP4结合产生补体依赖性细胞毒性作用和抗体依赖性细胞介导的细胞毒性作用,引起星形胶质细胞死亡、炎性反应细胞聚集、炎性反应因子释放和血-脑脊液屏障的破坏,导致少突胶质细胞死亡、髓鞘丢失以及神经元死亡,产生NMO的病理改变[1]。既往研究表明AQP4抗体和AQP4结合引起星形胶质细胞谷氨酸转运体-1(GLT-1)内陷、下调GLT-1表达和星形胶质细胞谷氨酸再摄取下降,推测其导致的细胞外谷氨酸浓度增加是神经元和少突胶质细胞死亡原因之一[2-3]。上述研究结果提示谷氨酸兴奋性毒性作用涉及NMO的发病机制。但也有研究指出AQP4抗体并不引起星形胶质细胞GLT-1内陷和谷氨酸摄取率的下降[4],故谷氨酸兴奋性毒性作用在NMO发病机制中的作用仍需进一步研究证实。
作者研究小组既往研究证实AQP4抗体阳性血清能导致体外培养的大鼠大脑皮质细胞中星形胶质细胞死亡,小胶质细胞激活和神经元死亡[5]。同时β-内酰胺类抗生素头孢曲松钠能上调星形胶质细胞GLT-1的表达,通过减少细胞外谷氨酸浓度在多种神经系统疾病中产生神经保护作用[6]。本研究采用大鼠大脑皮质细胞培养,观察头孢曲松钠对AQP4抗体阳性血清诱导的星形胶质细胞毒性作用、GLT-1表达以及细胞上清液谷氨酸浓度的影响,旨在探讨头孢曲松钠在AQP4抗体对星形胶质细胞损伤中的作用以及相关机制。
1 材料和方法
1.1 材料
1.1.1 实验动物:出生24 h之内SD大鼠新生鼠10只,由河北医科大学实验动物中心提供(合格证编号:1403062)。
1.1.2 主要试剂和仪器:DMEM/F12购自美国Gibco公司;胎牛血清购自杭州四季青公司;多克隆AQP4抗体购自英国Abcam公司;神经胶质原纤维酸性蛋白(GFAP)购自美国NeoMarkers公司;头孢曲松钠购自上海罗氏制药公司;谷氨酸检测试剂盒购自南京建成生物工程研究所;豚鼠抗大鼠GLT-1多克隆抗体购自美国Millipore公司;Western blotting电泳设备为美国Bio-Rad公司产品;FITC标记的抗兔IgG荧光二抗购自美国Sigma公司;CO2细胞培养箱购自美国Thermo Forma公司;TE2000-U型倒置荧光显微镜为日本Nikon公司产品。
1.1.3 血清来源:AQP4抗体阳性血清来自河北医科大学第三医院神经内科住院患者。该患者女,41岁,视神经炎和脊髓炎反复发作,使用AQP4抗体酶联免疫吸附试验试剂盒测定其血AQP4抗体浓度为215.53 μmol/L。健康人血清取自同年龄健康查体者。取早晨空腹静脉血,高速离心机离心3 min(离心加速度1335g),血清分装并保存在-80℃冰箱备用。本研究得到河北医科大学第三医院伦理委员会批准。
1.2 方法
1.2.1 SD大鼠大脑皮质细胞培养[5]:取出生24 h之内的SD大鼠大脑皮质,剥离脑膜和血管后移至装有1 mL PBS的器皿中,用解剖剪剪碎皮质组织,加入1 mL 0.25%(质量浓度)的胰酶,置于37℃ 5%(体积分数)CO2的细胞培养箱内孵育消化20 min。加入含20%(体积分数)胎牛血清的DMEM/F12细胞培养液终止消化,移入离心管中。用玻璃吸管反复轻轻吹打,机械分离后制成单细胞悬液。离心5 min(离心加速度356g),弃上清液,加含20%(体积分数)胎牛血清的DMEM/F12培养液。吹打细胞后400目细胞滤器过滤,将细胞接种于预先包被多聚赖氨酸的35 mm的培养皿中,于37℃ 5%(体积分数) CO2孵育箱内孵育。分别于24 h、72 h、6 d时换液。培养6 d后用于实验。
1.2.2 实验分组:将培养的大鼠大脑皮质细胞分正常血清对照组、AQP4抗体阳性血清组、头孢曲松钠+AQP4抗体阳性血清组以及单纯头孢曲松钠组。具体操作如下:细胞培养6 d后,头孢曲松钠+AQP4抗体阳性血清组和单纯头孢曲松钠组先给予含有10 μmol/L 头孢曲松钠的DMEM/F12培养液换液,48 h后正常血清对照组加入10%(体积分数)的正常人血清,AQP4抗体阳性血清组和头孢曲松钠+AQP4抗体阳性血清组分别加入等量AQP4抗体阳性患者血清,细胞继续培养24 h后进行细胞GLT-1蛋白表达水平及培养液上清谷氨酸含量测定。
1.2.3 免疫细胞荧光染色:细胞用0.01 mol/L PBS(pH 7.4)漂洗3次,4%(质量浓度)多聚甲醛室温固定30 min,0.2%(体积分数)Triton X-100透化细胞5 min,10%(体积分数)山羊血清室温下封闭细胞45 min,加入鼠抗GFAP(1∶200),4℃过夜,再加入山羊抗鼠IgG(1∶100)封闭30 min,Hoechst33258(10 μg/mL)复染胞核。在倒置荧光显微镜下随机选择10个不相同的视野,使用NIS-Elements BR 3.0软件采样,应用Image Pro-Plus软件计算每个高倍视野下GFAP阳性细胞数。各组实验独立重复3次,取平均值。

GFAP:神经胶质原纤维酸性蛋白;AQP4:水通道蛋白4;A:正常血清对照组;B:AQP4抗体阳性血清组;C:单纯头孢曲松钠组;D:头孢曲松钠+AQP4抗体阳性血清组
图1 各组大鼠脑皮质细胞培养中GFAP阳性细胞结果(免疫细胞荧光染色×200)
1.2.4 Western blotting检测GLT-1蛋白表达:培养的细胞弃上清,预冷的PBS洗涤3次,加入200 μL预冷的细胞裂解液裂解15 min,振荡后收集上清,4℃以12 000g高速离心15 min,收集上清即为总蛋白,用BCA法测定蛋白浓度后分装于-80℃保存。配制并灌注12%(体积分数)SDS-PAGE的分离胶和5%(体积分数)浓缩胶,取蛋白样品与5×蛋白上样缓冲液混匀,100℃水浴5 min,每孔上样50 μg总蛋白,进行电泳。电泳完毕后,将蛋白转至PVDF膜上,转膜后,将PVDF膜置于5%(质量浓度)脱脂奶粉中,37℃,封闭1 h。一抗孵育4℃过夜,取出置于37℃孵育箱中静置1 h复温。复温结束后,用TPBS溶液振洗3次,每次15 min。二抗孵育PVDF膜,置于37℃摇床缓慢摇动1 h。洗膜后三抗孵育PVDF膜,37℃孵育箱静置1 h,洗膜后化学发光显色。以灰度值表示GLT-1的表达水平,样本数为20。
1.2.5 细胞上清液谷氨酸浓度测定:提取细胞培养上清液,严格按照试剂盒说明书进行操作。
1.3 统计学处理 采用SPSS16.0软件统计学处理,所有数据使用均数±标准差表示,多组间比较用单因素方差分析,两两比较采用LSD-t检验。以P<0.05认为差异有统计学意义。
2 结果
2.1 各组大鼠脑皮质星形胶质细胞数比较 AQP4抗体阳性血清组星形胶质细胞较正常血清对照组明显减少(P<0.01);头孢曲松钠+AQP4抗体阳性血清组较AQP4抗体阳性血清组明显增加(P<0.01);而单纯头孢曲松钠组和正常血清对照组间比较无统计学差异(P>0.05)。结果见图1和表1。
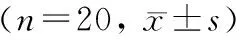
表 1 各组星形胶质细胞数目、谷氨酸浓度和GLT-1蛋白表达
注:GLT-1:谷氨酸转运体-1,图2同;A:正常血清对照组;B:AQP4抗体阳性血清组;C:头孢曲松钠+AQP4抗体阳性血清组;D:单纯头孢曲松钠组;与A组比较,#P<0.01;与B组比较,*P<0.01
2.2 星形胶质细胞GLT-1蛋白表达的变化 单纯头孢曲松钠组GLT-1表达较正常血清对照组明显增加,AQP4抗体阳性血清组GLT-1表达水平较对照组减少,头孢曲松钠+AQP4抗体阳性血清组较AQP4抗体阳性血清组GLT-1表达增加(均P<0.01)。结果见图2和表1。

1:正常血清对照组;2:单纯头孢曲松钠组;3:AQP4抗体阳性血清组;4:头孢曲松钠+AQP4抗体阳性血清组
图2 Western blotting检测各组大鼠脑皮质星形胶质细胞GLT-1蛋白的表达
2.3 细胞培养上清液中谷氨酸浓度变化 AQP4抗体阳性血清组谷氨酸浓度较正常血清对照组明显增高(P<0.01);头孢曲松钠+AQP4抗体阳性血清组组谷氨酸水平较AQP4抗体阳性血清组明显下降(P<0.01);而单纯头孢曲松组谷氨酸水平与正常血清对照组比较差异无统计学意义(P>0.05)。结果见表1。
3 讨论
谷氨酸是中枢神经系统最主要的神经兴奋性递质,谷氨酸内环境稳定不仅能维持中枢神经系统正常突触传递功能,而且能阻止谷氨酸对神经元以及胶质细胞的损害[7]。星形胶质细胞通过GLT-1转运90%细胞外谷氨酸[8],故星形胶质细胞膜上GLT-1在维持细胞外液谷氨酸内环境稳定中发挥主要作用。β-内酰胺抗生素头孢曲松钠能增加GLT-1的表达和活性[6],在缺血缺氧性脑病、急性脑卒中、肌萎缩侧索硬化等疾病模型中已经证实其通过上调GLT-1表达,减轻谷氨酸兴奋性毒性作用[9]。但其对AQP4抗体诱导的大鼠脑皮质星形胶质细胞损伤的影响尚未见报道。
本研究结果显示,头孢曲松钠能明显减轻AQP4抗体对星形胶质细胞的损害,而单独头孢曲松钠对星形胶质细胞数目并无影响,提示头孢曲松钠能减轻AQP4抗体血清对星形胶质细胞的毒性作用。利用免疫印迹法测定不同实验组的GLT-1的表达水平,结果发现单纯头孢曲松钠能上调GLT-1表达,AQP4抗体阳性血清可明显降低GLT-1表达,而给予头孢曲松钠能减轻AQP4抗体阳性血清诱导的GLT-1表达下调,提示其可能通过上调GLT-1表达发挥其保护作用。既往研究表明AQP4抗体并不引起星形胶质细胞GLT-1表达减少和谷氨酸摄取率下降,认为GLT-1表达减少是由于AQP4抗体导致的星形胶质细胞破坏和数目减少所致[4]。故本研究AQP4抗体阳性血清引起GLT-1下调,不能完全除外星形胶质细胞数目的影响因素。即使如此头孢曲松钠也能通过增加存活的星形胶质细胞GLT-1表达,减少AQP4抗体阳性血清引起的GLT-1下调。
该研究利用比色法测定不同实验组上清液谷氨酸浓度发现,AQP4抗体阳性血清组谷氨酸浓度明显高于对照组,头孢曲松钠预处理能明显减少AQP4抗体导致的谷氨酸浓度增加,提示AQP4抗体和星形胶质细胞AQP4结合破坏细胞外谷氨酸内环境的稳定性,导致细胞外谷氨酸浓度升高。头孢曲松钠通过上调星形胶质细胞GLT-1蛋白表达,增加其摄取谷氨酸,减少细胞外谷氨酸浓度,纠正AQP4抗体导致的细胞外液谷氨酸内环境紊乱。谷氨酸可以通过氧化应激机制导致星形胶质细胞的死亡[12],故推测头孢曲松钠通过增加星形胶质细胞GLT-1表达和谷氨酸摄取率,减少谷氨酸导致的氧化应激反应保护星形胶质细胞,减轻AQP4抗体对星形胶质细胞的损害。
综上所述,本研究表明在体外培养的大鼠大脑皮质神经细胞体系中,头孢曲松钠通过上调星形胶质细胞GLT-1表达,减少细胞外液谷氨酸浓度,减轻AQP4抗体对星形胶质细胞的毒性作用,也间接表明谷氨酸兴奋性毒性作用可能涉及NMO的发病机制。
[1]Kim W, Kim SH, Kim HJ. New insights into neuromyelitis optica[J]. J Clin Neurol, 2011,7(3):115-127.
[2]Hinson SR, Roemer SF, Lucchinetti CF, et al. Aquaporin-4-binding autoantibodies in patients with neuromyelitis optica impair glutamate transport by down-regulating EAAT2[J]. Exp Med,2008,205(11):2473-2481.
[3]Marignier R, Nicolle A, Watrin C, et al. Oligodendrocytes are damaged by neuromyelitis optica immunoglobulin G via astrocyte injury[J]. Brain, 2010,133(9):2578-2591.
[4]Ratelade J, Bennett JL, Verkman AS. Evidence against cellular internalization in vivo of NMO-IgG, aquaporin-4, and excitatory amino acid transporter 2 in neuromyelitis optica[J]. Biol Chem,2011,286(52):45156-45164.
[5]刘亚坤,张洁,任士卿. 水通道蛋白4抗体对体外培养大鼠皮层神经细胞的毒性作用[J].中华神经医学杂志,2012,11(7):663-666.
[6]Lee SG, Su ZZ, Emdad L, et al. Mechanism of ceftriaxone induction of excitatory amino acid transporter-2 expression and glutamate uptake in primary human astrocytes [J]. J Biol Chem, 2008, 283(19):13116-13123.
[7]Benarroch EE. Glutamate transporters: diversity, function, and involvement in neurologic disease[J]. Neurology,2010,74(3):259-264.
[8]Haugeto O, Ullensvang K, Levy LM, et al. Brain glutamate transporter proteins form homomultimers[J]. Biol Chem, 1996,271(44):27715-27722.
[9]Mimura K, Tomimatsu T, Minato K, et al. Ceftriaxone preconditioning confers neuroprotection in neonatal rats through glutamate transporter 1 upregulation[J].Reprod Sci,2011,18(12):1193-1201.
[10]Chen CJ, Liao SL, Kuo JS. Gliotoxic action of glutamate on cultured astrocytes[J].Neurochem,2000,75(4):1557-1565.
(本文编辑:时秋宽)
Ceftriaxone attenuates the cytotoxic effect of anti-aquaporin-4 antibody on astrocytes
LIYisha,RENYuteng,RENShiqing*.
*DepartmentofNeurology,ThirdHospitalofHebeiMedicalUniversity,ShijiazhuangHebei050051,China
REN Shiqing,Email:renshiq6666@163.com
Objective To observe the effects of ceftriaxone on toxicity of water channel protein-4 (aquaporin-4,AQP4) antibody to astrocytes and the possible mechanisms. Methods The routine methods were used to extract cortical cells from 1-day-old Sprague-Dawley rats, the cultured cerebral cortical cells were treated with healthy sera, AQP4 antibody positive sera, ceftriaxone + AQP4 antibody positive sera, ceftriaxone respectively. After 24 h cultivation, the number of astrocytes was observed by immunofluorescence staining. The glutamate concentration in the supernatants was measured by colorimetry, and the expression of glial glutamate transporter-1(GLT-1) was evaluated by western blot. Results The number of astrocytes and expression of GLT-1 in astrocytes were significantly decreased and the glutamate concentration was significantly increased in the AQP4 antibody positive group compared with the control group (P<0.01). Ceftriaxone increased the expression of GLT-1 (P<0.01), and did not change the number of astrocytes and the glutamate concentration comparing the ceftriaxone only group with the control group (P>0.05). The number of astrocytes and expression of GLT-1 in astrocytes were significantly increased and the glutamate concentration was significantly decreased in the ceftriaxone+AQP4 antibody positive group compared with the AQP4 antibody positive group (P<0.01). Conclusions Ceftriaxone could attenuates the cytotoxic effect of anti-aquaporin-4 antibody on cultured rat cortical astrocytes by upregulating the expression of GLT-1 in astrocytes and decreasing the glutamate concentration in the extracellular fluid.
neuromyelitis optica; aquaporin-4; ceftriaxone; glutamic acid; glial glutamate transporter-1; astrocytes
10.3969/j.issn.1006-2963.2015.03.003
056002邯郸第一医院神经内科(李义沙);050000 河北医科大学2010级本硕生(任玉腾);050051 河北医科大学第三医院神经内科(任士卿)
任士卿,Email:renshiq6666@163.com
R744.5+2
A
1006-2963 (2015)03-0162-04
2014-10-10)
