他汀类药物治疗多发性硬化的荟萃分析
2015-06-24付贺飞吴哲陈淑媛聂婉何志义
付贺飞 吴哲 陈淑媛 聂婉 何志义
他汀类药物治疗多发性硬化的荟萃分析
付贺飞 吴哲 陈淑媛 聂婉 何志义
目的 对他汀类降脂药应用于多发性硬化(MS)患者所获得的疗效及不良反应进行系统评价。方法 通过计算机检索PubMed、Cochran Library、Ovid、EMBASE、中国生物医学文献数据库(CBM)、中国期刊全文数据库(CNKI)、万方数据库,语种限制为中文和英文,时间均从数据库建库至2014-12,收集有关他汀类药物应用于MS患者治疗效果的随机对照实验研究,应用Cochran协作网推荐的“风险评估工具”对文献质量评估后应用Revman5.1软件对所提取文献资料进行荟萃分析。结果 共纳入6个研究合计包含557例复发缓解型MS(RRMS)患者,在应用β干扰素基础上联合应用他汀类药物治疗与单独应用同种β干扰素对照。荟萃分析结果显示,β干扰素联合他汀类药物组在降低患者的年复发率(WMD=-0.17,95%CI:-0.59~0.26,P=0.44)、出现病情复发或进展的患者数目 (RR=1.24,95%CI=0.93~1.65,P=0.14;RR=1.31,95%CI:0.73~2.36,P=0.36)、EDSS评分(WMD=-0.21,95%CI:-0.45~0.02,P=0.08),以及MRI新发T2病灶的患者人数(RR=1.41,95%CI:0.82~1.75,P=0.10)、新增T2或增强病灶数目(WMD=0.83,95%CI:-0.3~1.96,P=0.15;WMD=-0.25,95%CI:-0.65~0.14,P=0.21)等与同种β干扰素对照组比较差异均无统计学意义。在安全性方面,两组肌痛的发生率(RR=1.09,95%CI:0.48~2.50,P=0.17),疲劳的发生率(RR=1.06,95%CI:0.51~2.20,P=0.87)以及总的不良反应事件发生率(RR=1.08,95%CI:0.99~1.18,P=0.07) 差异均无统计学意义。结论 β干扰素联合他汀类药物治疗MS的疗效和安全性与单用同种β干扰素治疗无统计学差异。
多发性硬化;β干扰素;他汀类药物;荟萃分析
多发性硬化(multiple sclerosis,MS)是最常见的中枢神经系统白质脱髓鞘疾病,也是造成年轻患者慢性残疾的最常见病因之一[1]。目前研究认为MS是在遗传易感基因基础上受环境因素的触发,主要由T淋巴细胞介导的自身免疫性疾病并出现特征性的中枢神经系统炎性病灶。多数患者临床上表现为反复发生的神经功能障碍,发作缓解交替,病情逐渐进展加重,目前尚无完全治愈的办法[2]。体内及体外研究发现临床广泛使用的他汀类药物除了降脂、改善心脑血管疾病预后作用外,同时还具有抗炎、调节免疫、保护神经等多种作用[3-5]。有关MS的动物模型实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)的研究也发现口服他汀类药物能够抑制RhoA蛋白的表达,下调促炎反应的Th1细胞表达,调节Th1/Th2平衡,从而预防EAE的复发并改善EAE症状[6-7]。这些发现提示他汀类药物用于治疗MS可能使患者获益。基于此,近年一些评价他汀类药物对MS治疗效果及不良效应的临床试验也相继出现,但各研究结论并不完全一致,他汀类药物对MS的疗效特别是其与β干扰素合用的疗效仍存在诸多争议,因此本文对目前已经完成并发表的随机对照试验进行系统评价,期望为更多的相关研究及临床治疗MS提供参考。
1 材料和方法
1.1 纳入标准 (1)研究类型:随机对照临床试验;(2)研究对象:依照Poser标准或McDonald标准确诊的MS患者;(3)干预措施:他汀类药物作为附加治疗,与安慰剂对照或空白对照;(4)结局指标:①临床结局指标:随访期内患者的年复发率(annualized relapse rate,ARR),出现复发及病情进展的患者数目,扩展病残状态量表(expanded disability status scale,EDSS)评分[8]的变化。②MR相关的影像学结局指标:有新发T2病灶的患者数目、新T2WI病灶数目或新发T1钆增强病灶数目。③不良反应:包括肌痛、肌肉无力、疲劳等临床症状及血清转氨酶〔谷丙转氨酶(ALT)或谷草转氨酶(AST)〕升高≥3倍正常值上限、肌酸激酶(CK)升高≥10倍正常值上限;(5)文献语种为中文或英文。
1.2 排除标准 (1)回顾性研究、观察性研究等非随机对照试验;(2)研究对象为非临床患者,如EAE实验或体外试验等;(3)主要结局指标为免疫细胞、细胞因子、信号通路分子、抗原、抗体等指标者;(4)资料信息不完整,或尚未完成的试验。
1.3 文献检索策略 计算机检索PubMed、The Cochrane Library、Ovid、EMBASE、CBM、CNKI、万方中英文电子数据库,检索时间均从建库至2014-12,语种限制为中文及英文。英文检索词包括“multiple sclerosis”、“interferon beta”、“statins”;中文检索词包括“多发性硬化”、“干扰素”、“他汀”,根据不同数据库特点采用主题词检索与自由词检索结合的方式进行检索,同时采用文献追溯的方法保证查全。
1.4 文献提取及质量评价
1.4.1 文献的筛选:(1)由两名评价员独立阅读文献标题和摘要,剔除重复和明显不相关的研究报告,初步选择相关文献;(2)阅读可能相关的研究报告的全文,删除重复的、数据不完整的和结局指标与本研究目的不符的文献;(3)对有争议的文献资料通过和第三位研究者讨论解决,做出入选的最终决定。
1.4.2 文献质量评价:按照Cochrane Reviewer’s Handbook 5.0.0 偏倚风险评估标准对纳入随机对照试验的质量进行评价。评价内容包括:(1)随机方法是否正确;(2)是否采用盲法;(3)是否做到分配隐藏;(4)有无失访或退出,如有失访或退出时,是否采用意向治疗分析(ITT);(5)基线是否一致。所有质量标准均满足者(评价为“是”),发生偏倚的可能性最低,评为A级;如其中任何一条或多条质量评价标准仅部分满足(评价为“不清楚”),则该研究存在相应偏倚的可能性为中等,评为B级;如其中任何一条或多条完全不满足(评价为“否”),则该研究存在相应偏倚的高度可能性,评为C级。
1.5 统计学处理 采用Cochrane协作网提供的Revman5.1软件(http://ims.cochrane.org/revman)对所纳入文献进行荟萃分析。采用卡方检验对纳入文献进行统计学异质性分析,当各研究间无统计学异质性(P≥0.1,I2<50%)时,采用固定效应模型进行荟萃分析;如各研究间存在统计学异质性,分析其异质性来源,若2个研究组间存在统计学异质性但无临床异质性时(研究目的、患者类型、干预措施及终点指标无明显差异),采用随机效应模型进行荟萃分析。如两组间异质性过大(如试验设计和质量差异明显,患者类型或干预措施不一致及结局指标不统一无法合并)或无法找寻数据来源时,采用描述性分析。连续性变量用加权均数差(WMD)表示,非连续性变量用相对危险度(RR)表示,区间估计均采用 95%可信区间(95%CI)。以P<0.05 为差异有统计学意义。
2 结果
2.1 纳入文献特征 初始检索出182篇文献,排除不符合要求者,最终共6篇文献[9-14]符合全部纳入标准, 6篇文献的研究内容均为临床最常见的复发缓解型MS(relapsing-remitting multiple sclerosis,RRMS),其中4篇[9-10,13-14]试验观察了在应用β干扰素基础上加用阿托伐他汀的治疗效果,2个研究[11-12]观察了应用β干扰素附加辛伐他汀的治疗效果,β干扰素的种类分别为β干扰素1a和β干扰素1b,本文所纳入文献的方法质量评价结果见表1,基本资料情况见表2。
2.2 荟萃分析结果
2.2.1 年复发率:5个研究[10-14]报道了他汀类药物对MS患者年复发率的影响。各研究间存在统计学异质性(I2=79%;P<0.01),采用随机效应模型分析结果显示,他汀组和对照组差异无统计学意义(WMD=-0.17,95%CI:-0.59~0.26,P=0.44)。
2.2.2 复发的患者数目: 6个研究[9-14]均对MS的复发进行了定义,其中5个研究[9-11,13-14]将复发定义为“没有发热的情况下,出现新的或加重的神经缺损症状,并且至少持续24 h”,另一个研究[12]则将复发定义为“没有发热且至少有30 d的稳定期基础上出现了新的或加重的症状,并且持续超过48 h,或者EDSS评分增加超过0.5分,1个系统功能评分超过2分或2个系统功能评分超过1分”。对5个研究[9,10,12-14]中有复发风险的患者数据进行荟萃分析,各研究组间无统计学异质性(I2=0%;P=0.41),采用固定效应模型合并后分析,结果显示他汀组和对照组差异无统计学意义(RR=1.24,95%CI:0.93~1.65,P=0.14)。

表 1 所纳入研究的质量评价结果
注:ITT:意向治疗分析
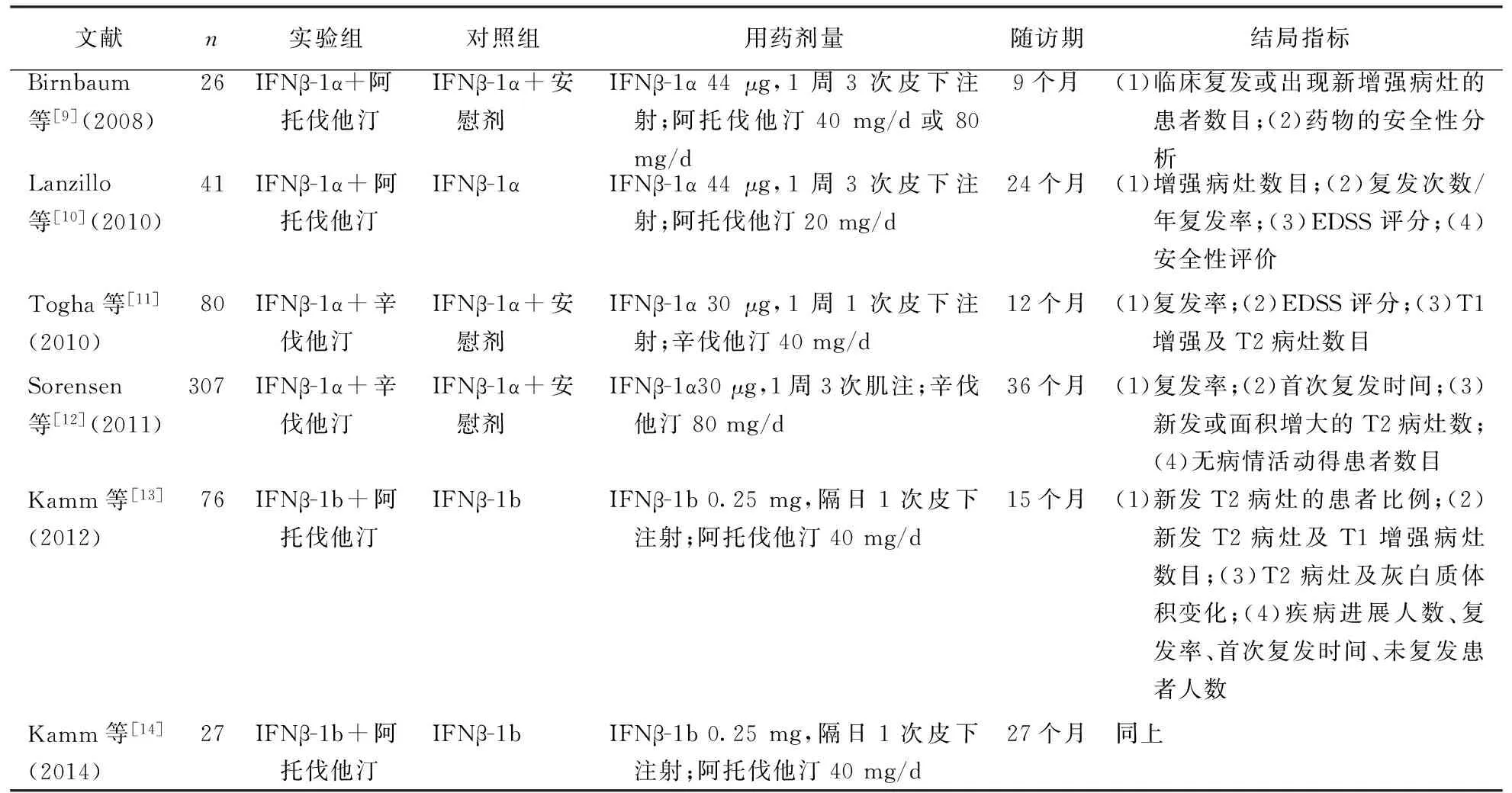
表 2 所纳入的RRMS研究基本信息
注: IFNβ:β干扰素;RRMS:复发缓解型多发性硬化;EDSS:扩展病残状态量表
2.2.3 病情进展的患者数目:有4个研究[9-12]定义并报告了随访期间出现病情进展的患者数目,其中3个研究[9-11]对病情进展定义为“持续的EDSS评分增加1分或1.5分以上”,Sorensen等[12]的研究则将进展定义为“MRI发现新病灶或临床复发”。各研究间无统计学异质性(I2=45%,P=0.16),采用固定效应模型对4个研究加权合并分析,他汀组和对照组病情进展的患者数目差异无统计学意义(RR=1.31,95%CI:0.73~2.36,P=0.36)。
2.2.4 EDSS评分:3个研究[10-12]报道了EDSS评分变化,包括1个阿托伐他汀研究[10]和2个辛伐他汀研究[11-12]。3个研究组间无统计学异质性(I2=45%;P=0.16),采用固定效应模型进行荟萃分析,结果示他汀组和对照组EDSS评分差异无统计学意义(WMD=-0.21,95%CI:-0.45~0.02,P=0.08)。
2.2.5 MRI相关结局指标的比较:其中3个[9,13-14]研究报道了随访期间患者颅脑MRI出现新T2病灶的情况。各研究组间无统计学异质性(I2=0%,P=0.43),加权分析后他汀组与对照组出现新T2病灶的患者数目差异无统计学意义(RR=1.41,95%CI:0.82~1.75,P=0.10)。Togha等[11]研究了辛伐他汀40 mg与对照组相比在T2病灶数目的差异,Kamm等[13-14]则在其主研究及扩展研究中比较了阿托伐他汀40 mg与对照组相比新发T2病灶数目的差异。忽略他汀的种类、随访期限的不同,采用固定效应模型进行合并分析(I2=32%,P=0.23),两组新发T2病灶数目差异无统计学意义(WMD=0.83,95%CI:-0.3~1.96,P=0.15)。3个研究[10-11,14]中他汀组与对照组比较,T1增强病灶数目差异均无统计学意义,进行合并加权分析,差异亦无统计学意义(WMD=-0.25,95%CI:-0.65~0.14,P=0.21)。
2.2.6 不良反应:纳入研究的6篇文献均对他汀治疗的不良反应进行了观察和统计,均没有报道与他汀相关的严重不良反应。3个研究[11-13]提供了可分析的数据,各研究间无统计学异质性(I2=43%,P=0.17),采用固定效应模型分析,结果显示他汀组与对照组肌痛的发生率(RR=1.09,95%CI:0.48~2.50,P=0.17)、疲劳的发生率(RR=1.06,95%CI:0.51~2.20,P=0.87)以及总的不良反应事件发生率(RR=1.08,95%CI:0.99~1.18,P=0.07)差异均无统计学意义。在因发生不良反应而终止治疗的患者数目方面,Birnbaum等[9]的研究中接受80 mg阿托伐他汀治疗组出现了1例因转氨酶升高和1例因肌痛及肌肉无力而终止治疗的患者,而安慰剂组也有1例患者因出现肌酸激酶升高而被终止治疗。
3 讨论
MS是T细胞介导的以中枢神经系统白质炎性脱髓鞘病变为主要特点的自身免疫性疾病,RRMS是其最常见的疾病类型。虽然过去的10余年MS的治疗取得了巨大进展,但目前应用于MS的一线及二线治疗药物如 β干扰素、醋酸格拉默等仍只对部分患者有效,且价格昂贵,给药方式不便利,促使人们寻找安全有效且应用方便的新药物。他汀类药物是3-羧甲基-戊二酰辅酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)抑制剂,除了能够通过抑制HMG-CoA还原酶阻碍L甲羟戊酸(MA)生成而降低血中胆固醇水平,他汀类药物还可干扰甲羟戊酸途径中类异戊二烯中间产物的合成,阻止RhoA、Ras等GTP结合蛋白的异戊二烯化,抑制淋巴细胞的活化、增殖、分化、抗原提呈等[1,3]。此外,他汀类药物还能够改变MS病灶中CD54等多种细胞间黏附分子的表达,干扰Th1细胞通路,起到免疫调节和抗炎作用[1,3,6]。目前有许多临床试验对他汀类药物作为β干扰素的附加治疗措施应用于MS的治疗效果进行了研究,但多数样本量较小,所得结论也不一致。基于此,本文作者全面检索并收集已发表的有关他汀类药物治疗MS效果的相关文献进行荟萃分析以进一步评价他汀类药物用于MS的疗效。
本研究纳入了目前已完成并发表研究结论的随机对照研究6个,分别观察了不同剂量的阿托伐他汀和辛伐他汀治疗RRMS的疗效和不良反应,其中2个研究[10-11]认为β干扰素联合他汀类药物治疗可以降低MS患者的年复发率,3个研究[12-14]认为β干扰素联合他汀类药物治疗对患者的年复发率、EDSS评分、MRI结果等无影响,另外1个研究[9]则认为β干扰素联合他汀类药物治疗反而加重了MS患者的临床病情或MRI结局,应用干扰素联合他汀类药物治疗出现病情恶化的发生机制可能为他汀类药物通过抑制STAT1的磷酸化影响了β干扰素信号通路,从而降低了β干扰素的作用效果并且增加了其不良反应[15]。对上述试验进行加权分析后显示,在应用β干扰素基础上加用他汀类药物治疗与仅应用β干扰素的对照组间患者的年复发率、复发患者数目、EDSS评分变化、MRI新发T2病灶的患者人数、MRI新T2或增强病灶数目等比较差异均无统计学意义。而且,他汀类药物的安全性良好,发生不良事件的次数与仅应用同种β干扰素的对照组比较差异亦无统计学意义。
综上,荟萃分析结果提示在β干扰素基础上联合应用他汀类药物并未改善RRMS患者的临床及影像结局,亦未增加患者的不良反应。然而本研究仍存在诸多不足:首先,仅有6个符合标准的研究被纳入,多数研究的样本量较小且随访时间较短。其次,他汀类药物及干扰素种类和剂量各不相同,研究质量参差不齐,有的研究随机方法不清楚,分配隐匿不明确,对照组未采用安慰剂等,由此可能产生选择、实施和结果测量偏倚,影响结果的论证强度。此外,由于纳入的研究数量有限,本研究未分析文献发表的偏倚。因此,不同种类和剂量的他汀类药物对MS的疗效尚需更多高质量的随机对照试验来证实。
[1]Neuhaus O, Hartung HP. Evaluation of atorvastatin and simvastatin for treatment of multiple sclerosis[J]. Expert Rev Neurother, 2007,7(5): 547-556.
[2]侯世芳,刘银红,许贤豪,等.多发性硬化诊断与治疗进展[J].中国现代神经疾病杂志, 2014,14(10):849-853.
[3]Sellner J, Greeve I, Findling O, et al. Effect of interferon-b and atorvastatin on Th1/Th2 cytokines in multiple sclerosis[J]. Neurochem Int, 2008, 53(1-2): 17-21.
[4]DeAngelis T, Lublin F. Neurotherapeutics in multiple sclerosis: Novel Agents and Emerging Treatment Strategies[J]. Mt Sinai J Med, 2008, 75(2): 157-167.
[5]Weber MS, Youssef S, Dunn SE, et al. Statins in the treatment of central nervous system autoimmune disease[J]. J Neuroimmunol, 2006, 178(1-2): 140-148.
[6]王捷,尉杰忠,郭敏芳,等. 他汀类药物对EAE小鼠RhoA表达的影响[J].中国神经免疫学和神经病学杂志, 2010, 17(2): 104-106.
[7]Paintlia AS, Paintlia MK, Khan M, et al. HMG-CoA reductase inhibitor augments survival and differentiation of oligodendrocyte progenitors in animal model of multiple sclerosis[J]. FASEB J, 2005, 19(11): 1407-1421.
[8]Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an Expanded Disability Status Scale (EDSS)[J]. Neurology,1983, 33(11): 1444-1452.
[9]Birnbaum G, Cree B, Altafullah I, et al. Combining beta interferon and atorvastatin may increase disease activity in multiple sclerosis[J]. Neurology, 2008, 71(18): 1390-1395.
[10]Lanzillo R, Orefice G, Quarantelli M, et al. Atorvastatin combined to interferon to verify the efficacy (ACTIVE) in relapsing-remitting active multiple sclerosis patients: a longitudinal controlled trial of combination therapy[J]. Mult Scler, 2010, 16(4): 450-454.
[11]Togha M, Karvigh SA, Nabavi M, et al. Simvastatin treatment in patients with relapsing-remitting multiple sclerosis receiving interferon beta 1a: a double blind randomized controlled trial[J]. Mult Scler, 2010, 16(7):848-854.
[12]Sorensen S,Lycke J,Eralinna J, et al. Simvastatin as add-on therapy to interferon beta-1a for relapsing-remitting multiple sclerosis (SIMCOMBIN study):a placebo-controlled randomised phase 4 trial[J]. Lancet Neurol, 2011, 10(8): 691-701.
[13]Kamm CP, El-Koussy M, Humpert S, et al. Atorvastatin added to interferon beta for relapsing multiple sclerosis: a randomized controlled trial[J]. J Neurol, 2012, 259(11):2401-2413.
[14]Kamm CP, El-Koussy M, Humpert S, et al. Atorvastatin added to interferon beta for relapsing multiple sclerosis: 12-month treatment extension of the randomized multicenter SWABIMS trial [J].PLoS One, 2014, 9(1):e86663.
[15]Sellner J, Weber MS, Vollmar P, et al. The combination of interferon-beta and HMG-CoA reductase inhibition in multiple sclerosis: enthusiasm lost too soon? [J]. CNS Neurosci Ther, 2010, 16(6):362-373.
(本文编辑:邹晨双)
Effects of statins in multiple sclerosis: A meta-analysis
FUHefei,WUZhe,CHENShuyuan,NIEWan,HEZhiyi*.
*DepartmentofNeurology,theFirstAffiliatedHospital,ChinaMedicalUniversity,ShenyangLiaoning110001,China
HE Zhiyi, Email:hezhiyi0301@sina.com
Objective To evaluate the efficacy and safety of statins used in patients with multiple sclerosis(MS). Methods PubMed, the Cochrane Library, Ovid,EMBASE, Chinese Bio-medicine Database, China National Knowledge Infrastructure and Wanfang Database were searched from the earliest possible data to the data of December 2014. Randomized controlled trials comparing statin-interferon combination therapy with interferon alone or with placebo in patients with MS were collected.The quality of the included trials were assessed by the authors according to the Cochrane Handbook for Systematic Reviews of Interventions Version. The Cochrane Collaboration’s RevMan 5.1 software was used for meta-analysis.Results Six randomized controlled trials involving 557 participants totally were included. In this meta-analysis, no significant difference was found between the stain and control groups in annual relapse rate(WMD=-0.17,95%CI:-0.59-0.26,P=0.44),the number of the participants who had relapses(RR=1.24,95%CI:0.93-1.65,P=0.14), disease progression (RR=1.31,95%CI:0.73-2.36,P=0.36),change of EDSS score(WMD=-0.21,95%CI:-0.45-0.02,P=0.08),or number of participants who developed new T2 lesions in MRI(RR=1.41,95%CI:0.82-1.75,P=0.10),number of new T2 lesions(WMD=0.83,95%CI:-0.3-1.96,P=0.15) or number of gadolinium-enhanced lesions(WMD=-0.25,95%CI:-0.65-0.14,P=0.21). The two groups showed no statistically significant difference in the incidence of muscle pain(RR=1.09,95%CI:0.48-2.50,P=0.17),fatigue(RR=1.06,95%CI:0.51-2.20,P=0.87) and total adverse events(RR=1.08,95%CI:0.99-1.18,P=0.07). Conclusions Statins in addition to beta interferon on MS compared with beta interferon monotherapy showed no significant difference in efficacy and safety.
multiple sclerosis;interferon-beta;statins;meta-analysis
10.3969/j.issn.1006-2963.2015.03.004
110001 中国医科大学附属第一医院神经内科(付贺飞、吴哲、聂婉、何志义);中国医科大学附属盛京医院神经功能科(陈淑媛)
何志义,Email:hezhiyi0301@sina.com
R744.5+1
A
1006-2963 (2015)03-0166-05
2014-09-05)
