丹参酮类化合物对髓系白血病的作用机制研究进展
2015-06-23王春森
向 洪,王春森,李 慧
(1.四川省医学科学院·四川省人民医院血液内科,四川 成都 610072;2.川北医学院,四川 南充 637000)
△通讯作者
丹参酮类化合物对髓系白血病的作用机制研究进展
向 洪1,2,王春森2△,李 慧2
(1.四川省医学科学院·四川省人民医院血液内科,四川 成都 610072;2.川北医学院,四川 南充 637000)
丹参是临床常用的活血化瘀药物之一,由于价格低廉、疗效确切,长期广泛应用于心血管系统疾病。丹参酮类化合物因其独特的化学结构,具有广泛的抗肿瘤作用,是目前研究的丹参的主要抗肿瘤活性成分。大量体内外实验证明,丹参酮类化合物对髓系白血病细胞有细胞毒作用。同时有报道认为丹参酮类化合物可以抑制JAK/STAT3信号通路,降低P-gp表达,逆转多耐药,抑制NF-κB的表达,有潜在的靶向治疗髓细胞白血病的作用。本文就丹参酮类常见化合物的结构、抗肿瘤的构效关系及丹参酮类化合物对髓系白血病的作用及其机制做一综述。
髓细胞白血病;丹参酮;作用
髓细胞白血病是一种异质性的恶性肿瘤,也是血液系统常见的疾病之一。髓系白血病(Myeloid leukemia)按自然病程及肿瘤细胞的成熟程度可以分为急性和慢性两大类。急性髓细胞白血病是成人白血病中最常见的类型之一,同时也是预后最差的白血病类型。其致死率高,约有半数以上的成年患者及90%的老年患者死于该病[1]。慢性髓细胞白血病占成人白血病的15%,随着酪氨酸激酶抑制剂的应用,其临床预后有显著的提高。但包括异基因骨髓移植在内的经典治疗手段都存在着副作用大、耐药、容易复发及老年患者不易耐受等问题,因此,髓细胞白血病的治疗仍面临着严峻的挑战。中药抗癌已有数百年的历史,临床常以单药或复方制剂应用于白血病的辅助治疗。与传统西医化疗药物相比,中医药具有延长或阻止白血病复发、预防及逆转白血病多耐药以及防治白血病治疗相关并发症等优势[2,3]。目前研究表明,中药及其提取物,如夹竹桃、野生甘菊、葛根素、当归多糖、半枝莲、苦参、蟾蜍、丹参酮、 鱼藤素、β-七叶皂苷等有抗白血病的作用。传统中医以“扶正祛邪”为原则治疗肿瘤疾病,常用活血化瘀药物祛邪。丹参为常用的活血化瘀药物,临床常用于心血管疾病,也用于肿瘤的辅助治疗。丹参酮作为丹参根部的乙醚或乙醇提取物,是丹参抗肿瘤的主要有效成分。近年来大量研究证实,丹参酮类化合物对急性髓细胞白血病细胞有抑制增殖与诱导分化、凋亡的作用[4~6]。同时有研究表明在肿瘤细胞内,丹参酮可以降低P-gp、NF-κB的表达[7,8]。以上研究证实丹参酮类化合物应用于髓细胞白血病,有潜在的抗白血病的临床价值。
1 丹参酮类化合物的结构及抗肿瘤作用的构效关系
丹参的活性成分分为脂溶性和水溶性两种,水溶性活性成分主要为酚酸类化合物,脂溶性的活性成分主要为二萜醌类化合物。二萜醌类化合物骨架上多具有三元或四元碳环的对醌或邻醌结构,统称为丹参酮类化合物。随着色谱和光谱技术的发展,丹参酮类化合物的分离和鉴定也有了长足的进展。目前,已分离出的丹参酮类化合物有数十种成分,主要有丹参酮Ⅰ、丹参酮ⅡA、次甲丹参酮ⅡA、丹参酮ⅡB、隐丹参酮、二氢丹参酮Ⅰ、羟基丹参酮ⅡA、丹参新酮等[9]。
丹参酮Ⅰ、丹参酮ⅡA、隐丹参酮、二氢丹参酮Ⅰ是丹参中最主要的丹参酮类化合物,其含量也较高,均为邻醌型的二萜醌类化合物[10]。这四种化合物均以1,2临醌为基本母核,结构差异表现为A环与C环的不同(图1)。其中二氢丹参酮Ⅰ与丹参酮Ⅰ的A环为芳环,丹参酮ⅡA与隐丹参酮的A环为脂环。二氢丹参酮Ⅰ与隐丹参酮的C环为二氢呋喃环,丹参酮Ⅰ与丹参酮ⅡA的C环为呋喃环。经研究发现,丹参酮类化合物的菲醌结构是其抗肿瘤的结构基础,但各种化合物因其A环与C环的结构差异,抗肿瘤的疗效不一。叶因涛等通过研究丹参酮类化合物对HeLa细胞、SPC-A-1细胞、NB4 细胞、K562细胞的生长抑制与构效关系证明:丹参酮Ⅰ、丹参酮ⅡA、隐丹参酮、二氢丹参酮Ⅰ均能有效抑制肿瘤细胞生长,但A环为芳环的化合物(二氢丹参酮Ⅰ与丹参酮Ⅰ)的细胞毒性作用优于A环为脂环的丹参酮类化合物(丹参酮ⅡA与隐丹参酮)。A环为芳环,可以使丹参酮类化合物的B环和C环的夹角减小,增强药物的细胞毒性作用。同时,认为二氢丹参酮Ⅰ的细胞毒性强于丹参酮Ⅰ,是由于两种化合物的C环结构差异,认为二氢呋喃环的毒性作用优于呋喃环。但是该结论却难以解释实验的另一结果,即C环为呋喃环的丹参酮ⅡA对肿瘤细胞的作用却优于C环为二氢呋喃环的隐丹参酮[11~14]。
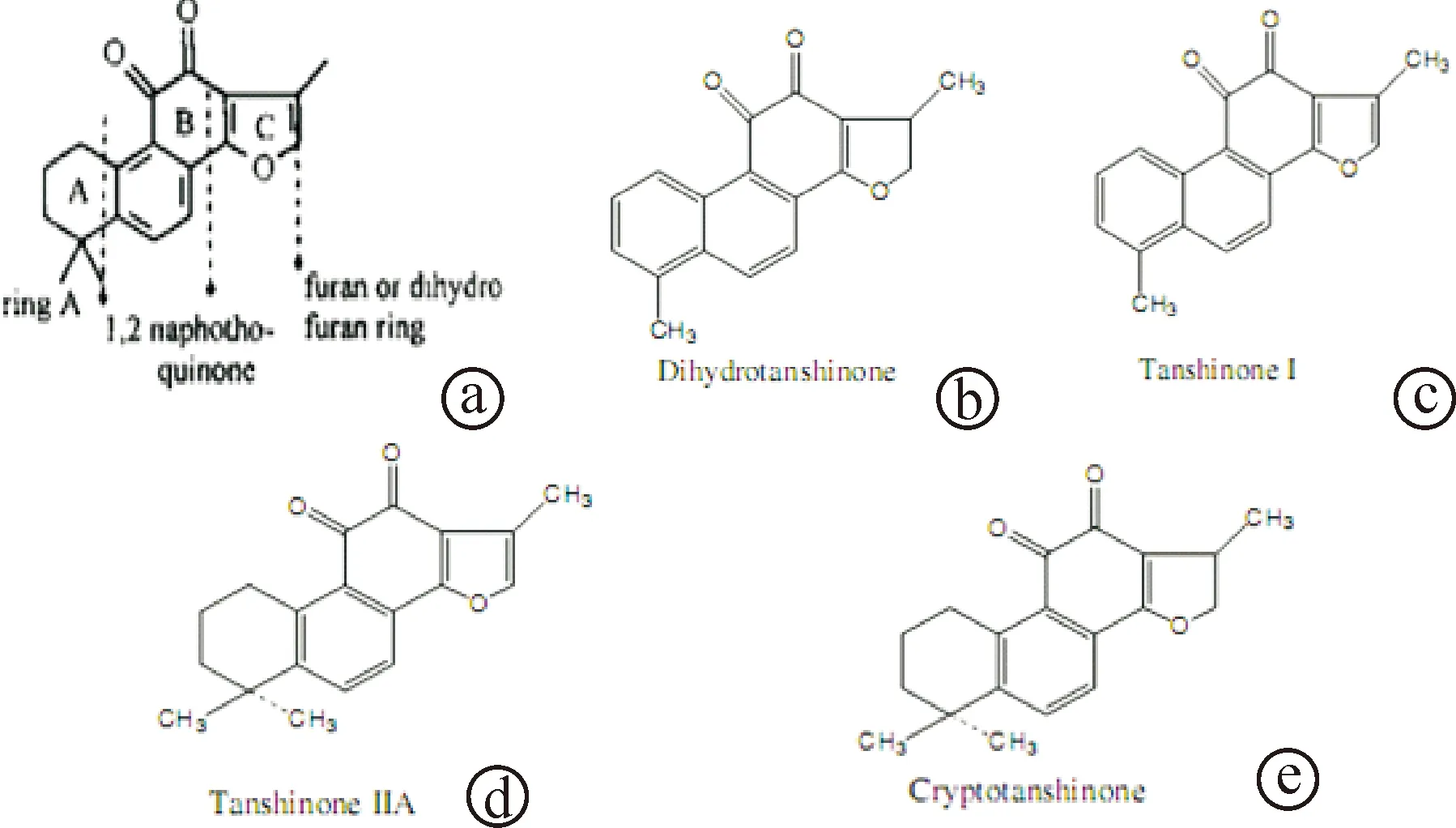
图1 丹参酮类化合物的结构 a:丹参酮类化合物的基本结构;b:二氢丹参酮Ⅰ;c:丹参酮Ⅰ;d:丹参酮ⅡA;e:隐丹参酮
2 丹参酮类化合物对髓系白血病的作用及其机制
目前,髓细胞白血病的临床治疗仍以联合化疗和干细胞移植为主。化疗存在副作用大,易耐药及早期复发等缺陷。因此,寻找高效低毒的治疗药物,是当前研究领域的热点。大量体外研究证实,丹参酮类化合物有抗神经胶质瘤、乳腺癌、黑色素瘤、肝癌、肺癌、结肠癌、宫颈癌等多种肿瘤细胞的作用。同时研究表明,丹参酮类化合物对血液系统恶性肿瘤的增殖抑制与诱导分化、凋亡作用尤其显著[15,16]。
2.1 抑制髓系白血病细胞增殖和DNA合成 丹参酮类化合物的菲环结构可以与DNA结合,发挥其抗肿瘤的作用。丹参酮类化合物的呋喃环、醌类结构可产生自由基,引起DNA损伤,导致DNA功能障碍,从而抑制DNA合成。通过抑制DNA合成,阻滞肿瘤细胞周期G1期进入S期,延长细胞周期,抑制肿瘤细胞的增殖作用。体外实验显示,人早幼粒细胞白血病(NB4)、维甲酸耐药的NB4(MR2)、红白血病(K562)细胞被丹参酮阻滞于G0/G1期,S期细胞减少[16]。
2.2 诱导肿瘤细胞凋亡 丹参酮类化合物作用于肿瘤细胞,可以激活信号通路,激活内切酶等效应分子,诱导肿瘤细胞凋亡。介导细胞凋亡的三大途径,分别为线粒体信号通路、死亡受体信号途径、内质网途径。它们介导的凋亡上游事件机制不尽相同,但分别通过激活Caspase-9、Caspase-8、Caspase-12,最终均引起凋亡的关键效应酶Caspase-3激活。正常情况下,Caspase-3 以无活性的酶原形式存在,广泛分布于各种不同类型的细胞中,其相对分子质量为32000,通过Asp-28-Ser29 和Asp175-Ser-176两个位点酶切后而激活。激活后的Caspases-3 相对分子质量为17000,可进一步激活Caspases 活化的核酸内切酶(CAD),活化的CAD可切割DNA,导致细胞发生凋亡。多数资料显示,药物或者某些生物活性因子都是通过激活Caspases 途径开始,最终产生诱导肿瘤细胞凋亡的作用[17]。实验证明,丹参酮ⅡA可以激活Caspases-3,诱导白血病细胞凋亡[18,19]。Li等对比单独或联合丹参酮ⅡA及三氧化二砷作用于维甲酸耐药的急性早幼粒细胞株的效果,发现丹参酮ⅡA与三氧化二砷对该细胞株的诱导凋亡作用有协同性。丹参酮ⅡA是通过激活Caspases-3、激活Caspases-8、上调肿瘤坏死因子-α的表达、释放细胞色素C,改变线粒体跨膜电位等作用机制诱导维甲酸耐药的急性早幼粒细胞株的凋亡[20]。葛宇清等对K562 细胞进行体外培养,采用不同浓度的隐丹参酮作用于K562 细胞[21]。该实验认为隐丹参酮可以增加Bax/Bcl-2蛋白的表达,下调线粒体膜电位,增加细胞膜通透性和释放到胞浆的Cyt C,激活促凋亡蛋白Caspase-3、Caspase-9 和PARP,诱导肿瘤细胞凋亡。
2.3 诱导肿瘤细胞分化 丹参酮可以诱导肿瘤细胞逆转,促使肿瘤细胞重新向正常成熟的方向分化。丹参酮ⅡA可以通过调控分化等多种相关基因,诱导白血病细胞分化[22]。梁勇等选用临床初治、复发及维甲酸耐药的急性早幼粒细胞白血病患者的原代细胞进行培养,对丹参酮ⅡA与维甲酸的作用进行对比[23]。体外实验结果表明,对初治、复发病例、ATRA继发耐药的病例的原代细胞,丹参酮ⅡA均有诱导细胞分化的作用。Kaiji等采用0、0.1、1.0和10 mg/L 四个不同浓度的丹参酮ⅡA作用于NB4细胞株,48 h后采用逆转录——聚合酶链反应和Western blot法检测各组细胞CHOP蛋白(CAAT增强子结合蛋白同源蛋白)表达水平[6]。丹参酮ⅡA浓度为10 mg/L时,CHOP蛋白表达水平下调,NB4细胞出现显著分化。因此,认为CHOP在丹参酮ⅡA作用NB4细胞过程中起着负向调节作用。流式细胞术检测结果表明单纯抑制CHOP的表达不能明显增强凋亡效应,联合10 mg/L Tan 1I A进行干预,则出现显著的凋亡作用,并显示了良好的细胞分化作用。
2.4 影响JAK/STAT通路 JAK家族是一组受体相关蛋白酪氨酸激酶,是细胞因子受体的细胞内信号效应器,其家族成员有JAK1、JAK2、JAK3和酪氨酸激酶2(TYK2)。JAK的异常激活或失活,在炎症、免疫性疾病以及恶性肿瘤的发生起着重要的作用[24]。STAT蛋白是JAK的重要底物之一,是一种细胞质内的转录因子。STAT蛋白可以进入细胞核,刺激生长因子和细胞因子,诱导相应的基因转录。STAT蛋白异常可以激活癌症细胞周期,导致细胞生存和衰老调节异常,在癌症细胞的生物活动里起着重要的作用[25]。JAK/STAT信号转导调节基因的产物可以参与各种细胞生物过程,如细胞的增殖、分化、凋亡、炎症等。白血病细胞的JAK/STAT信号通路异常激活,白血病患者体内JAK/STAT信号通路也异常活化,JAK/STAT信号通路可能成为白血病治疗的潜在靶点[26,27]。Ji等分别采用丹参酮IIA与隐丹参酮作用于K562细胞株(慢性髓细胞白血病细胞株),进行体外实验研究,探讨丹参酮IIA与隐丹参酮对K562细胞株的JAK/STAT信号通路的影响[28]。研究发现丹参酮IIA与隐丹参酮均对细胞有增殖抑制作用,其增殖抑制作用与药物剂量有依赖性。实验结果发现药物IC50值约为20 μmol/l,药物细胞毒性作用无显著差异。通过Western blot和凝胶电泳分析认为丹参酮IIA抑制STAT5细胞通路,不抑制STAT3通路。丹参酮IIA导致JAK2的去磷酸化,但是对JAK1无作用。与丹参酮IIA不同,隐丹参酮抑制STAT3细胞通路,不抑制STAT5通路。JAK2是在细胞中STAT3或STAT5的上游激酶,隐丹参酮也可以抑制JAK2磷酸化。
2.5 具有逆转多耐药(multidrug resistance,MDR)作用 MDR是肿瘤化疗失败的主要因素之一,最常见的机制是一种分子量为170kd的跨膜蛋白在肿瘤细胞中过度表达。这种跨膜蛋白由1280个氨基酸残基组成,依赖ATP水解提供的能量,将药物从细胞内转运至细胞外,降低细胞内化疗药物的浓度。P-gp少量表达于许多正常人体组织中,在很多恶性肿瘤细胞高表达。P-gp也被证实高表达于白血病,但在各个亚型表达不一,表达高者预后较差[29]。丹参酮可以显著降低P-gp的表达,逆转MDR[30]。Li等采用10 mg/ml 、20 mg/ml的丹参酮IIA单独或联合三氧化二砷作用于耐维甲酸的NB4细胞株[31]。实验发现三氧化二砷联合使用丹参酮IIA组对细胞的抑制率显著高于单独使用三氧化二砷组,丹参酮IIA可以降低耐维甲酸的NB4细胞株的P-gp表达。作者认为丹参酮IIA与三氧化二砷诱导耐维甲酸的NB4细胞株凋亡有协同作用,同时可以降低P-gp的表达。
2.6 可能存在靶向治疗白血病干细胞作用 目前认为由于髓细胞白血病干细胞的存在,维持着髓系白血病的生长、复发、耐药。由于95%的干细胞处于G0休眠期,细胞周期特异性化疗药物作用于白血病干细胞(LSC)效果较差,导致联合化疗时耐药及复发[32]。因此,靶向治疗髓细胞白血病干细胞是治疗髓细胞白血病的根本。Guzman等认为,与造血干细胞(HSC)不同,在LSC中转录因子NF-κB持续激活[33]。NF-κB异常活跃于各种恶性血液病,可以抗凋亡,促进肿瘤细胞增殖。白血病干细胞中NF-κB因子持续激活,因此,NF-κB可能是一个潜在的白血病干细胞靶向治疗的靶点[34]。有资料报道,NF-κB的药物抑制剂治疗可以有效地治疗白血病[35]。Su等报道,丹参酮IIA可以抑制NF-κB的表达[36]。
3 展望
综上所述,丹参酮类化合物应用于髓细胞白血病,可以抑制髓系白血病细胞增殖和DNA合成、引起凋亡的关键效应酶Caspase-3激活、诱导白血病细胞分化、抑制JAK/STAT信号通路、降低P-gp的表达、抑制NF-κB的表达等作用。这些作用证明酮类化合物可以同时靶向治疗白血病细胞和白血病干细胞,逆转多耐药,有潜在的临床价值。同时与传统经典化疗药物相比,具有副作用小的优势。若能对丹参酮类化合物针对急性髓细胞白血病的作用进行系列的体外研究,同时证实其在临床也具有抗肿瘤、抗肿瘤干细胞、逆转MDR活性作用,将获益于髓细胞白血病患者。
[1] Ferrara F,Schiffer CA.Acute myeloid leukaemia in adults[J].Lancet,2013,381(9865):484-495.
[2] 付亚玲,陈涛.中医药治疗白血病的研究现状[J].中西医结合学报,6(8):867-872.
[3] 黄衍强.治疗白血病中药不是“预备役”[J].家庭中医药,2006,10(1):24-25.
[4] 李慧,张晋琳,王晓冬,等.丹参酮ⅡA乳剂对NB4 细胞的诱导分化与凋亡作用[J].实用医院临床杂志,2011,8(4):43-45.
[5] Jia-Jun L,Wen-Da L,Hong-Zhi Y,et al.Inactivation of PI3k/Akt signaling pathway and activation of caspase-3 are involved in tanshinone I-induced apoptosis in myeloid leukemia cells in vitro[J].Ann Hematol,2010,9(11):1089-1097.
[6] Kaiji Z,Jian L,Wentong M,et al.C/EBPb and CHOP participate in Tanshinone IIA-induced differentiation and apoptosis of acute promyelocytic leukemia cells in vitro[J].International Journal of Hematology,2010,92:571-578.
[7] Su CC,Chien SY,Kuo SJ,et al.Tanshinone IIA inhibits human breast cancer MDA-MB-231 cells by decreasing LC3-Ⅱ,Erb-B2 and NF-kappaBp65[J].Molecular medicine reports,2012,5:1019-1022.
[8] 何欣,曾柏荣,刘华,等.丹参酮ⅡA对小鼠S180肿瘤获得性多药耐药及P-gp、LRP的影响[J].湖南中医药大学学报,2010,7(1):16-19.
[9] 覃江克.丹参酮类化合物的分离及化学转化研究[D].中山大学,2005.
[10]蓝天凤.丹参中丹参酮类成分及其含量测定方法研究[D].山东中医药大学,2011.
[11]叶因涛,杨福军,徐文清.丹参酮化合物对HeLa细胞抑制作用与构效关系探讨[J].医药导报,2009,28(10):1261-1264.
[12]李慧,张青,石华月,等.丹参酮类化合物对K562细胞的生长抑制作用及其构效关系探讨[J].中国实验血液学杂志,2010,18(6):1469-1473.
[13]石华月,张青,李慧,等.丹参酮类化合物对SPC-A-1细胞的生长抑制及其构效关系探讨[J].中国肺癌杂志,2011,14(1):7-12.
[14]傅慧敏,储婷,李慧,等.丹参酮类化合物对NB4 细胞的增殖抑制与构效关系探讨[J].华西药学杂志,2012,27(3)∶253-256.
[15]Liu JJ,Lin DJ,Liu PQ.Induction of apoptosis and inhibition of cell adhesive and invasive effects by tanshinone ⅡA in acute promyelocytic leukemia cells in vitro[J].J Biomed Sci,2006,13:813-823.
[16]袁淑兰,宋毅,王修杰,等.丹参酮ⅡA抑制多种肿瘤细胞生长的体外实验研究[J].华西药学杂志,2003,18(5):327-329.
[17]Schimmer AD.Induction of apoptosis in lymphoid and myeloid leukemia[J].Curr Oncol Rep,2006,8(6):430-436.
[18]Hyun JS,Sun MC,Yoosik Y,et al.Tanshinone IIA,an ingredient of Salvia miltiorrhiza BUNGE,induces apoptosis in human leukemia cell lines through theactivation of caspase-3[J].Exp Mol Med,1999,31(4):174-178.
[19]Jiajun L,Yong Z,Dongjun L,et al.Tanshinone IIA inhibits leukemia THP-1cell growth by induction of apoptosis[J].Oncology Reports,2009,21(4):1075-1081.
[20]Li J,Zhang K,Meng W,et al.Tanshinone IIA in acute promyelocytic leukemia[J].Am J Med Sci,2012,344(4):283-288.
[21]葛宇清,杨波,程汝滨,等.隐丹参酮对K562 细胞凋亡的影响及其机制[J].中草药,2013,44(22):3188-3194.
[22]杜睿,郑鸿,王艳萍,等.丹参酮ⅡA诱导白血病NB4细胞分化分子机制研究[J].中国中药杂志,2008,33(24):2954-2957.
[23]梁勇,井丽萍.丹参酮l A 对初治、复发及耐药人急性早幼粒细胞白血病细胞体外诱导分化作用[J].中华血液学杂志,2006,27(l):62-63.
[24]Babon JJ,Lucet IS,Murphy JM,et al.The molecular regulation of Janus kinase(JAK)activation[J].Biochem J,2014,462(1):1-13.
[25]Jonchère B1,Bélanger A,Guette C,et al.STAT3 as a new autophagy regulator[J].JAKSTAT,2013,2(3):e24353
[26]Yamada O,Kawauchi K.The role of the JAK-STAT Pathway and related signal cascades in telomerase activationduring the development of hematologic malignancies[J].JAKSTAT,2013,2(4):e25256.
[27]谌登兵.血病细胞JAKPSTAT 途径异常激活[J].国外医学生理、病理科学与临床分册,2002,22(6):568-570.
[28]Ji HJ,Tae-Rin K,Soo-Jin J.Apoptosis Induced by Tanshinone IIA and Cryptotanshinone Is Mediated by Distinct JAK/STAT3/5 and SHP1/2 Signaling in Chronic Myeloid Leukemia K562 Cells[J].Evid Based Complement Alternat Med,2013,2013:805639.
[29]丁江华,张荣艳,彭燕,等.急性白血病P-gp和Bcl-2表达与临床意义[J].江西医学院学报,2003,43(5):51-54.
[30]刘长剑,刘建国,于铁成,等.微乳丹参酮逆转肿瘤多药耐药的作用[J].吉林大学学报,2007,33(2):293-296.
[31]Li J,Zhang K,Meng W,et al.Tanshinone IIA in acute promyelocytic leukemia[J].Am J Med Sci,2012,344(4):283-288.
[32] 牛新清,佘妙容,李 强.急性髓系白血病细胞系中白血病干细胞样亚群的分离和鉴定[J].中国免疫学杂志,2009,25(11):1048-1049.
[33] Guzman ML,Neering SJ,Upchurch D,et al.Nuclear factor-kappaB is constitutively activated in primitive human acute myelogenous leukemia cells[J].Blood,2001,98:2301-2307.
[34] Monica LG,Craig TJ.Feverfew:weeding out the root of leukaemia[J].Expert Opin Biol Ther,2005,5:1147-1152.
[35] Griessinger E,Imbert V,Lagadec P,et al.AS602868,a dual inhibitor of IKK2 and FLT3 to target AML cells[J].Leukemia,2007,21:877-885.
[36] Su CC,Chien SY,Kuo SJ,et al.Tanshinone IIA inhibits human breast cancer MDA-MB-231 cells by decreasing LC3-Ⅱ,Erb-B2 and NF-kappaBp65[J].Molecular medicine reports,2012,5:1019-1022.
Progress of tanshinones on myeloid leukemia
XIANG Hong1,2,WANG Chun-sen2,LI Hui2
R557
B
1672-6170(2015)01-0165-04
2014-07-24;
2014-11-20)
