白介素—33、白介素—37在鼻息肉组织中的表达及意义
2015-06-17薛军芳柴向斌
薛军芳++++++柴向斌
[摘要] 目的 探讨白介素-33(IL-33)、白介素-37(IL-37)在鼻息肉中的表达及其在鼻息肉中发挥的作用。 方法40例鼻息肉患者的鼻息肉组织及18例鼻中隔偏曲患者的正常鼻黏膜组织为本次研究对象,用免疫组织化学方法分别检测其中IL-33及IL-37的表达情况。 结果 鼻息肉组IL-33阳性率为65.0%,IL-37阳性率为20.0%。正常鼻黏膜组中IL-33阳性率为33.3%,IL-37阳性率为77.8%。 结论 IL-33、IL37与鼻息肉发病密切相关。
[关键词] 鼻息肉;白介素-33;白介素-37;免疫组织化学
[中图分类号] R765.25 [文献标识码] A [文章编号] 1673-9701(2015)12-0009-03
Expression of IL-33,IL-37 in human nasal polyps and clinical significance
XUE Junfang CHAI Xiangbin
Department of Otolaryngology Head and Neck Surgery,First Clinical Medical College of Shanxi Medical University,Taiyuan 030001,China
[Abstract] Objective To investigate the expression of IL-33,IL-37 in nasal polyps tissue,and their relevance to the pathogenesis of human nasal polyps. Methods Immunohistochemistry was used to detect the expression of IL-33,IL-37, in excisional nasal polyps tissue from 40 patients with nasal polyps. In addition,the expression of IL-33,IL-37 was also detected in normal nasal mucosa from 18 patients with the nasal septum deviation. Results In the nasal polyps tissues,IL-33 positive rate was 65.0%,IL-37 positive rate was 20.0%.In the normal nasal mucosa, IL-33 positive rate was 33.3%,IL-37 positive rate was 77.8%. Conclusion IL-33 and IL-37 play an important role in the pathogenesis of nasal polyps.
[Key words] Nasal polyps; IL-33; IL-37; Immunohistochemical
鼻息肉为鼻科常见病,发病率较高,为感染、非感染性炎症,解剖异常、免疫异常、遗传因素等多致病因素导致的疾病实体,其发病机制尚不明确。近来研究表明,许多细胞因子在鼻息肉的发生发展中起重要的作用。IL-33、IL-37为新近发现的隶属于IL-1家族的新型细胞因子,与许多炎症性疾病及免疫性疾病密切相关。本研究应用免疫组织化学方法检测鼻息肉组织及正常鼻黏膜组织中IL-33、IL-37的表达情况,探讨此两种细胞因子在鼻息肉发生中的作用。
1 材料与方法
1.1 材料来源
所取标本均来自2013年10月~ 2014年9月我院住院鼻息肉患者手术标本及鼻中隔偏曲患者正常鼻黏膜标本。所有患者取材前1周内均未使用过任何激素类药物。所有鼻息肉患者术前均已经过鼻窦CT、鼻内窥镜的确认,术后所有鼻息肉组织均经病理证实。其中男20例,女20例;年龄15~67岁。另取18例鼻中隔偏曲患者手术时的中鼻甲头端距上缘3~5 mm 处、2 mm×2 mm大小的黏膜组织作为对照组,其中男 12例,女6例,年龄18~49岁,各组患者均无过敏性鼻炎及其他疾病史。鼻息肉组和正常黏膜组性别、年龄比较均无明显差异(P>0.05),具有可比性。
1.2试剂与检测方法
两组标本以10%的福尔马林固定 24~48 h,常规石蜡包埋。4 μm 厚切片,兔抗人白介素-33抗体(博奥森,北京)工作浓度为 1∶100,兔抗人白介素-37抗体(博奥森,北京)工作浓度为 1∶200。免疫组化染色试剂盒(博奥森,北京)包括:3%H2O2去离子水、封闭用正常山羊血清工作液、生物素二抗工作液、辣根酶标记链霉链霉卵白素工作液。DAB显色,苏木素衬染,封片,显微镜观察。
1.3结果判断
IL-33主要表达于上皮细胞和血管内皮细胞的胞核[1],胞浆也有少量表达,IL-37主要表达于炎症细胞、上皮细胞的胞浆[2],胞核也有少量表达,以上两种因子均以胞核及胞浆中出现棕黄色至深棕黄色颗粒为阳性,分析5 个不同视野染色细胞百分数并计算,阳性表达细胞数在0~25%为“+”,26%~50%为“++”,≥51%为“+++”。
1.4统计学处理
所有数据采用 SPSS17.0 统计学软件处理,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2结果
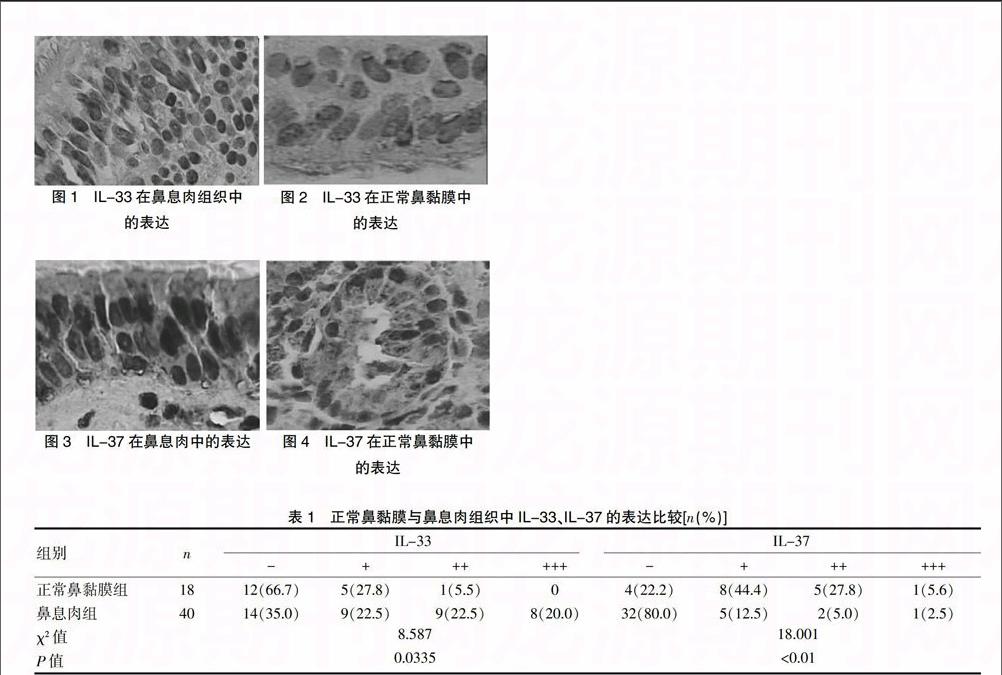
IL-33主要表达于细胞核中,在细胞浆中也有少量表达,呈棕黄色和深棕黄色(图 1、2)。18 例正常鼻黏膜组 6例为阳性(+),阳性表达率为 33.3%,其中5 例为弱阳性(+),1 例为中度阳性(++)。40 例鼻息肉组26 例阳性,阳性表达率为65%,其中 9 例为弱阳性(+),9 例为中度阳性(++),8例为强阳性(+++)。两组差异具有统计学意义(P<0.05)。见表 1。
IL-37主要表达于细胞浆中,呈棕黄色和深棕黄色(图3、4)。18 例正常鼻黏膜组14例为阳性(+),阳性表达率为 77.8%,其中8例弱阳性(+),5 例为中度阳性(++),1例强阳性(+++)。40 例鼻息肉组8例阳性,阳性表达率为20.0%,其中 5 例弱阳性(+),2 例中度阳性(++),1例强阳性(+++)。两组差异具有统计学意义(P<0.01)。见表1。
3 讨论
鼻息肉作为一种多因素致病的炎症性疾病,其发病机制一直没有统一的认识。目前发现多种细胞因子对鼻息肉的发生有一定作用[3]。近些年来的研究显示,在鼻腔外侧壁有一个不稳定的组织微环境,在某些诱导因子的作用下,能产生、分泌许多不同类型的细胞因子。这些细胞因子不仅可以使血管内皮细胞、上皮细胞、腺细胞和基质细胞增殖,而且可以激活某些细胞和细胞外基质,引起嗜酸性粒细胞、肥大细胞等多种炎性细胞释放大量炎性介质,导致局部病理改变,最终形成息肉。此次研究表明鼻息肉组织较正常鼻腔黏膜组织中的IL-33表达增高,IL-37表达降低,提示这些因素参与了鼻息肉的发病过程。
白介素-33(IL-33)是2005年发现的一个多功能、风湿性关节炎因子,属于IL-1家族新成员[4],它的分子量约18kD,含有270个氨基酸[5]。IL-33常表达于屏障组织细胞,如皮肤、肠、肺等,当这些细胞发生损伤时,全长IL-331-270在胞外可经中性粒细胞丝氨酸蛋白酶、组织蛋白酶G和弹性蛋白酶酶切,产生3种活性形式,分别是IL-3395-270、IL-3399-270和IL-33109-270[6]。由于IL-33的特殊结构,它具有核因子和细胞因子两个功能,能激活肥大细胞、淋巴细胞和嗜酸性粒细胞产生Th2类细胞因子,在炎症、感染、自身免疫性疾病中发挥着十分重要的作用。经研究发现,IL-33具有核因子和细胞因子的双重功能[7],作为细胞因子它可以参与调节Th2免疫反应,作为核因子可以定位于细胞核内起转录抑制作用[8]。IL-33作为一种细胞因子,是在细胞发生损伤时分泌,其促进炎症发生的生物学活性是由细胞坏死引起的[9]。它可以作为一种危险信号从细胞中释放,激活肥大细胞和嗜酸或嗜碱性粒细胞等多种炎性细胞释放炎性介质,并促进幼稚T细胞向Th2细胞转化,趋化Th2细胞达到病灶,发挥促炎作用[10]。IL-33的信号传导通路与典型的Th2类细胞因子的传导通路不同,IL-33是通过与细胞胞膜上的IL-1受体相关蛋白ST2及IL-1受体辅助蛋白组成的异二聚体将信号转导至细胞内,募集下游的信号分子,来调节 IL-4、IL-5、IL-13等Th2型细胞因子的转录和随后的生物学活性[11],并且具有前炎症因子的作用[12]。在对哮喘的研究中发现,在急性本实验中研究发现鼻息肉组织中白介素-33的表达较正常鼻黏膜高,IL-33可能在鼻息肉的发病过程中发挥促进作用。
IL-37是Kumar等[13]在2000年发现的一种白介素-1家族新成员。人类IL-37基因存在于2号染色体上,结构与IL-1家族相似,可分为5个亚型IL-37a-e,分子量是17-24kD[14-17]。它与其他IL-1家族成员不同,它是一种天然的免疫应答抑制物,并且可以抑制促炎症因子的产生[2],在炎症性疾病中发挥抑制作用[18]。已经有研究证实,IL-37可以与IL-18Rα链非竞争性的形成复合体,从而抑制了NF-κB 和 MAPK 等途径,使得IFN-γ的合成下调,对TLR 后信号传导和 DC 细胞活性产生抑制作用,但对IL-18本身的活性却无影响[15],并且成熟的 IL-37 还可以进入细胞核与 Smad3 结合,形成复合体,通过调节基因转录来抑制促炎因子的产生[2]。在本实验中,我们发现鼻息肉组织中IL-37的表达水平较正常鼻黏膜中的低,表明IL-37可能在鼻息肉的发病过程中起抑制作用。
综上所述,此次试验应用免疫组织化学技术在细胞学的水平上依次对IL-33及IL-37在鼻息肉及正常鼻黏膜中的表达进行了定性研究。结果显示,IL-33在鼻息肉组织中的阳性表达明显高于正常鼻黏膜,IL-37在鼻息肉组织中的阳性表达明显低于正常鼻黏膜,差异均具有统计学意义(P<0.05)。说明鼻息肉的发病过程可能与IL-33、IL-37密切相关,IL-33可能在鼻息肉的发病中发挥促进作用,而IL-37则可能发挥抑制作用。因此,本实验为临床靶向治疗鼻息肉提供用药指导,为预防鼻息肉的复发提供新理论依据。
[参考文献]
[1] Baekkevold ES,Roussigné M,Yamanaka T,et al. Molecular characterization of NF-HEV,a nuclear factor preferentially expressed in human high endothelial venules[J]. Am J Pathol,2003,163(1):69-79.
[2] Sharma Sheetal,Kulk Nicole,Nold Marcel F,et al. The IL-1 family member 7b translocates to the nucleus and down-regulates proinflam-matory cytokines[J]. J Immunol,2008,8:5477-5482.
[3] Kountakis SE,Arango P,Bradley D,et al. Molecular and cellular staging for the severity of chronic rhinosinusitis[J].Laryngoscope, 2004,114(11):1895,1905.
[4] Carriere V,Roussel L,Ortega N,et al. IL-33,the IL-1-like cytokine ligand for ST2 receptor,is a chromatin-associated nuclear factor in vivo[J]. Proc Natl Acad Sic usa,2007,104(1):282-287.
[5] Schmitz J,Owyang A,Oldham E,et al. IL-33,an intefleukin-1- like cytokine that signals via the IL-I receptor-related protein ST2 and induces T helper type 2-associated cytokines[J]. Immunity,2005,23(5):479-490.
[6] Lefrancais E,Roga S,Gautier V,et al. IL-33 is processed into mature bioactive forms by neutrophil elastase and cathepsin G[J]. Pro Natl Acad Sci USA,2012,109(5):1673-1678.
[7] Roussel L,Eard M,Cayrol C,et al. Molecular mimicry between IL-33 and KSHV for attachment to chromatin through the H2A-H2B acidic poket[J]. Embo Rep,2008, 9(10):1006-1012.
[8] Carriere V,Roussel L,Ortega N,et al. IL-33,the IL-1-like cytokine ligand for ST2 receptor,is a chromatin-associated nuclear factor in vivo[J]. Proc Natl Acad Sci USA,2007,104:282-287.
[9] Weldy V,Bonilla,Anja Frhlich,et al. The alarmin interleukin-33 drives protective antiviral CD8+ T cell responses[J]. Science,2012,335(6071):984-989.
[10] Kobori A,Yagi Y,Imaeda H,et al. Interleukin-33 expression is specifically enhanced in inflamed mucosa of ulcerative colitis[J]. J Gastroenterol,2010,45(10):999-1007.
[11] Borish L.Steinke JW. Intedeukin-33 in asthma:how big of a role does it play?[J]. Curr Allergy Astluna Rep,2011,11(1):7-11.
[12] Likura M,Suto H,Kajiwara N,et al. IL-33 can promote survival,adhesion andcytokine production in human mast cells[J]. Lab Invest,2007,87:971-978.
[13] Kumar S,McDonnell PC,Lehr R,et al. Identification and initial characterizationof four novel members of the interl-eukin-1 family[J]. J Biol Chem,2000,275:10308-10314.
[14] Wong CK,Cheung PF,Ip WK,et al. Interleukin-25 induced chemokines and interleukin-6 release from eosinophils is mediated by p38[J]. Genomics,2000,66(2):213-216.
[15] Taylor SL,Renshaw BR,Garka KE,et al. Genomic Organization of the Interleukin-1Locus[J]. Genomics,2002, 79(5):726-733.
[16] Smith VP,Alcami A. Expression of secreted cytokine and chemokine inhibitors by ectromelia virus[J]. Virol,2000,74(18): 8460-8471.
[17] Kumar S,Hanning CR,Brigham-Burke MR,et al. Interleukin-1F7B (IL-IH4/IL-IF7)is processed by caspase-1 and mature IL-1F7B binds to the IL-18 receptor but does not induce IFN-gamma production[J]. Cytokine,2002,18(2):61-71.
[18] Boraschi D,Lucchesi D,Hainzl S. IL-37:A new antiinflammatory cytokine of the IL-1 family[J]. European Cytokine Network,2011,(3):127-147.
(收稿日期:2015-02-27)