牙龈卟啉单胞菌脂多糖对人脐静脉内皮细胞表达趋化因子IL-8和MCP-1的影响
2015-06-12胡琳琳林玉祥贾慧杰李文军
胡琳琳,林玉祥,肖 莉,李 霞,贾慧杰,李文军,葛 颂
(遵义医学院附属口腔医院 牙周科,贵州 遵义 563099)
基础医学研究
牙龈卟啉单胞菌脂多糖对人脐静脉内皮细胞表达趋化因子IL-8和MCP-1的影响
胡琳琳,林玉祥,肖 莉,李 霞,贾慧杰,李文军,葛 颂
(遵义医学院附属口腔医院 牙周科,贵州 遵义 563099)
目的 观察牙龈卟啉单胞菌(P.gingivalis)脂多糖(lipopolysaccharide,LPS)对人脐静脉内皮细胞(HUVECs)产生趋化因子的影响,探讨P.gingivalis在动脉粥样硬化(atherosclerosis,As)病变过程中的可能作用。方法 复苏P.gingivalis菌株(ATCC 33277)并于厌氧条件下培养,采用热酚水法提取P.gingivalis-LPS,并加以纯化。应用红外线光谱、鲎实验对提取的脂多糖予以鉴定。体外培养HUVECs并加入不同终浓度的P.gingivalis-LPS,采用酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)检测共同培养2 、6 、24 h后,HUVECs分泌IL-8和MCP-1的量。结果 本研究条件下,应用不同浓度P.gingivalis-LPS刺激HUVECs 2 、6 、24 h后,细胞表达 IL-8和MCP-1蛋白水平升高。结论P.gingivalis-LPS能上调HUVECs的IL-8和MCP-1表达。
牙龈卟啉单胞菌脂多糖;人脐静脉内皮细胞;白细胞介素-8;单核细胞趋化蛋白-1
牙周炎是一种世界范围内的常见病、多发病,在我国成人中的患病率高达80%~90%,其中20%左右为重度牙周炎。流行病学调查和实验研究均显示,牙周炎与主动脉瘤、动脉粥样硬化(atherosclerosis,As)、冠心病等心血管疾病密切相关[1-4]。牙龈卟啉单胞菌(P.gingivalis)是牙周炎的主要致病菌,并且已经在As斑块中检测出P.gingivallis[5]。已有的研究发现P.gingivallis能够侵入人冠状动脉和脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs),而血管内皮细胞的损伤和功能紊乱在As的发生发展中起着重要作用。脂多糖(lipopolysaccharides,LPS)是P.gingivalis的重要毒力因子,具有广泛的生物学活性[8-9]。研究表明P.gingivallis-LPS能活化血管内皮细胞并影响内皮细胞的功能。
趋化因子白细胞介素-8(IL-8)和单核细胞趋化蛋白-1(MCP-1)是炎症反应中重要的前炎症因子,能选择性诱导中性粒细胞、单核细胞在炎症部位聚集。正常内皮细胞能表达少量MCP-1和IL-8,许多学者研究发现P.gingivallis全菌刺激内皮细胞后,内皮细胞表达IL-8、MCP-1明显增强。Takahashi研究表明P.gingivalis-LPS能刺激HUVECs表达趋化因子,Nassar等[6]通过研究也认为P.gingivalis外膜成分包括P.gingivallis-LPS能诱导HUVECs产生MCP-1和IL-8。然而也有学者认为P.gingivalis-LPS不能诱导HUVECs产生IL-8[11]。出现这两种截然相反观点的原因可能与实验中LPS的提取方法、作用浓度等的不同有关,但也使大家关于P.gingivallis-LPS对血管内皮细胞功能影响及其在As发生发展中作用的认识无法形成定论。因此,本实验采用经典热酚水法提取、纯化P.gingivalis-LPS,并以不同浓度作用于HUVECs,观察其产生细胞趋化因子的情况,以期探讨和明确P.gingivalis-LPS能否导致内皮细胞的活化和功能紊乱。
1 材料与方法
1.1 材料、仪器设备和试剂
1.1.1 材料P.gingivalisATCC33277菌株(四川大学华西口腔医学院口腔疾病研究国家重点实验室提供);人脐静脉内皮细胞株ATCC CRL-2480(中南大学湘雅医学院提供)。
1.1.2 试剂 牛心脑浸液(BHI)培养基(OXIOD, United Kingdom);DNase I(Sigma, USA);RNase H(Sigma, USA);透析袋(Merck,German);鲎试剂(厦门鲎试剂厂,敏感性0.25 EU/mL);大肠杆菌脂多糖O111:B4(Sigma,USA);IL-8 ELISA试剂盒、MCP-1 ELISA试剂盒(上海西唐生物工程公司)。
1.1.3 主要仪器 厌氧培养箱(Shellab , USA);超声波振碎机(Soniprep150 );电泳仪(BIO-RAD, USA);1000 FT-IR红外线光谱仪(VARIAN, USA);超速离心机(BECKMAN, USA);酶标仪(ELx 800, USA)。
1.2 方法
1.2.1 实验分组 实验组分为2组:T1组为1 μg/mLP.gingivalis-LPS刺激的HUVECs组,T2组为10 μg/mLP.gingivalis-LPS刺激的HUVECs组;对照组分2组:E.coli-LPS组(阳性对照组)为加入100 ng/mL刺激的HUVECs组,阴性对照组为仅加RPMI-1640培养基的HUVECs。
1.2.2P.gingivalis菌株的培养 复苏用脱脂牛奶冻存的P.gingivalisATCC33277菌株,并将P.gingivalis接种于BHI血琼脂培养基,放置于厌氧培养箱( 80%N2, 10%H2, 10%CO2) ,37 ℃恒温培养5~7d。挑取少量菌落涂片,革兰染色呈红色,镜检证实为纯培养物,用pH 7.4、0.01 mol/L PBS 收集菌苔,并用无菌蒸馏水悬浮,-20 ℃冻存。
1.2.3P.gingivalis-LPS的提取及纯化 热酚水法提取P.gingivalisATCC33277脂多糖[7]。用pH 7.4、0.01 mol/L PBS 收集 P.gingivalis 菌苔,用 PBS 离心洗涤3次后取细菌沉淀,称重后将细菌悬浮于适量的无菌蒸馏水中,形成细菌悬液,-70 ℃反复冻融4~5次,超声波裂解机振碎30 min。裂解后的细菌悬液加入等量90% 苯酚,68~70 ℃水浴中剧烈搅拌30 min,冷却至室温,3 000 r/min 离心 30 min,吸取上层水相,中层变性蛋白吸弃。将等量的无菌蒸馏水加入下层酚相,按照上述的方法继续提取2~3次。收集的上层水相先后用自来水、蒸馏水透析,透析后的水相用聚乙二醇20000浓缩至原体积的1/4,加入终浓度为50 μg/mL的DNaseⅠ和RNase H,37 ℃消化4 h,100 ℃水浴15 min,3 000 r/min 离心30 min,收集上清,再用终浓度为50 μg/mL Proteinase K 同上述方法处理后收集上清,上清加6倍以上体积无水乙醇4 ℃过夜, 3 000 r/min 离心30 min,收集沉淀,无菌蒸馏水悬浮沉淀,蒸馏水透析沉淀48 h,换水4~6次,105 000~110 000 r/min 超速离心4 h,收集沉淀,无菌蒸馏水悬浮沉淀,蒸馏水透析悬浮的沉淀48 h,换水4~6次,真空冰冻干燥后称重。
1.2.4P.gingivalis-LPS 再纯化 据 Manthey 和 Vlgel 介绍的方法对P.gingivalis脂多糖进行再纯化,5 mgP.gingivalis脂多糖溶于1 mL含0.2% 三乙胺和0.5% 脱氧胆酸钠无热源性蒸馏水中,加入1 mL 9:1(v/v)苯酚水混合物,室温下漩涡搅拌5 min,静置5 min,把样本静置于冰上10 min,14 000 r/min离心2 min,收集上层水相,酚相加入1 mL含0.2%三乙胺和0.5% 脱氧胆酸钠无热源蒸馏水,按上述的方法重提1次,合并上层水相,再用9:1 (v/v)苯酚水混合物再抽提1次,加入终浓度为75% 无水乙醇和3 mM乙酸钠, -20 ℃ 放置1 h使LPS沉淀下来,14 000 r/min 离心10 min,收集沉淀,无热源蒸馏水悬浮沉淀,蒸馏水透析悬浮的沉淀48 h,换水4~6次,真空冰冻干燥后4 ℃保存。
1.2.5 鉴定P.gingivalis-LPS
1.2.5.1 鲎实验 采用试管法凝胶鲎试剂检测P.gingivalis-LPS和商品化E.coli-LPS活性。分别取1.0、2.0、5.0、10.0、15.0、20.0、25.0、50.0、100.0 ng/mL的各种脂多糖溶液0.1 mL与等量经无热源性水溶解的鲎试剂轻轻混均,37 ℃孵箱孵育1 h,1 h后读取结果。结果判断标准:缓慢将试管旋转180°,管内容物呈凝胶状,坚实,不变形,不脱出为阳性(+);管内容物不呈凝胶状或形成的凝胶状物质形状不完整能从管壁滑落为阴性(-)。本实验以无热源性水作为阴性对照,鲎试剂阳性品作为阳性对照。
1.2.5.2 红外线光谱 称取P.gingivalis-LPS2 mg,加入200 mg KBr粉末于红外灯下在玛瑙乳钵中充分研磨均匀,装入压片模具在抽真空状态下以27 mPa的压力压制2 min,取出压片,进行红外扫描测定,以商品化的E.coli-LPS(sigma)做参比。查看Satler标准光栅光谱的谱线索引对光谱图进行剖析。
1.2.6 实验步骤
1.2.6.1P.gingivalis脂多糖刺激脐静脉内皮细胞 取生长旺盛的HUVECs(存活率>95%),用0.25% 胰蛋白酶消化,制备成细胞悬液,调整细胞数为5×105/mL,接种于6孔培养板中,每孔接种2 mL,5% CO2、37 ℃孵箱中培养过夜,待细胞有90% 以上贴壁后,用PBS洗涤细胞3次。实验组T1组、T2组分别加入终浓度为1 μg/mL和10 μg/mL的P.gingivalis-LPS工作液。空白对照组,加入新鲜配制的RPMI-1640完全培养基2 mL,复种2孔,阳性对照组加入终浓度为100 ng/mLE.coli-LPS工作液。按P.gingivalis-LPS刺激HUVECs时间又分为3个观察时间点:2、6、24 h。在2、6、24 h时,分别吸取上清液,-80 ℃冰箱冻存,用于后续实验。
1.2.6.2 ELISA法检测IL-8和MCP-1蛋白含量 ① 建立标准孔:将标准品加入0.5 mL蒸馏水混均,配制成2000 pg/mL的溶液,设立标准管8管,每管加入标本稀释液300 μL,进行对倍稀释,第8管为空白对照。② 检测:每孔加入样本100 μL,将反应板充分混均,封板,37 ℃孵育120 min,洗板。加入100 μL第一抗体工作液,混均, 37 ℃孵育60 min,洗涤。加入100 μL稀释好的酶标抗体,混均,37 ℃孵育30 min,洗涤。加入100 μL新鲜配制的底物工作液。加入100 μL反应终止液,混均。30 min之内用酶标仪在450 nm波长处读取各孔光密度值。
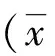
2 结果
2.1P.gingivalis菌株的培养 在BHI血琼脂平板上,P.gingivalis呈圆形微隆的黑色光滑菌落;革兰染色后镜下见为红色的球杆状细菌。
2.2P.gingivalis-LPS的鉴定
2.2.1 鲎实验结果 提取的P.gingivalis-LPS具有较高的生物活性(≥15 ng/mL),可用于后续实验(见表1)。
表1P.gingivalis-LPS及E.coli-LPS鲎实验结果

组别LPS浓度(ng/mL)1005025201510521Pg-LPS+++++----E.coli-LPA+++++----阴性对照----------
阴性对照为等量的无热源水。
2.2.2 LPS的红外线光谱检测P.gingivalis-LPS的红外线光谱图与E.coli-LPS比较相似(见图1、2),其中3400 cm-1及1630 cm-1处吸收峰为多聚-OH及-C-N=OH,提示为多糖及脂类成分。
2.3 不同浓度P.gingivalis-LPS刺激 HUVECs 表达 IL-8水平的比较 T1组、T2组在2、6、24 h,随着刺激时间的延长,IL-8分泌水平升高且均高于阴性对照组,24 h表达量达到最高(P<0.05)。表明P.gingivalis-LPS刺激下,HUVECs表达IL-8水平上调(见表2)。
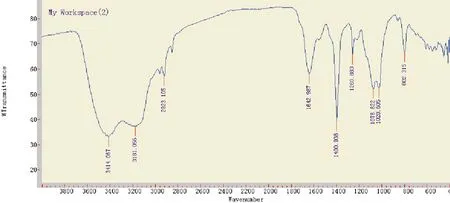
图1 E.coli-LPS红外线光谱图
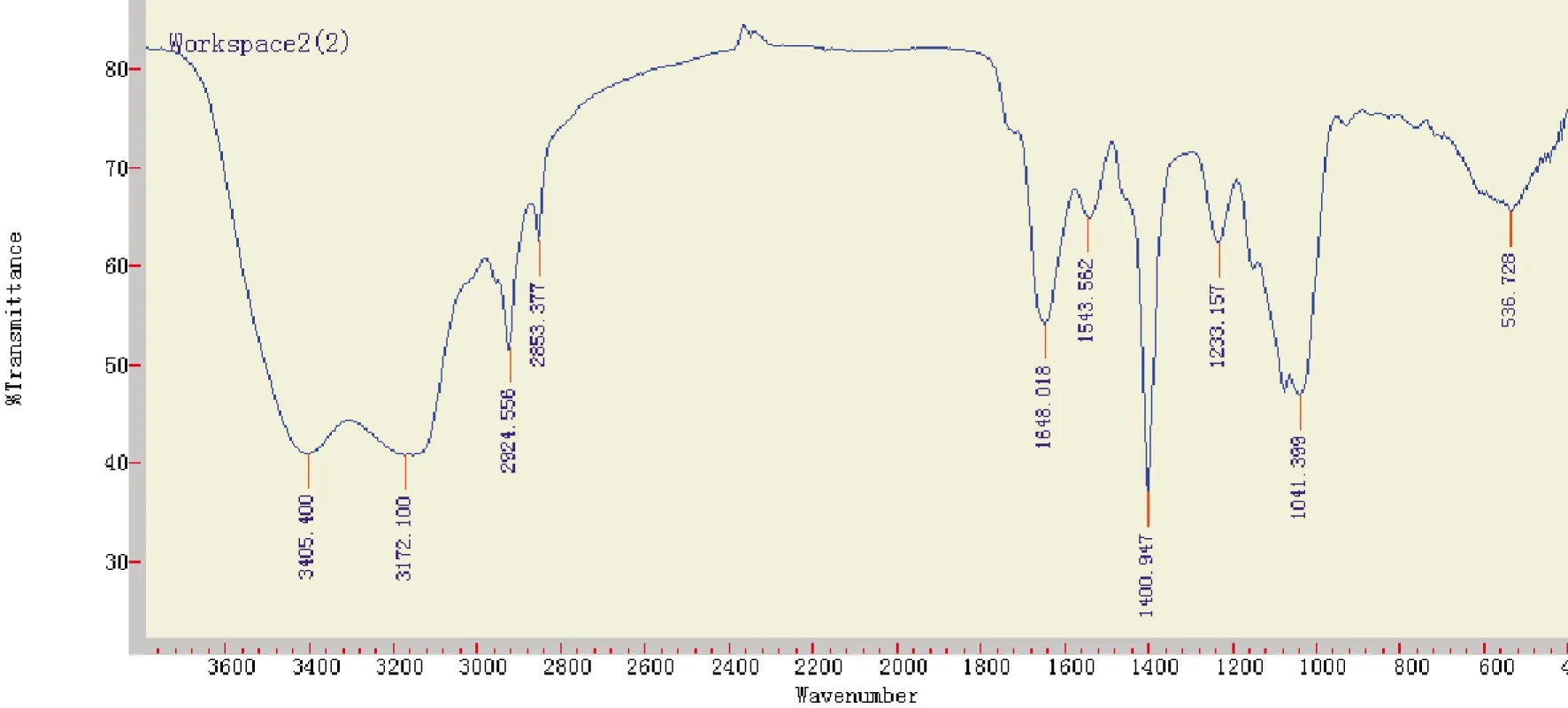
图2 P.gingivalis ATCC33277 -LPS红外线光谱图
表2 不同浓度P.gingivalis-LPsS刺激HUVEC表达IL-8水平的比较
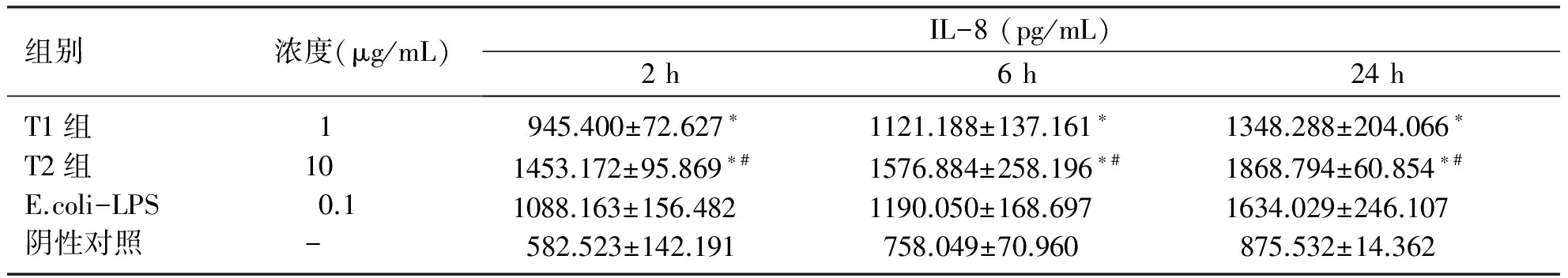
组别浓度(μg/mL)IL-8(pg/mL)2h6h24hT1组T2组E.coli-LPS阴性对照1100.1-945.400±72.627∗1453.172±95.869∗#1088.163±156.482582.523±142.1911121.188±137.161∗1576.884±258.196∗#1190.050±168.697758.049±70.9601348.288±204.066∗1868.794±60.854∗#1634.029±246.107875.532±14.362
与阴性对照组比较,*P<0.05;与T1组比较,#P<0.05。
2.4 不同浓度P.gingivalis-LPS刺激HUVECs表达 MCP-1水平的比较 2 h时,T2组及阳性对照组,HUVECs表达MCP-1水平高于阴性对照组(P<0.05),T1组与阴性对照组比较差异无统计学意义(P>0.05);6、24 h时,T1、T2组及其阳性对照组,HUVECs表达MCP-1水平高于阴性对照组(P<0.05);T2组在2、6、24 h,HUVECs表达MCP-1的量均高于T1组(P<0.05)。表明在P.gingivalis-LPS刺激下,HUVECs的 MCP-1蛋白水平的表达上调(见表3)。
表3 不同浓度P.gingivalis-LPS刺激HUVECs表达MCP-1水平的比较
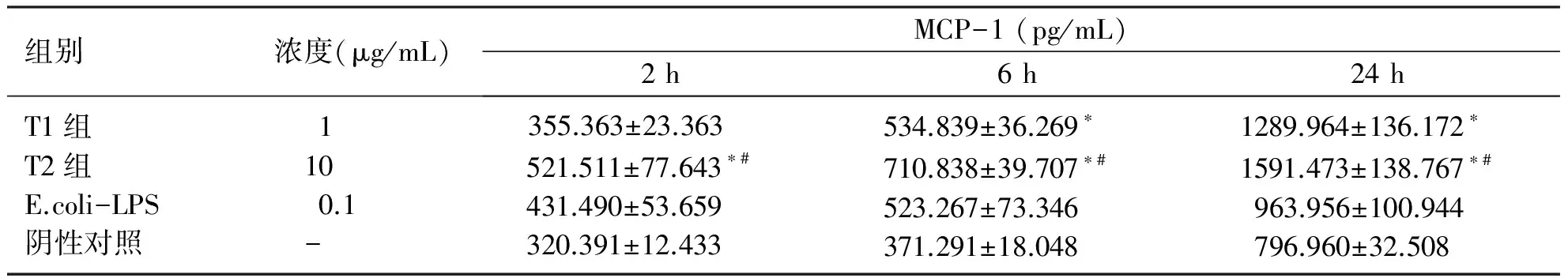
组别浓度(μg/mL)MCP-1(pg/mL)2h6h24hT1组T2组E.coli-LPS阴性对照1100.1-355.363±23.363521.511±77.643∗#431.490±53.659320.391±12.433534.839±36.269∗710.838±39.707∗#523.267±73.346371.291±18.0481289.964±136.172∗1591.473±138.767∗#963.956±100.944796.960±32.508
与阴性对照组比较,*P<0.05;与T1组比较,#P<0.05。
3 讨论
流行病学调查和实验研究均提示,牙周炎并不是一种独立的疾病,而是与心血管系统疾病、代谢综合征、糖尿病、风湿性关节炎等疾病密切相关。但牙周炎与这些全身系统性疾病、尤其是心血管系统疾病相关的机制与生物学基础目前尚不清楚。作为牙周炎最重要的致病菌—P.gingivalis常在深牙周袋上皮、龈下菌斑表面大量存在并造成牙周袋内壁溃疡、出血,P.gingivalis及其毒性产物—LPS可通过牙周袋内壁破损处进入血液循环,影响脉管系统宿主细胞—内皮细胞。而血管内皮细胞是As形成的关键细胞,其受多种因素刺激所导致的损伤和功能紊乱、进而引发后续炎症反应正是As过程的起始。因此本实验将P.gingivalis-LPS作用于HUVECs。籍此探讨P.gingivalis-LPS在As发生发展中的作用。
LPS是革兰阴性菌细胞壁外膜的主要成分,由脂质A、核心寡聚糖和O-特异性多糖侧链组成,是P.gingivalis最重要的毒力因子之一。研究表明P.gingivalis-LPS化学组成和结构与经典大肠杆菌脂多糖(E.coli-LPS,E-LPS)相似,仅生物学活性部分脂质A磷酸化和碱基化形式有所不同[10]。本实验选用的P.gingivalis菌株是国际标准菌株ATCC33277,使用热酚水法提取LPS。该方法提取的LPS中常见的污染物为核酸,用DNaseI和RNsaeH消化后提取的P.gingivalis-LPS,能够最大限度的减少提取的LPS中残存的核酸,再根据Manthey和Vlgel介绍的方法对P.gingivalis-LPS进行纯化。经鉴定提取的P.gingivalis-LPS凝固鲎试剂活性与Ecoli-LPS相似,P.gingivalis-LPS红外光谱也与Ecoli-LPS比较相似,表明该P.gingivalis-LPS与Ecoli-LPS具有相似的基本结构。为了验证P.gingivalis-LPS对HUVECs功能的影响,本研究分别选用了前期实验确定的LPS刺激浓度范围内较低(1 μg/mL)和较高(10 μg/mL)的两种不同浓度的P.gingivalis-LPS刺激HUVECs。实验结果表明,刺激2、6、24 h 后,细胞表达 IL-8蛋白水平随着刺激时间的延长而升高,24 h时表达量最高;2 h时,高浓度P.gingivalis-LPS刺激细胞表达 MCP-1蛋白水平与阴性对照组相比升高,6 h和24 h时,高浓度和低浓度P.gingivalis-LPS刺激细胞表达 MCP-1蛋白水平均较阴性对照组高。本研究与Nassar等的研究结果相似,均显示P.gingivalis-LPS能刺激HUVECs致其功能紊乱、表达趋化因子IL-8和MCP-1增加。IL-8和MCP-1是特异性中性粒细胞和单核细胞的趋化因子,可引起中性白细胞和单核细胞向内皮细胞聚集并在黏附分子的作用下黏附于内皮细胞,从而使后续的单核细胞向内皮下迁移并吞噬脂质而成为泡沫细胞、As病损初步形成等成为可能。因此,我们推测,P.gingivalis-LPS对HUVECs的影响可能是P.gingivalis感染所致牙周炎与As相关的生物学基础之一。
目前已有研究表明,牙周主要致病菌P.gingivalis可根据其菌毛蛋白编码基因fimA核苷酸序列的差异被分为6型(Ⅰ-Ⅴ型以及Ⅰb型)。其中,ⅡfimA型和ⅣfimA型菌株与重度牙周炎的发生发展密切相关,是P.gingivalis的高毒力株,而ⅠfimA型菌株则为低毒力株。与此同时,流行病学研究显示,与As相关的主要是重度牙周炎。那么,不同fimA型P.gingivalis菌株的LPS对HUVECs功能的影响有无差异、其作用的分子机制与信号通路等尚待进一步研究阐明。
[1] Nakano K, Wada K, Nomura R, et al. Characterization of aortic aneurysms in cardiovascular disease patients harboring Porphyromonas gingivalis [J]. Oral Diseases, 2011, 17(4): 370-378.
[2] Wada K, Kamisaki Y. Roles of oral bacteria in cardiovascular diseases-from molecular mechanisms to clinical cases: Involvement of Porphyromonas gingivalis in the development of human aortic aneurysm [J]. J Pharmacol Sci, 2010, 113(2): 115-119.
[3] Pinho M M,Faria-Almeida R,Azevedo E, et al. Periodontitis and atherosclerosis:an observational study [J]. J Periodontal Res, 2013, 48(4): 452-457.
[4] Miyauchi S, Maekawa T, Aoki Y, et al. Oral infection with Porphyromonas gingivalis and systemic cytokine profile in C57BL/6.KOR-ApoE shl mice [J]. J Periodontal Res, 2012, 47(3): 402-408.
[5] Padilla C, Lobos O, Hubert E, et al. Periodontal pathogens in atheromatous plaques isolated from patients with chronic peridontitis [J]. Periodontal Res, 2006, 41(4): 350-353.
[6] Nassar H,chou H H,khlgatian M,et al. Role for fimbriae and lysine-specific cysteine proteinase gingipain K in expression of interleukin-8 and monocyte chemoattractant protein inPorphyromonasgingivalis-infected endothelial cells [J]. Infection and Immunity, 2002, 70(1): 268 - 276.
[7] 杨成兰,罗薇,刘内生,等. 丙型副伤寒沙门氏菌脂多糖提取纯化及活性分析[J]. 中国畜牧兽医,2014 ,41(4): 75-78.
[8] Herath T D, Wang Y, Seneviratne C J, et al. Porphyromonas gingivalis lipopolysaccharide lipid a heterogeneity differentially modulates the expression of IL-6 and IL-8 in human gingival fibroblasts [J]. J Clin Periodontol, 2011, 38(8): 694-701.
[9] Darveau R P. Periodontitis: a polymicrobial of host homeostasis [J].Nat Rev Microbiol, 2010, 8(7): 481-490.
[10] Rietschel E T, Kirikae T, Schade F U, et al. The chemical structure of bacterial endotoxin in relation to bioactivity [J]. Immunobiology, 1993, 187(3-5): 169-259.
[11] Erridge C, Spickett C M, Webb D J. Non-enterobacterial endotoxins stimulate human coronary artery but not venous endothelial cell activation via Toll-like receptor 2 [J]. Cardiovasc Res,2007,73(1):181-189.
[收稿2014-12-30;修回2015-03-03]
(编辑:谭秀荣)
Effects ofPorphyromonasgingivalislipopolysaccharide on the expressions of IL-8 and MCP-1 in HUVECs
HuLinlin,LinYuxiang,XiaoLi,LiXia,JiaHuijie,LiWenjun,GeSong
(Department of Periodontics,The Affiliated Dental Hospital of Zunyi Medical University,Zunyi Guizhou 563099, China)
Objective To study the effects of lipopolysaccharide (LPS) fromPorphyromonasgingivalison the expressions of IL-8 and MCP-1 in human umbilical vein endothelial cells (HUVECs) and discuss the possible role ofPorphyromonasgingivalisin the process of atherosclerosis.Methods Anaerobic method was employed forP.gingivalis(ATCC 33277).P.gingivalis-LPS was prepared by phenol-water methodsand then purified.P.gingivalis-LPS was assessed for their inductions of IL-8 and MCP-1 expressions in HUVECs. Enzyme linked immunosorbent assay was used to determine the protein expressions of IL-8 and MCP-1 in the culture supernatant of HUVECs at different time intervals (2, 6 and 24 h).Results Under the environments of our experiment,P.gingivalis-LPS increased the levels of IL-8 and MCP-1.Conclusion LPS ofPorphyromonasgingivaliscould stimulate HUVECs to express IL-8 and MCP-1.
P.gingivalis-LPS; HUVECs; IL-8; MCP-1
国家自然科学基金资助项目(NO:8126016)。
葛颂,男,博士,教授,硕士生导师,研究方向:牙周病学,E-mail:gesong007b@163.com。
R781.4
A
1000-2715(2015)02-0154-06
