吴茱萸碱、吴茱萸次碱和吴茱萸总碱的小鼠急性毒性
2015-06-12林淑娴任丽娜孙安盛
林淑娴,任丽娜,孙安盛
(1.遵义医学院 药理学教研室暨贵州省基础药理学重点实验室,贵州 遵义 563099;2.遵义医学院 药学院2011级实习生, 贵州 遵义 563099)
基础医学研究
吴茱萸碱、吴茱萸次碱和吴茱萸总碱的小鼠急性毒性
林淑娴1,任丽娜2,孙安盛1
(1.遵义医学院 药理学教研室暨贵州省基础药理学重点实验室,贵州 遵义 563099;2.遵义医学院 药学院2011级实习生, 贵州 遵义 563099)
目的 观察吴茱萸碱、吴茱萸次碱和吴茱萸总碱的急性毒性,为吴茱萸碱类的深入研究提供实验依据。方法 昆明种小鼠,清洁级,雌雄兼用,随机分为4组:空白对照、吴茱萸碱、吴茱萸次碱和吴茱萸总碱组。各给药组分别单次灌胃给药2 g/kg,无小鼠死亡。然后进行单次灌胃最大给药量(5g/kg)实验,连续观察14 d。观察小鼠一般指标及体重变化;分别在给药后2 h、8 h、1 d、7 d和14 d测定血清谷氨酸转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)、肌酐(Crea)和尿素(Urea)的浓度;同时进行心、肝、脾、肺、肾和脑组织病理学观察,并计算脏器指数。结果 在观察的14 d内无小鼠死亡。与空白对照组比较,吴茱萸3种生物碱给药小鼠的皮毛、行为活动、呼吸、精神状态、饮食等均未见明显异常改变。测定药后2 h、8 h、24 h、7 d和14 d ALT、AST、Crea、Urea 及主要脏器指数,与对照组没有明显差异。肉眼及组织病理学观察没有异常发现。吴茱萸碱组于给药后7 d 和14 d 时,体重较对照组呈下降趋势,但无统计学意义。结论 小鼠分别单次灌胃吴茱萸碱、吴茱萸次碱或吴茱萸总碱最大给药量5g/kg,连续观察14 d,未见明显毒性。
吴茱萸碱;吴茱萸次碱;吴茱萸总碱;急性毒性;小鼠
吴茱萸是我国常用中药,为芸香科植物吴茱萸Euodiarutaecarpa(Juss)Benth、石虎Euodiarutaecarpa(Juss.)Benthvar.officinalis(Dode)Huang或疏毛吴茱萸Euodiarutaecarpa(Juss.)Benth.Var.bodinieri(Dode)Huang干燥近成熟果实,其味苦,性辛热,有小毒,具有散寒止痛,降逆止呕,助阳止泻等功效[1]。在我国用其治疗头痛、腹痛、产后出血、痢疾等病症已有数百年的历史[2]。近年来国内外对吴茱萸的化学成分和药理作用进行了大量的研究,发现吴茱萸所含生物碱是其药理活性的主要成分[3-4 ]。近期报道,吴茱萸水和醇提组分具有明显的肝毒性,其对肝脏的损害呈现“量-毒”关系[5-8 ]。有关吴茱萸生物碱类的毒性,目前尚未见有报道,我们对吴茱萸所含主要生物碱,吴茱萸碱、吴茱萸次碱和吴茱萸总碱进行了小鼠急性毒性的研究,为吴茱萸的深入研究提供实验依据。
1 材料与方法
1.1 试药 吴茱萸总碱(批号:ZL140410593,纯度98.2%),吴茱萸碱(批号:ZL140215968,纯度98.6%)和吴茱萸次碱(批号:ZL140308269,纯度98.5%)均购自南京郎泽医药科技有限公司。
1.2 仪器 电子天平(德国赛多利斯公司),PUZS-300全自动生化分析仪(德国贝朗医疗有限公司)。
1.3 动物 昆明种小鼠(SPF级),雌雄各半,体重18~22g,6周龄,由第三军医大学实验动物中心提供,实验动物质量合格证号SCXK-(军)2012-0003。
1.4 预实验及最大给药量实验 小鼠适应性喂养3 d,给药前禁食、自由饮水12 h。受试小鼠雌雄各半,随机分为4组,空白对照组、吴茱萸总碱组、吴茱萸碱组和吴茱萸次碱组。预实验各组小鼠5只,雌雄兼用,各给药组小鼠1次灌胃给药2 g/kg,观察14 d无小鼠死亡,然后进行最大给药量实验[9]。小鼠最大灌胃给药浓度及给药容量(0.4 mL/10 g体重)5 g/kg体重,空白对照组灌胃等容量生理盐水。
1.4.1 急性毒性一般指标观察及体重变化 每组小鼠10只,观察各组小鼠的外观、行为活动、呼吸、精神状态、饮食、粘膜、排泄物、体重及死亡情况。给药后2 h内,每15分钟观察1次;3~6 h内,每30分钟观察1次;7~12 h内,每1小时观察1次;此后每天观察1次,连续14 d。给药后1、7和14 d测小鼠体重。
1.4.2 肝、肾功能检测 分别于给药后2 h、8 h、1 d、7 d和14 d(每时间点小鼠8只)小鼠眼球取血,离心3 500 rpm,10 min,制备血清,测定血清中谷氨酸转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)、肌酐(Crea)和尿素(Urea)的浓度。
1.4.3 大体解剖及病理学检查 动物数及处死时间同1.4.2,行肉眼及病理学观察心、肝、脾、肺、肾、脑等主要脏器的改变,并计算脏器指数,脏器指数=器官重量(g)/体重(g)×100%。
2 结果
在预试验中,分别单次灌胃吴茱萸3种生物碱2g/kg,各组在观察的14 d 内,未见小鼠死亡,无法测出LD50,故进行最大给药量的测定。各给药组小鼠1次灌胃最大给药浓度及给药容量(0.4 mL/10g体重)5 g/kg,观察14 d,无小鼠死亡。
2.1 吴茱萸3种生物碱最大给药量对小鼠一般指标及体重的影响 各组小鼠1次灌胃最大给药量5 g/kg体重,在观察的14 d 内,小鼠的皮毛、行为活动、精神状态、饮食和大小便及其颜色,与空白对照组比较,未见异常,鼻、眼和口无异常分泌物。在给药后的14 d,各组小鼠的体重均有所增加,与空白对照组比较,吴茱萸碱给药组体重的增加有下降趋势,但没有统计学意义(P>0.05);吴茱萸总碱和吴茱萸次碱组体重的变化与空白对照组相似(见图1)。
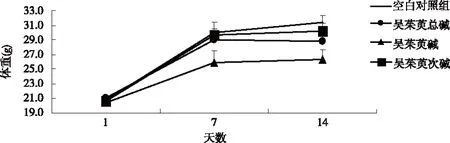
图1 小鼠的体重曲线
2.2 吴茱萸3种生物碱最大给药量对肝、肾功能的影响 各组小鼠于给药后2 h、8 h、1 d、7 d和14 d的生化检测结果(见表1~5),与空白对照组比较无统计学意义(P>0.05)。
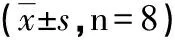
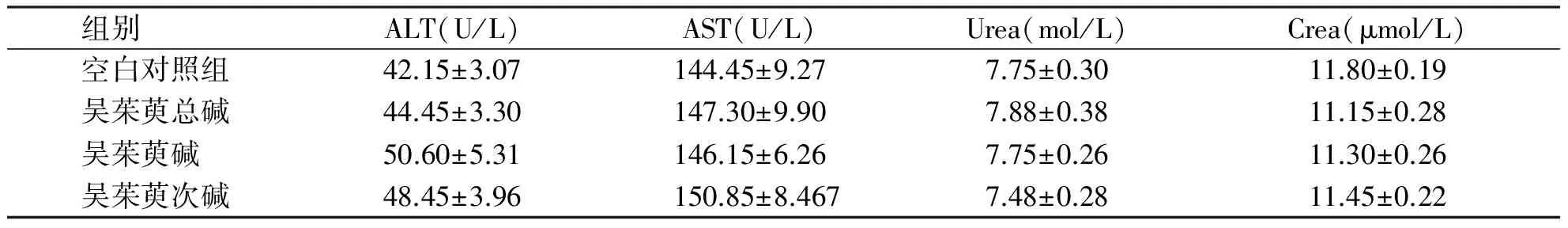
组别 ALT(U/L)AST(U/L)Urea(mol/L)Crea(μmol/L)空白对照组42.15±3.07144.45±9.277.75±0.3011.80±0.19吴茱萸总碱44.45±3.30147.30±9.907.88±0.3811.15±0.28吴茱萸碱 50.60±5.31146.15±6.267.75±0.2611.30±0.26吴茱萸次碱48.45±3.96150.85±8.4677.48±0.2811.45±0.22
各组间无统计学意义(P>0.05)。

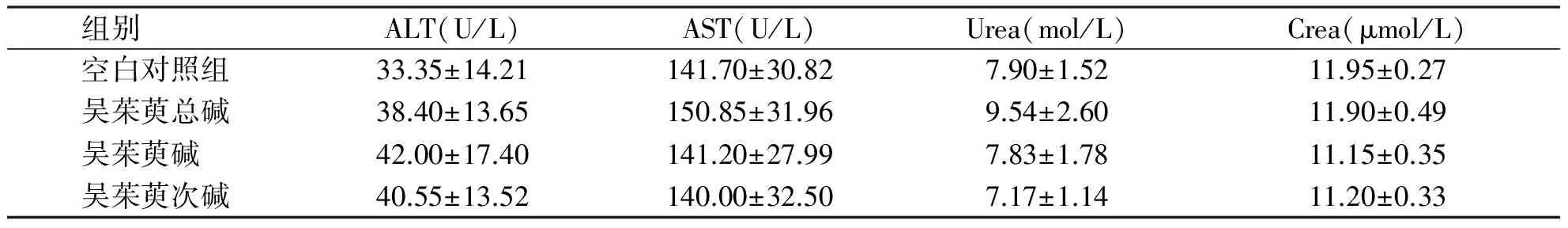
组别 ALT(U/L)AST(U/L)Urea(mol/L)Crea(μmol/L)空白对照组33.35±14.21141.70±30.827.90±1.5211.95±0.27吴茱萸总碱38.40±13.65150.85±31.969.54±2.6011.90±0.49吴茱萸碱 42.00±17.40141.20±27.997.83±1.7811.15±0.35吴茱萸次碱40.55±13.52140.00±32.507.17±1.1411.20±0.33
各组间无统计学意义(P>0.05)。

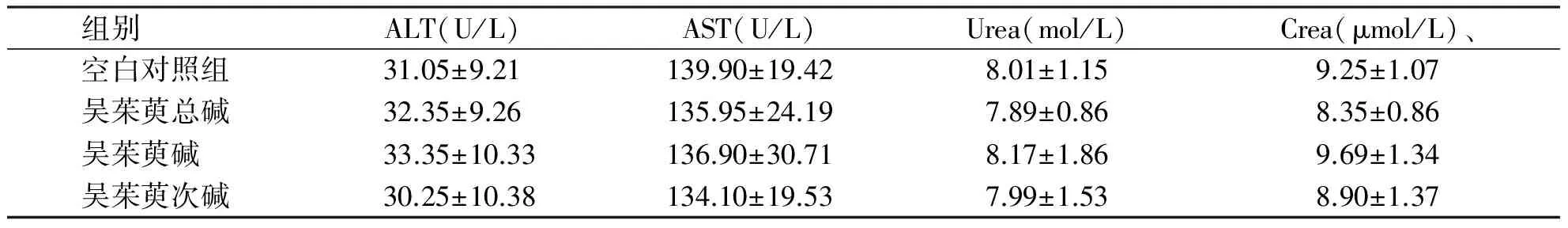
组别 ALT(U/L)AST(U/L)Urea(mol/L)Crea(μmol/L)、空白对照组31.05±9.21139.90±19.428.01±1.159.25±1.07吴茱萸总碱32.35±9.26135.95±24.197.89±0.868.35±0.86吴茱萸碱 33.35±10.33136.90±30.718.17±1.869.69±1.34吴茱萸次碱30.25±10.38134.10±19.537.99±1.538.90±1.37
各组间无统计学意义(P>0.05)。


组别 ALT(U/L)AST(U/L)Urea(mol/L)Crea(μmol/L)空白对照组37.60±14.39146.60±43.518.26±0.7611.64±2.53吴茱萸总碱38.85±12.25131.10±19.467.81±1.4111.11±2.42吴茱萸碱 43.60±19.67147.05±27.538.54±1.3410.72±1.92吴茱萸次碱41.15±15.09142.45±28.197.97±1.1011.49±2.29
各组间无统计学意义(P>0.05)。

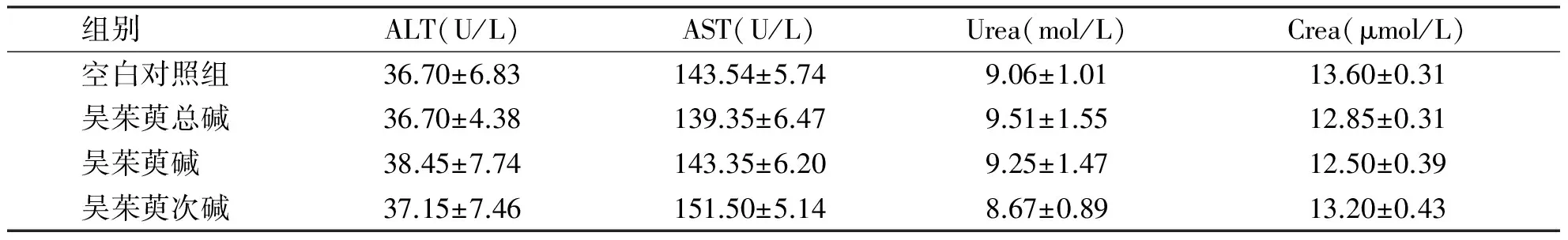
组别 ALT(U/L)AST(U/L)Urea(mol/L)Crea(μmol/L)空白对照组36.70±6.83143.54±5.749.06±1.0113.60±0.31吴茱萸总碱36.70±4.38139.35±6.479.51±1.5512.85±0.31吴茱萸碱 38.45±7.74143.35±6.209.25±1.4712.50±0.39吴茱萸次碱37.15±7.46151.50±5.148.67±0.8913.20±0.43
各组间无统计学意义(P>0.05)。
2.3 吴茱萸3种生物碱最大给药量主要脏器的病理学检查 各组小鼠分别于给药后2 h、8 h、1 d、7 d和14 d处死小鼠,肉眼观察没有发现心、肝、脾、肺、肾、脑异常改变,病理学检查未见异常(见图2~6),与空白对照组比较,脏器指数无统计学意义(P>0.05)。

图2 药后2 h对小鼠主要脏器指数的影响

图3 药后8 h对小鼠主要脏器指数的影响

图4 药后1 d对小鼠主要脏器指数的影响

图5 药后4 d对小鼠主要脏器指数的影响

图6 药后14 d对小鼠主要脏器指数的影响
3 讨论
吴茱萸是中医临床常用药材,植物化学研究表明,其化学成分主要含有生物碱、黄酮苷类化合物、挥发油、苦味素等[10]。吴茱萸的主要活性成分为生物碱,如吴茱萸碱、吴茱萸次碱、羟基吴茱萸碱、去氢吴茱萸因碱等。近年来,对吴茱萸碱和吴茱萸次碱的药理学研究越来越多,但却未见到有关其毒性的报道。我国药典和文献均注明吴茱萸有小毒,临床时有个案报道服用吴茱萸水煎剂中毒[11-12],主要表现为腹痛、中枢神经系统症状等。近来报道:小鼠单次灌服吴茱萸水提组分32.5 g/kg,导致血清AST 和ALT升高,于药后2 h 达高峰,肝脏指数明显升高;病理学检查显示给药8~72 h 肝组织可见明显损伤,且呈量-毒关系[5]。鉴于上述报道,我们在小鼠急性毒性实验中,分别灌胃吴茱萸碱、吴茱萸次碱和吴茱萸总碱最大给药量5 g/kg,观察药后2 h、8 h、1 d、7 d 和14 d 小鼠的表现,同时检测肝肾功能,主要脏器指数和肝脏组织病理学,没有发现明显肝毒性,小鼠的一般状况,所检测的其它脏器指数和病理学也无异常发现。吴茱萸水提取物的成分复杂,明确哪一具体物质引起毒性,值得深入研究。
[1] 国家药典委员会编.中华人民共和药典[S].I部.北京: 中国医药科技出版社,2010:160.
[2] Jia S, Hu C. Pharmacological effects of Rutaecarpine as a cardiovascular protective agent[J]. Molecules, 2010, 15(3): 1873-1881.
[3] Li Y J, Zhang F, Gong Q H, et al. Rutaecarpine inhibits angiotensin II-induced proliferation in rat vascular smooth muscle cells[J]. Chin J Integr Med,2014,20(9): 682-687.
[4] 文丽梅, 马超英, 余德林. 吴茱萸的化学成分和药理作用研究进展[J]. 中华中医药学刊,2012,30(9):1976-1977.
[5] 黄 伟,孙 蓉,吕丽莉,等.吴茱萸水提组分单次给药对小鼠肝毒性“量-时-毒”关系研究[J].中药药理与临床,2012,28(5):96-99.
[6] 黄 伟,赵 燕,孙 蓉.吴茱萸不同组分对小鼠急性毒性试验比较研究[J].中国药物警戒,2010,7(3):129-134.
[7] 李 波,李 莉,赵军宁,等.吴茱萸乙醇提取物对大鼠急性毒性及肝毒性的影响[J].中药药理与临床,2013,29(2):120-124.
[8] 祝靓靓,杨东旭,刘 昕,等.吴茱萸果实的肝脏毒性研究及毒性部位初步探索[J].时珍国医国药,2013,24(8):1810-1813.
[9] 食品药品监督管理局.化学药物急性毒性试验技术指导原则[EB/OL].(2005-5-18)http://www.sda.gov.cn/WS01/CL1616/83424.html.
[10] 文丽梅,马超英,余德林,等.吴茱萸的化学成分和药理作用研究进展[J].中华中医药学刊,2012, 30(9):1976-1977.
[11] 陈云云.浅谈吴茱萸的中毒与治疗[J]. 浙江中西医结合杂志,1999,9(4):281.
[12] 蔡雪映,孟 楠,杨 冰.服用吴茱萸过量致中毒1例分析[J].北京中医,2006,25(3): 171-172.
[收稿2015-01-06;修回2015-02-09]
(编辑:谭秀荣)
Acute toxicity study on evodiamine, rutacarpine and evodia total alkaloids in mice
LinShuxian,RenLina,SunAnsheng
(1.Department of Pharmacology and the Key Laboratory of Basic Pharmacology of Guizhou Province, Zunyi Medical University, Zunyi Guizhou 563099, China)
Objective To study the acute toxicity of evodiamine (Evo), rutacarpine (Rut) and evodia total alkaloids (ETA) in mice. Methods Adult 6-week-old male and female Kunming mice were randomly divided into the control, Evo, Rut and ETA groups. Mice were respectively treated with single dose of Evo (2 g/kg), Rut (2 g/kg) and TA (2 g/kg) by intragastric administration (i.g). Fourteen days after drug treatment, no mice died. Then, the maximum amount of Evo, Rut and ETA (5 g/kg) were respectively undertaken to observe the toxic reaction and the body weight changes of mice. At different time points after drug administration for 14 days, the serum concentrations of ALT, AST, Crea and Urea were determined by automatic biochemistry analyzer. The histopathology of liver, spleen, lung, heart, kidney and brain was evaluated by HE staining and the visceral index was calculated. Results Within 14 days after drug administration, no significant difference of the mouse fur, activities, respiration, mental state, diet, eyelids, feces, body weight, color, histopathological examination and visceral index between the control and drug treatment groups was shown. Conclusion Evo, Rut and ETA have no significantly toxicity.
evodiamine; rutacarpine; evodia total alkaloids; acute toxicity; mouse
国家自然科学基金资助项目(NO:81160528);贵州省中医药管理局资助项目(NO:黔中医药 2009-79)。
孙安盛,男,教授,硕士生导师,研究方向:心血管药理,E-mail:sunansheng1945@163.com。
R285
A
1000-2715(2015)02-0146-04
