猪带绦虫TSO45W-4B-TSOL18融合基因重组双歧杆菌诱导家猪免疫应答
2015-06-12周必英刘美辰万小波
周必英,刘美辰,万小波
(遵义医学院 寄生虫学教研室,贵州 遵义 563099)
专家论坛
猪带绦虫TSO45W-4B-TSOL18融合基因重组双歧杆菌诱导家猪免疫应答

周必英,刘美辰,万小波
(遵义医学院 寄生虫学教研室,贵州 遵义 563099)
目的 观察猪带绦虫TSO45W-4B-TSOL18融合基因重组双歧杆菌口服灌胃和肌肉注射家猪后诱导的免疫应答。方法 12头40日龄健康家猪随机均分为3组,每组4头。口服灌胃组每猪灌胃1011CFU重组双歧杆菌[溶于50 mL双歧杆菌液体培养基(MRS)],肌肉注射组每猪于猪后腿肌肉注射1011CFU重组双歧杆菌(溶于10 mL MRS),对照组每猪灌胃50 mL MRS。每次间隔2周,共免疫2次。于免疫后0、2、4、6和8周进行前腔静脉采血,采用ELISA法检测猪血清免疫球蛋白G(IgG)水平;制备猪外周血淋巴细胞(PBMC),采用四甲基偶氮唑盐(MTT)法检测猪PBMC增殖水平;收集粪便,测定分泌型免疫球蛋白A(sIgA)水平。结果 与免疫前和MRS对照组相比,口服灌胃组和肌肉注射组猪血清IgG水平、PBMC增殖水平均在免疫后2~8周升高,6周达较高水平;粪便sIgA水平在免疫后2~8周升高,4周达较高水平,差异均具有统计学意义(P<0.05)。口服灌胃组的IgG、sIgA水平和PBMC增殖水平显著高于肌肉注射组(P<0.05)。结论 猪带绦虫TSO45W-4B-TSOL18融合基因重组双歧杆菌可诱导家猪产生有效的免疫应答,其免疫效果口服灌胃优于肌肉注射。
猪带绦虫;TSO45W-4B-TSOL18融合基因;重组双歧杆菌;免疫应答
囊尾蚴病是由猪带绦虫(Taeniasolium)幼虫猪囊尾蚴寄生于人体皮下、肌肉、脑和眼等引起的一种严重危害畜牧业生产和人类健康的人兽共患寄生虫病。该病呈世界性分布,我国以东北、华北、西北和西南地区发病率较高,因其防治存在化学药物的残留和抗药性问题,研制疫苗防治该病已成为当前研究的热点[1-4]。双歧杆菌(bifidobacterium)是人和动物肠道内重要的益生菌,近年来,随着基因工程技术的发展,选择具有益生功能的双歧杆菌作为载体传递系统,已在细菌、病毒、寄生虫和肿瘤等领域构建了一系列重组双歧杆菌[5]。在猪带绦虫六钩蚴阶段表达的TSO45W-4B和TSOL18基因与六钩蚴的入侵密切相关,具有良好的免疫原性和免疫保护性,是理想的猪带绦虫疫苗候选抗原[6-10]。本研究拟在成功构建猪带绦虫TSO45W-4B-TSOL18融合基因重组双歧杆菌[11-14]的基础上,将其口服灌胃和肌肉注射免疫家猪,观察其诱导产生的免疫应答。
1 材料与方法
1.1 疫苗来源 猪带绦虫TSO45W-4B-TSOL18融合基因重组双歧杆菌[11-14](以下简称为重组双歧杆菌)由本室制备。
1.2 实验动物 12头40日龄健康家猪,体重约为15 kg,购于遵义县三盆镇养殖场,饲养于遵义医学院实验动物中心。
1.3 主要试剂和仪器 纯化的猪带绦虫TSO45W-4B-TSOL18重组抗原由本室制备[12]。猪血清免疫球蛋白G(IgG)和粪便分泌型免疫球蛋白A(sIgA)检测试剂盒购自美国Southern Biotech公司,刀豆球蛋白A(ConA)购自美国Sigma公司,RPMI 1640培养基、胎牛血清(FCS)、四甲基偶氮唑盐(MTT)试剂购自生工生物工程(上海)股份有限公司。酶标仪购于山东高密彩虹分析仪器有限公司,CO2培养箱购自美国Thermo公司。
1.4 动物分组与免疫 将12头健康家猪随机分为3组,每组4头。免疫前30 min灌胃5% NaHCO3,以中和胃酸。口服灌胃组每猪灌胃1011CFU重组双歧杆菌[溶于50 mL双歧杆菌液体培养基(MRS)],肌肉注射组每猪于猪后腿肌肉注射1011CFU重组双歧杆菌(溶于10 mL MRS),对照组每猪灌胃50 mL MRS。每次间隔2周,共免疫2次。
1.5 猪血清IgG和粪便sIgA水平检测 于免疫后0、2、4、6、8周从猪前腔静脉采血2~2.5 mL,4oC静置12 h,1 018 ×g离心10 min,分离血清,-20oC冻存待检。收集各组粪便0.1 g,用0.01 mol/mL磷酸盐缓冲液(PBS)200 μL悬浮,4 ℃静止30 min,充分混匀,509 ×g离心15 min,收集上清,-20 ℃冻存。采用猪血清免疫球蛋白G(IgG)和粪便分泌型免疫球蛋白A(sIgA)检测试剂盒进行检测,具体按试剂盒说明书进行操作。
1.6 猪外周血淋巴细胞(PBMC)制备 于免疫后0、2、4、6、8周从猪前腔静脉采血1~2 mL,置于无菌乙二胺四乙酸(EDTA)抗凝管内,用含10% FCS的RPMI 1640培养液稀释2倍。按2∶1体积缓慢加至淋巴细胞分离液液面上,636 ×g离心20 min,吸取上下液体交界处白膜层。用RPMI 1640培养液稀释5倍,洗涤2次,并用RPMI 1640培养液调整细胞浓度为5×106/mL。
1.7 猪PBMC增殖水平检测 将5×106/mL猪PBMC加入24孔细胞培养板上,分别加入1 mL原液、1 mL原液+10 μL猪带绦虫TSO45W-4B-TSOL18重组抗原(1 μg/μL)、1 mL原液+10 μL ConA(1 μg/μL)。于37 ℃ 5% CO2培养箱中培养44 h。每孔加入10 μL MTT(5 mg/mL),继续培养4 h。轻轻倒置细胞培养板,控干液体,每孔加入100 μL二甲基亚砜(DMSO),轻轻振荡,溶解沉淀。测定每孔吸光度(A630值)。
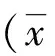
2 结果
2.1 猪血清IgG水平 结果显示,口服灌胃组和肌肉注射组血清IgG水平在免疫后2~8周升高,6周达较高水平,与免疫前和MRS对照组相比,差异有统计学意义(P<0.05)。免疫后2、4、6和8周,口服灌胃组血清IgG水平显著高于肌肉注射组(P<0.05,见表1)。
表1 猪带绦虫TSO45W-4B-TSOL18融合基因重组双歧杆菌免疫家猪后血清IgG水平(n=4,μg/mL)

免疫后周数口服灌胃组肌肉注射组MRS对照组0208.86±3.08206.19±1.83207.00±4.682230.86±3.08ab220.78±2.97a206.86±1.004270.01±2.82ab260.08±3.80a207.97±3.936306.05±2.90ab281.29±4.85a209.13±3.828290.95±0.51ab271.19±0.18a204.50±0.38
与免疫0周和MRS对照组比较,aP<0.05;与肌肉注射组比较,bP<0.05。
2.2 猪粪便sIgA水平 结果显示,口服灌胃组和肌肉注射组粪便sIgA水平在免疫后2~8周升高,4周达较高水平,与免疫前和MRS对照组相比,差异有统计学意义(P<0.05)。免疫后2、4、6和8周,口服灌胃组粪便sIgA水平显著高于肌肉注射组(P<0.05,见表2)。
表2 猪带绦虫重组TSO45W-4B-TSOL18融合基因重组双歧杆菌免疫家猪后粪便sIgA水平(n=4,μg/mL)

免疫后周数口服灌胃组肌肉注射组MRS对照组014.08±0.1314.23±0.2914.21±0.31218.07±0.36ab17.03±0.14a14.20±0.31420.69±0.58ab19.10±0.51a14.24±0.29616.77±0.32ab16.99±0.32a14.24±0.29815.95±0.51ab15.19±0.18a14.50±0.38
与免疫0周和MRS对照组比较,aP<0.05;与肌肉注射组比较,bP<0.05。
2.3 猪PBMC增殖水平 结果显示,口服灌胃组和肌肉注射组PBMC增殖水平在免疫后2~8周升高,6周达较高水平,与免疫前和MRS对照组相比,差异有统计学意义(P<0.05)。免疫后2、4、6和8周,口服灌胃组显著高于肌肉注射组(P<0.05,见表3)。
表3 猪带绦虫重组TSO45W-4B-TSOL18融合基因重组双歧杆菌免疫家猪后PBMC增殖水平(n=4,A630值)
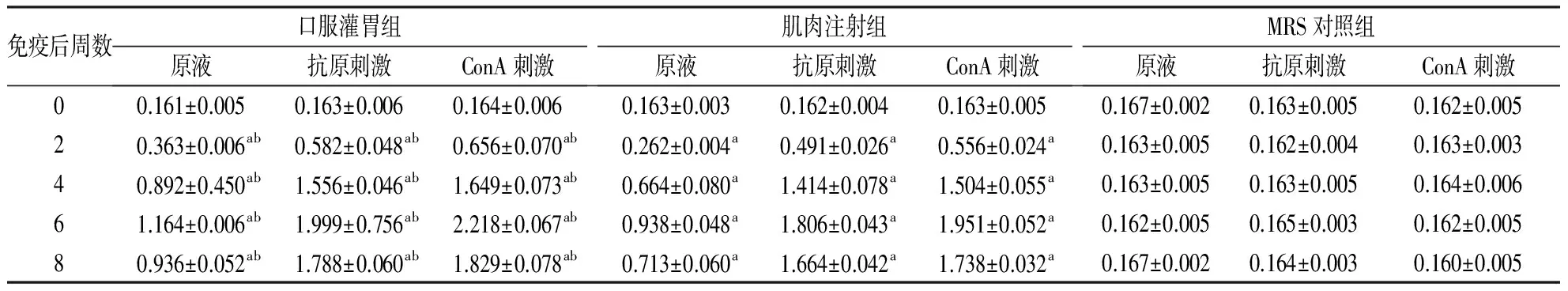
免疫后周数口服灌胃组原液抗原刺激ConA刺激肌肉注射组原液抗原刺激ConA刺激MRS对照组原液抗原刺激ConA刺激00.161±0.0050.163±0.0060.164±0.0060.163±0.0030.162±0.0040.163±0.0050.167±0.0020.163±0.0050.162±0.00520.363±0.006ab0.582±0.048ab0.656±0.070ab0.262±0.004a0.491±0.026a0.556±0.024a0.163±0.0050.162±0.0040.163±0.00340.892±0.450ab1.556±0.046ab1.649±0.073ab0.664±0.080a1.414±0.078a1.504±0.055a0.163±0.0050.163±0.0050.164±0.00661.164±0.006ab1.999±0.756ab2.218±0.067ab0.938±0.048a1.806±0.043a1.951±0.052a0.162±0.0050.165±0.0030.162±0.00580.936±0.052ab1.788±0.060ab1.829±0.078ab0.713±0.060a1.664±0.042a1.738±0.032a0.167±0.0020.164±0.0030.160±0.005
与免疫0周和MRS对照组比较,aP<0.05;与肌肉注射组比较,bP<0.05。
3 讨论
不同接种途径涉及不同抗原提呈,可产生不同强度、不同类型的免疫应答。肠上皮细胞和肠黏膜下集合淋巴结是诱导肠道黏膜免疫反应的主要部位。肠上皮细胞不仅具有吸收肠腔内各种抗原功能,还具有摄取和释放sIgA、提呈抗原、分泌细胞因子等免疫功能。进行肌内注射免疫,抗原在骨骼肌细胞中表达,肌肉组织可长期表达蛋白质,其应答水平可维持较长时间[15-19]。
sIgA是黏膜免疫应答发生的重要标志。IgG是评价系统免疫应答的重要指标和体液免疫应答产生的主要抗体。黏膜免疫后IgG抗体形成细胞主要进入血循环,并归巢至系统淋巴结或组织炎症部位。而sIgA抗体形成细胞归巢至黏膜效应部位,当再次遇到相同抗原时分泌大量sIgA。
鉴于合适的免疫途径对充分发挥疫苗的免疫效应至关重要。本研究结果显示,免疫后2、4、6和8周,口服灌胃组猪血清IgG、粪便sIgA和PBMC增殖水平均显著高于肌肉注射组,表明猪带绦虫TSO45W-4B-TSOL18融合基因重组双歧杆菌口服灌胃和肌肉注射均可诱导家猪产生系统免疫、黏膜免疫和细胞免疫,且口服灌胃优于肌肉注射,说明口服灌胃是较为合适的免疫途径。
[1] Ito A,Urbani C,Jiamin Q,et al. Control of echinococcosis and cysticercosis:a public health challenge to international cooperation in China[J]. Acta Trop,2003,86(1): 3-17.
[2] 张榕燕,李莉莎,林金祥. 猪带绦虫病和猪囊尾蚴病3例报告[J]. 中国寄生虫学与寄生虫病杂志,2007,25(4): 319.
[3] 周必英,刘美辰,杨凤娇.猪带绦虫TSOL18基因在长双歧杆菌中的表达[J].遵义医学院学报,2014,37(3):283-285,289.
[4] 刘美辰,贺莉芳,周必英. 猪带绦虫基因工程疫苗研究进展[J]. 中华地方病学杂志,2014,33(2):233-236.
[5] 刘美辰,贺莉芳,周必英. 重组双歧杆菌研究进展[J]. 中国病原生物学杂志,2014,9(5): 470-472.
[6] 周必英. 猪带绦虫重组抗原研究进展[J]. 中国人兽共患病学报,2014,30(4): 418-422.
[7] 骆学农,郑亚东,窦永喜,等. 猪带绦虫TSO45W-4BX与猪CD58分子在大肠埃希菌中的联合表达[J]. 中国寄生虫学与寄生虫病杂志,2006,24(4): 285-289.
[8] Ding J,Zheng Y,Wang Y,et al. Immune responses to a recombinant attenuatedSalmonellatyphimuriumstrain expressing aTaeniasoliumoncosphere antigen TSOL18[J].Comp Immunol Microbiol Infect Dis,2013,36(1): 17-23.
[9] Luo X N,Zheng Y D,Hou J L,et al. Protection against AsiaticTaeniasoliuminduced by a recombinant 45W-4B protein[J]. Clin and Vaccine Immunol,2009,16(2):230-232.
[10] Cai X P,Yuan G L,Zheng Y D,et al. Effective production and purification of the glycosylated TSOL18 antigen,which is protective against pig cysticercosis[J]. Infect Immun,2008,76(2): 767-770.
[11] 周必英,刘美辰,贺莉芳. 猪带绦虫重组Bb(pGEX-TSO45W-4B-TSOL18)疫苗的构建及鉴定[J]. 中国病原生物学杂志,2014,9(4): 289-292,298.
[12] 周必英,周泠,刘美辰,等. 猪带绦虫TSO45W-4B-TSOL18融合基因在大肠埃希菌ArcticExpress(DE3)中的表达、纯化和兔抗血清的制备[J]. 中华地方病学杂志,2013,32(6): 619-624.
[13] 周必英,刘美辰,杨凤娇. 猪带绦虫TSO45W-4B-TSOL18融合基因在长双歧杆菌中的表达[J]. 中国人兽共患病学报,2014,30(9): 889-892.
[14] 周必英,刘美辰,杨凤娇. 猪带绦虫重组双歧杆菌疫苗人工传代后的稳定性研究[J]. 中国病原生物学杂志,2014,9(8): 710-712.
[15] 万小波,周必英. 寄生虫疫苗免疫途径的研究现状[J]. 国际医学寄生虫病杂志,2014,41(3):186-190.
[16] Newberry R D,Lorenz R G. Organizing a mucosal defense[J]. Immunol Rev,2005,206(1): 6-21.
[17] 刘延庆,刘晋平,殷国荣,等. STAg不同途径免疫对小鼠弓形虫感染保护作用[J]. 中国公共卫生,2009,25(1): 71-72.
[18] 刘美娜,殷国荣,孟晓丽,等. 弓形虫STAg不同途径免疫小鼠诱导的黏膜免疫和系统免疫应答动态变化[J]. 中国病原生物学杂志,2010,5 (4): 266-269.
[19] 殷丽天,曹蕾,王海龙,等. 重组弓形虫热休克蛋白鼻内及皮下免疫小鼠诱导的免疫应答比较[J]. 中国生物制品学杂志,2011,24(6): 689-692.
[收稿2015-02-11;修回2015-03-27]
(编辑:谭秀荣)
Immune responses induced by recombinant bifidobacterium of TSO45W-4B-TSOL18 fusion gene ofTaeniasoliumin domestic pigs
ZhouBiying,LiuMeichen,WanXiaobo
(Department of Parasitology, Zunyi Medical University, Zunyi Guizhou 563099,China)
Objective To observe the immune responses induced by recombinant bifidobacterium of TSO45W-4B-TSOL18 fusion gene ofTaeniasoliumin domestic pigs through oral administration and intramuscular injection.Methods Twelve healthy 40-day-old domestic pigs were randomly divided into 3 groups with each group of 4 pigs:oral administration group giving 1011CFU recombinant bifidobacterium dissolved in 50 ml bifidobacterium liquid medium, MRS; intramuscular injection group giving 1011CFU recombinant bifidobacterium dissolved in 10 ml MRS; oral administration control group giving 50 ml MRS.All groups were immunized twice,once every two weeks. On 0th,2th,4th,6thand 8thweek after immunization, the sera was collected from precaval vein to detect the level of immunoglobulin G (IgG) using enzyme linked immunosorbent assay (ELISA). Peripheral blood lymphocytes (PBMC) were prepared to detect the level of proliferation using methyl thiazolyl tetrazolium (MTT) method. The feces of pig were collected to detect the level of secreted immunoglobulin A (sIgA) using ELISA.Results The level of IgG in sera increased during 2~8thweek, and reached the higher level in 6thweek. The level of PBMC proliferation increased during 2~8thweek, and reached the higher level in 6thweek. The level of sIgA in feces increased during 2~8thweek ,and reached the higher level in 4thweek, compared with those in preimmune and MRS control groups,the difference was significant(P<0.05). The level of sera IgG, PBMC proliferation or fece sIgA in oral administration group was significantly higher than those in intramuscular injection group (P<0.05).Conclusion The recombinant bifidobacterium of TSO45W-4B-TSOL18 fusion gene ofTaeniasoliumcould induce effective immune responses in domestic pigs,and the immune effects in oral administration group is better than those in intramuscular injection group.
bifidobacterium; TSO45W-4B-TSOL18 fusion gene; recombinant bifidobacterium;immune response
国家自然科学基金资助项目(NO:81160206);贵州省科技厅科学技术基金资助项目(NO:黔科合J[2014]2178)。
周必英,女,博士,教授,硕士生导师,病原生物学术带头人,现任遵义医学院寄生虫学教研室副主任。贵州省医学会热带病与寄生虫学分会委员,《重庆医科大学学报》《遵义医学院学报》审稿人。主要从事寄生虫感染与免疫研究,获国家级、省市级等各级科研项目近10项,发表科研论文40余篇,获贵州医学科技奖三等奖1项。
R383.32
A
1000-2715(2015)02-0117-04
