苦瓜提取物对糖尿病大鼠肾皮质Na+,K+-ATP酶活性的影响
2015-06-12翟玉荣莫镇涛靳俊峰李意奇李志梅
翟玉荣,刘 波,莫镇涛,靳俊峰,李意奇,李志梅
(遵义医学院珠海校区 药理学教研室,广东 珠海 519041)
专题研究
苦瓜提取物对糖尿病大鼠肾皮质Na+,K+-ATP酶活性的影响
翟玉荣,刘 波,莫镇涛,靳俊峰,李意奇,李志梅
(遵义医学院珠海校区 药理学教研室,广东 珠海 519041)
目的 探讨苦瓜提取物(MCE)对糖尿病肾病(DN)的保护作用及对肾皮质Na+,K+-ATP酶活性的影响。方法 链脲佐菌素(STZ)诱导大鼠糖尿病模型,随机将大鼠分为正常组,模型组,MCE预防给药低、高剂量组,MCE治疗给药低、高剂量组。测定各组大鼠24 h尿蛋白量、血肌酐、尿素氮浓度及肾皮质Na+,K+-ATP酶活性的变化,HE染色观察肾脏病理学变化。结果 与正常组相比,模型组大鼠的24 h 尿蛋白量、血清肌酐、尿素氮浓度及Na+,K+-ATP酶活性均明显升高(P<0.05);与模型组相比,MCE各给药组大鼠的24 h 尿蛋白量、血清肌酐、尿素氮浓度及肾皮质Na+,K+-ATP酶活性均明显降低(P<0.05或P<0.01),且MCE各给药组均在不同程度上减轻了DN组大鼠的肾小球结构模糊、细胞数增多等病理变化;相同剂量下与治疗给药组比较,MCE预防给药组24 h 尿蛋白、血清肌酐、尿素氮浓度及肾皮质Na+,K+-ATP酶活性均下降更为明显(P<0.05),减轻病理变化也更显著。结论 苦瓜提取物对DN大鼠的肾损伤有一定保护作用,能阻遏DN大鼠肾皮质Na+,K+-ATP酶活性的升高。
苦瓜提取物;糖尿病肾病;大鼠;Na+,K+-ATP酶
糖尿病肾病( Diabetic nephropathy,DN)是糖尿病( diabetes mellitus,DM)最常见的微血管并发症之一[1],也是导致终末期肾病的首要原因[2]。迄今仍无满意的防治方法,主要采用降糖、调脂、降压等对症治疗为主。因此,探索防治DN治疗药物具有重要意义。苦瓜为葫芦科苦瓜属植物,是我国传统的一种药食两用植物,性味苦寒,具有辅助降血糖、降血脂、抗氧化、增强免疫力及预防肥胖等保健功能[3]。有文献表明苦瓜皂苷对糖尿病肾病有一定保护作用[4],但苦瓜提取物(MomordicacharantiaL.extract,MCE)对早期糖尿病大鼠的肾脏保护作用疗效如何及作用机制是否与Na+,K+-ATP酶活性有关尚不清楚。本研究采用链脲佐菌素诱导2型糖尿病大鼠肾损伤模型,观察MCE对糖尿病大鼠的肾脏保护作用,并通过观察其对肾皮质中Na+,K+-ATP酶活性影响,初步探讨苦瓜提取物对糖尿病肾病的保护作用机制。
1 材料与方法
1.1 动物 选用SPF级健康雄性SD大鼠60只,体重200~250g,购于广东省医学实验动物中心,合格证号scxk(粤)2011-0002。
1.2 药品与试剂 苦瓜提取物购于福州日冕科技开发有限公司,产品标准号:Q/RM0513-KG-2011,苷与苦瓜苷1%;链脲佐菌素(Streptozotocin,STZ)购自美国Sigma公司;考马斯亮兰蛋白、尿蛋白及Na+,K+-ATP酶的测试盒购于南京建成生物公司;One Touch自动血糖分析仪及配套试纸由美国强生公司生产;SN-6930A型液闪仪与SN-6100型γ计数器购自上海核所日环光电公司。
1.3 糖尿病模型制备、分组及给药 60只大鼠按体重随机分为正常组,模型组,苦瓜提取物预防给药低、高剂量组,苦瓜提取物治疗给药低、高剂量组。每组10只大鼠。各组大鼠适应性喂养1周后,禁食12 h,除正常组外,其余各组大鼠用1% STZ溶液(STZ溶解于0.1 mmol/L 4 ℃枸橼酸缓冲液中,调pH=4.2~4.5,现配现用),按60 mg/kg腹腔注射,72 h后分别取上述各组大鼠尾尖血测血糖,1次/d,连续3 d,以空腹血糖≥16.7 mmol/L者,视为糖尿病大鼠模型已制成。正常对照组给予同等容量的枸橼酸溶液腹腔注射。苦瓜提取物预防给药低(100 mg/kg)、高(300 mg/kg)剂量组于造模前2周开始灌胃给药,1次/d,连续6周;治疗给药低、高剂量组于成模后第3天开始给药,给药剂量及方法同预防给药组,连续给药4周;正常和模型组灌服相同体积的蒸馏水。各组均给予普通饲料,自由饮水。
1.4 一般项目观察 包括大鼠的精神状态、毛色、饮食量、尿量、体重等。
1.5 HE染色肾脏病理学观察 取左肾“去包膜”置于40g/L多聚甲醛固定,石蜡包埋,制成4μm切片行HE染色,光镜下观察病理变化。
1.6 尿蛋白、血清肌酐及尿素氮测定 实验结束前日用代谢笼收集24h尿液,以放射免疫法测定24 h尿蛋白量,具体步骤按照试剂盒说明书进行。实验结束后,动脉取血,室温下凝固,以1509×g离心10 min,取血清置-20 ℃保存备用,测血清肌酐和尿素氮。血清肌酐、尿素氮由我院附属医院生化检验室测定。
1.7 肾皮质Na+,K+-ATP酶活性的测定 取0.3g肾皮质置于玻璃皿中,加入9倍体积的冷生理盐水,在冰浴条件下剪碎并制成匀浆,取浓度为100g/L的组织匀浆以1593×g离心15 min,留上清液待测。 Na+,K+-ATP酶活性每毫克肾皮质组织总蛋白中Na+,K+-ATP酶每小时分解ATP产生的无机磷(Pi)的量表示(pmol.mg-1.h-1)。样品中总蛋白含量用考马斯亮兰法测定(按试剂盒说明书操作)。
2 结果
2.1 各组大鼠一般情况 正常大鼠毛色光滑,反应灵敏,体重增长较快;模型组大鼠出现多饮多食多尿,毛色晦暗,明显消瘦,行动迟缓,体重减轻或增长缓慢。MCE预防给药低、高剂量组大鼠的精神状况良好,体重减轻,反应灵敏度较正常组稍差;MCE治疗给药高、低剂量组大鼠的精神状况,体重变化及反应灵敏度与预防给药组情况相近,但较正常组稍差。
2.2 HE染色光镜下肾组织病理形态学观察 正常组大鼠肾小球结构清楚,肾小球血管袢薄而清晰,无系膜增生,肾小球内细胞数没有明显增加,其周肾小管基本正常;模型组大鼠肾小球结构模糊,呈分叶状,系膜细胞增生,肾小球内细胞数明显增加。MCE各给药组较模型组相比,上述改变有所减轻,周围肾小管结构相对正常,MCE预防给药与治疗给药同剂量组相比,MCE预防给药组病理变化减轻较为明显(见图1)。
2.3 MCE对糖尿病大鼠尿蛋白、血清肌酐和尿素氮的影响 与正常组相比,模型组大鼠24 h尿蛋白含量、血清肌酐及尿素氮浓度均明显升高(P<0.01)。与模型组相比,MAG预防及治疗给药各组的24 h尿蛋白、血清肌酐及尿素氮浓度均显著下降(P<0.05或P<0.01),相同剂量下,MAG预防给药较治疗给药下降更为明显(P<0.05,见图2)。
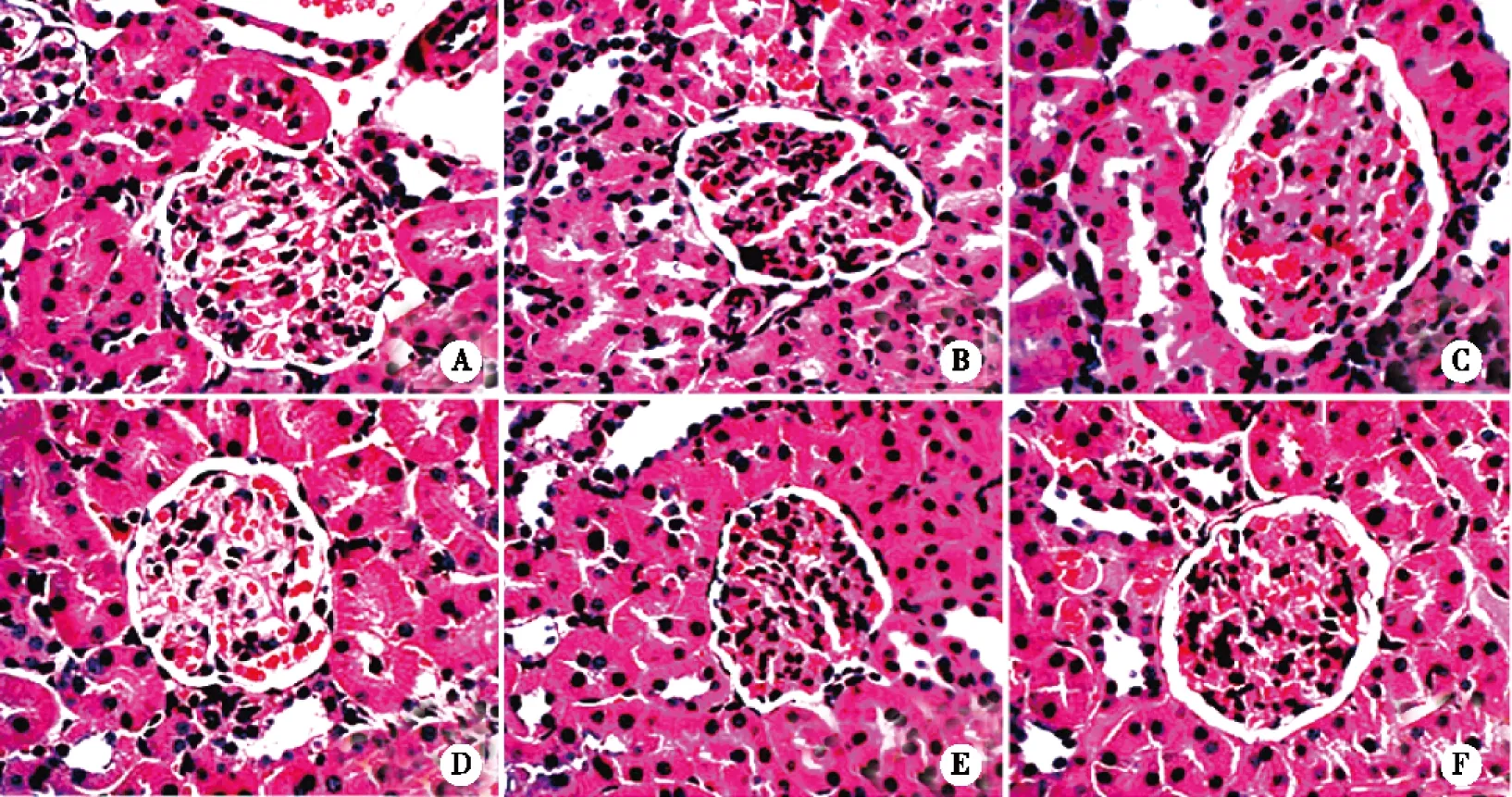
A:正常组;B:模型组;C:MC预防给药100 mg/kg;D:MCE预防给药300 mg/kg;E:MCE治疗给药100 mg/kg;F:MCE治疗给药300 mg/kg。
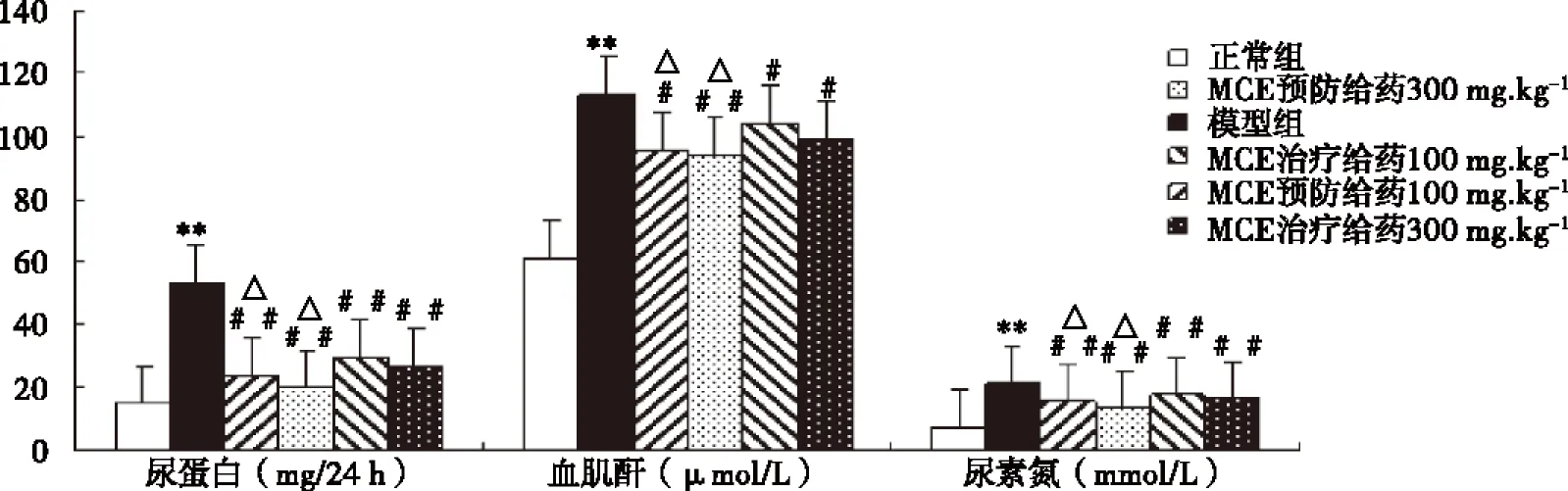
模型组与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;相同剂量下MCE预防与治疗给药组比较,△P<0.05(n=10)。
2.4 MCL对糖尿病大鼠肾皮质Na+,K+-ATP酶的影响 与正常组相比,模型组肾皮质Na+,K+-ATP酶活性显著升高(P<0.01)。与模型组相比,MAG预防及治疗给药各组Na+,K+-ATP酶活性均明显降低(P<0.01)。相同剂量下,MAG预防比治疗给药Na+,K+-ATP酶活性下降更显著(P<0.01,见图3)。
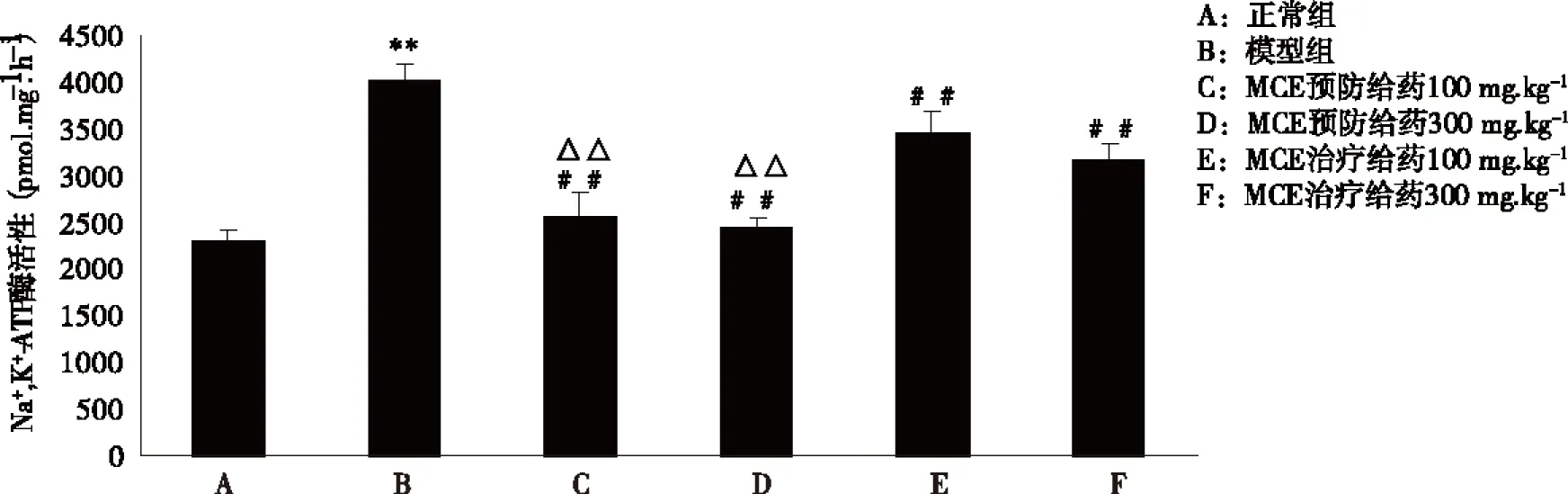
模型组与正常组比较,**P<0.01;与模型组比较,##P<0.01;同剂量下MCE预防与治疗给药组比较,△△P<0.01(n=10) 。
3 讨论
DN以肾小球损害为主,当滤过膜的通透性增加,会引起明显蛋白尿,蛋白尿的发展与糖尿病病程进展关系密切,即使严格控制血糖,随着2型糖尿病进展仍有1.7%的患者伴有蛋白尿出现[5]。一旦进入大量尿蛋白期,肾功能损害的速度加快,且不可逆转,所以及时有效的治疗对于阻止、延缓DN的进展十分重要[6]。血肌酐和尿素氮在肾小球滤过率降低后,其血中浓度会升高,因此尿蛋白、血肌酐和尿素氮是诊断肾损伤的常用检测指标,也是治疗效果的直接判断指标。本实验中,与正常组相比,模型组大鼠24 h尿蛋白、血肌酐和尿素氮的浓度均明显升高;光镜病理学观察也显示模型组大鼠肾小球结构模糊、细胞数增多等病理变化,上述变化说明糖尿病模型4周时已有肾脏损伤。苦瓜提取物预防和治疗给药各组均能明显降低DN模型大鼠的24 h尿蛋白、血肌酐和尿素氮的浓度,且不同程度上减轻了DN大鼠的肾小球结构模糊、细胞数增多等病理变化,提示苦瓜提取物对糖尿病引起的肾损伤有一定的保护作用,但预防给药组要优于治疗给药组。
Na+,K+-ATP酶在肾脏中分布广泛,主要位于肾小管上皮细胞的基膜上,是钠、钾、葡萄糖和氨基酸等物质转运、肾小管水重吸收及物质交换的主要动力,也是维持内环境稳定的基础。有研究表明,在STZ诱导的糖尿病大鼠肾损伤早期,肾小管各节段Na+,K+-ATP酶活性都显著增强[7-9],而在DN肾功能失代偿期,肾组织Na+,K+-ATP酶活性会明显下降[9-10]。这些研究表明肾小管的Na+,K+-ATP酶活性变化可能与糖尿病肾病的发病机制有关。本研究显示,STZ诱导的糖尿病大鼠4周时,肾皮质Na+,K+-ATP酶活性显著升高,与上述报道一致[7-9],这可能是血糖的升高对肾小管管周膜的刺激,使Na+,K+-ATP酶活性代偿性升高,此时,肾脏功能还处于代偿期的原因。MCE预防给药6周和治疗给药4周,明显抑制造模导致肾皮质Na+,K+-ATP酶活性的显著升高,这可能是MCE降低血糖,从而减轻了高血糖对肾皮质Na+,K+-ATP酶的刺激,使肾皮质Na+,K+-ATP酶活性下降。至于MCE减轻DN肾损伤作用的机制是否与其稳定肾皮质Na+,K+-ATP酶活性有关,在此实验基础上还有待于进一步深入研究。
[1] 张婷,高彦彬.中医药治疗糖尿病肾病研究进展[J].世界中医药,2014,9(5):679-683.
[2] 卢叶,李海明.基于指南之糖尿病肾病的诊疗[J].上海医药,2013,34(18):6-9.
[3] 陈敬鑫,张子沛,罗金凤,等.苦瓜保健功能的研究进展[J]. 食品科学,2012,33(1):271-275.
[4] 关悦,李扬.苦瓜总皂苷对糖尿病大鼠肾保护作用及其机制研究[J].中国食物与营养,2012,18(9):73-77.
[5] Zhou L,Dong H,Huang Y,et al.Hu-Lu-Ba-wan Attenuates Diabetic Nephropathy in Type 2 Diabetic Rats through PKC-α/NADPH Oxidase Signaling Pathway[J].Evid Based Complement Alternat Med,2013,doi:10.1155/2013/504642.
[6] 魏玉娇,金智生,朱真灵,等. 红芪多糖对糖尿病肾病db/db小鼠肾脏保护作用及其对肾组织PKCα与VEGF表达的影响[J].北京中医药大学学报,2014,37(2):116-120.
[7] Scherzer P,Popovter M M. Segmentai iocaiization of mRNAs encoding Na+-K+-ATPase α1and β1-subunits in diabetic rat kid-neys using RT-PC[J].Am J Physioi Renai Physioi,2002,282(3):F492 - F500.
[8] 沈东波,高原,杜飞.灯盏花素在大鼠糖尿病早期对近球小管钠钾ATP酶活性的影响[J].中国药理学通报,2007,23(7):917-920.
[9] 罗蕾,刘 红. 灯盏花素对2型糖尿病大鼠肾脏肥大的抑制作用与机制研究[J].时珍国医国药,2009,30(1):86-87.
[10] 吴铎,赵汝霞,吕俊华.小檗碱对高脂高糖饮食与链脲佐菌素联合诱致糖尿病大鼠肾脏损伤的保护作用[J].中国老年学杂志,2012,32(9):1878-1880.
[收稿2015-01-28;修回2015-02-26]
(编辑:谭秀荣)
Effects ofMomordicacharantiaL.extract on renal cortical Na+,K+- ATPase activity in diabetic rats
ZhaiYurong,LiuBo,MoZhentao,JinJunfen,LiYiqi,LiZhimei
(Department of Pharmacology, The Zhuhai Campus of Zunyi Medical University, Zhuhai Guangdong 519041, China)
Objective To investigate the protective effects ofMomordicacharantiaL.extract (MCE) on renal injury and the effects of MCE on renal cortical Na+,K+-ATPase activity in diabetic rats. Methods The diabetic nephropathy (DN) model was induced by intraperitoneal injection of streptozotocin(STZ) in the rats. Rats were randomly divided into the normal control, model, provention and treatment of MCE low- and high-dose groups.The 24-h urine protein quantity, serum creatinine (Scr), blood urea nitrogen (BUN) and the renal cortical Na+,K+-ATPase activity were detected. Renal pathology was observed via HE staining.Results Compared with normal control group, the 24-h urine protein quantity, Scr, BUN and the renal cortical Na+,K+-ATPase activity in model group were significantly increased (P<0.05). However, compared with model group, the above-mentioned indexes were obviously decreased and the renal pathological changes were also remarkably improved in MCE provention and treatment groups. In the same MCE dose, compared with MCE treatment group, the 24-h urine protein quantity, Scr, BUN, the renal cortical Na+,K+-ATPase activity and the renal pathologacal changes were more significantly improved in MCE provention group (P<0.05). Conclusion MCE have protective effects on renal injury and inhibit the increased renal cortical Na+, K+-ATPase activity in DN rats.
MomordicacharantiaL.extract; diabetic nephropathy; rat; Na+, K+-ATPase
贵州省卫生厅科学技术基金资助项目(NO:gzwk2009-1-067);遵义医学院中青年启动基金资助项目(NO:F-497)。
R285.5
A
1000-2715(2015)02-0121-04
