2014年滨州市猪伪狂犬病血清抗体检测与分析
2015-06-11吕素芳张文通刘吉山李书光郭广君张松林王文秀
李 峰,吕素芳,张文通,刘吉山,李书光,郭广君,张松林,王文秀
(1.山东省滨州畜牧兽医研究院,山东滨州256600;2.山东绿都生物科技有限公司,山东滨州256600)
猪伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(PRV)感染引起的猪场常见传染病之一,能够引起种猪繁殖障碍,新生仔猪发热、震颤及急性死亡,生长猪、育肥猪呼吸道症状等。其临床症状取决于感染猪只的年龄、感染途径、感染毒株的毒力和自身免疫情况等[1-2]。该病在世界范围内发生,特别是养殖密度比较大的国家,包括南美洲、欧洲。疫苗免疫-检测净化成为根除PRV 的有效手段,其实施前提是对区域内猪群PRV免疫和感染情况进行正确判断[3]。本研究对滨州部分养猪场的猪进行了随机采样和血清抗体检测,以期对该市相关情况进行评判,合理指导该病防控。
1 材料与方法
1.1 材料
1.1.1 血清样品 采集自滨州市惠民、邹平、滨城、沾化等县区43家不同规模自繁自养场能繁母猪和育肥猪血样453份,其中能繁母猪血样303份,育肥猪血样150份(表1)。
1.1.2 试剂盒 猪伪狂犬病病毒gB 抗体ELISA 检测试剂盒由山东省滨州预防兽医学与动物生物技术重点开放实验室生产,批号:2014061301;猪伪狂犬病病毒gE 抗体ELISA 检测试剂盒由武汉科前动物生物制品责任公司生产,批号:20140706。
1.2 方法
1.2.1 血样采集和调查 耳缘静脉或前腔静脉采血,3 mL/头~5 mL/头,常规方法分离血清。采样时,同时对该场伪狂犬病疫苗免疫情况进行调查登记。
1.2.2 PRV gB抗体检测 采取ELISA 检测法,按照试剂盒说明书进行。试验有效性判断:阴性对照OD450nm 值≤0.2;阳性对照OD450nm 值≥0.4。临界值(CO)的计算:临界值=0.18+阴性对照均值;阴性对照OD450nm 值大于0.2 时应舍弃,所有阴性对照OD450nm 值都大于0.2 时须重复试验;阴性对照低于0.05 时以0.05 计算。结果判定:检测样品OD450nm 值≥临界值,判定该检测样品为阳性;检测样品OD450nm 值<临界值,判定该检测样品为阴性。
1.2.3 PRV gE 抗 体 检 测 采 取 阻 断ELISA 检 测法,按照试剂盒说明书进行。结果判定:试验成立的条件是阴性对照孔平均OD630nm 值与阳性对照平均OD630nm 值之差≤0.3。S=样品孔OD630nm值,N=阴性对照孔平均OD630nm 值。若S/N 比值≤0.35,样品判为gE 抗体阳性。若S/N 比值≤0.4但≤0.35,样品判为可疑。该样品必须重测,如结果相同,则判为gE抗体阳性。若S/N 比值>0.4,样品判为gE抗体阴性。
2 结果
2.1 疫苗免疫情况统计
对随机采样的43个自繁自养场PRV 疫苗免疫情况进行统计,35个猪场使用过伪狂犬病疫苗,约占调查场数的81.40%;整体免疫密度达到91.46%。按照村养能繁母猪数量是否≥30头为界统计发现,从免疫场数和免疫密度来看,规模≥30头的猪场明显优于<30头的猪场(表2)。
2.2 PRV gB抗体检测情况
共检测样品453份,其中332份阳性,总体阳性率约为73.29%。按照能繁母猪、育肥猪分别进行了统计分析,并对能繁母猪抗体阳性率分布区间进行了统计。
2.2.1 母猪PRV gB抗体检测结果 采集的303份血清中229份为阳性,总体阳性率为75.58%。39个猪场有样品检测结果为阳性,占猪场总数的90.70%。其中35个免疫猪场的样品检测阳性率为77.08%,明显好于非免疫猪场68.0%的阳性率(表3)。
2.2.2 育肥猪PRV gB抗体检测情况 采集的150份血清中103份检测为阳性,总体阳性率为68.67%。24个猪场有样品检测结果为阳性,占猪场总数的80.0%(表4)。
2.2.3 PRV gB抗体阳性率统计分析 对采样的43个猪场能繁母猪伪狂犬病病毒gB抗体阳性率进行了统计,其中阳性率高于90%猪场为19家,占采样猪场总数的44.19%;阳性率高于80%的猪场总数为25家,约占采样猪场总数的58.14%;低于70%,即免疫保护率不合格的有11家猪场,约占采样猪场总数的25.58%(表5)。
2.3 PRV gE抗体检测情况
2.3.1 母猪PRV gE抗体检测结果 经检测,303份血清样品中有77份为伪狂犬病病毒gE抗体阳性,阳性率为25.41%;阳性样品来自于20个猪场,猪场阳性率为46.51%。按照是否免疫及能繁母猪规模划分为4个组别进行了统计分析,其中免疫猪场中养殖规模能繁母猪小于30 头的猪场阳性率最低,为35.29%,与非免疫组差异不显著;免疫猪场中养殖规模能繁母猪大于等于30 头的样品阳性率最低,为22.99%,与非免疫组差异显著(表6)。
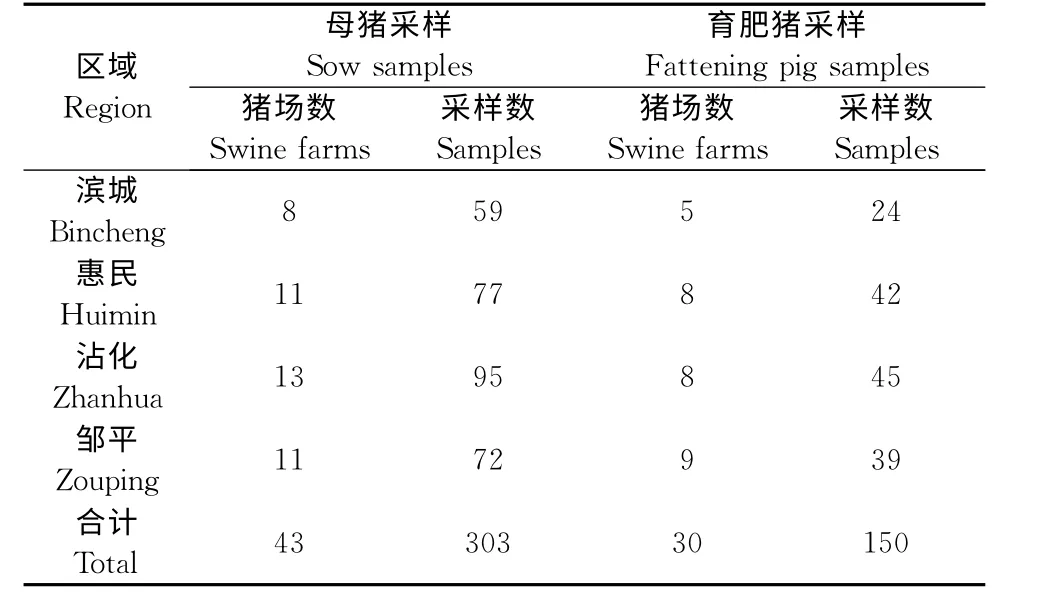
表1 样品来源及分布情况Table 1 The sample source and distribution

表2 PRV疫苗免疫情况统计表Table 2 Statistics of PRV vaccine immunization

表3 母猪PRV gB抗体检测结果统计表Table 3 Statistics results of sow PRV gB antibody detection

表4 育肥猪PRV gB抗体检测结果统计表Table 4 Statistics results of PRV gB antibody detection in fattening pigs
2.3.2 育肥猪PRV gE抗体检测情况 150份育肥猪血样中40份样品检测结果为PRV gE抗体阳性,阳性率为26.67%;13个猪场检出阳性,猪场阳性率为44.33%。样品阳性率和猪场阳性率两个指标,免疫猪场均明显优于非免疫猪场(表7)。
2.3.3 不同猪场PRV gE抗体阳性率分析 根据采样不同区县对检测结果统计发现,4个县区PRV gE抗体猪场阳性率在36.36%~55.55%,样品阳性率介于20.78%~32.20%之间,不同区县之间具有明显差异(表8)。

表5 母猪PRV gB抗体阳性率分布情况表Table 5 PRV gB antibody positive rate distribution in sows

表6 母猪PRV gE抗体检测结果统计表Table 6 Statistics results of sow PRV gE antibody detection

表7 育肥猪PRV gE抗体检测结果统计表Table 7 Statistics results of PRV gE antibody detection in fattening pigs of different regions

表8 育肥猪PRV gE抗体检测结果统计表Table 8 Statistics results of PRV gE antibody detection of fattening pigs
3 讨论
2014年度滨州市不同县区43家不同规模自繁自养场能繁母猪PRV gB抗体猪场阳性率高于70%的猪场占比为74.42%,样品阳性率为75.58%,较2012年和2013年检测数据略好[4]。育肥猪样品阳性率为68.67%,低于同区域能繁母猪阳性率。这与戴爱玲等[5]的调查结果相同,他们发现种猪免疫抗体阳性率明显高于育肥猪,且育肥猪免疫抗体阳性率出现明显的波动,其中130日龄~160日龄阳性率最高,60日龄~80日龄次之,80~130日龄时阳性率最低,这可能与随着日龄增长,猪体内母源抗体逐渐消失,120日龄左右基本消失有关。本研究表明滨州市各区域PRV gB抗体阳性率低于2013年全国88.05%的平均水平[6]。分析认为,PRV gB抗体滴度与PRV 疫苗免疫频次和密度相关。经调查,该市母猪PRV 多采取跟胎免疫的疫苗免疫程序,即在产前30日龄~35日龄免疫,免疫间隔时间过长,容易产生空白期。
2014年度滨州市不同县区43家不同规模自繁自养场能繁母猪PRV gE 抗体猪场阳性率为46.51%,样品阳性率为25.41%;育肥猪PRV gE 抗体猪场阳性率为44.33%,样品阳性率为26.67%。与张三军[8]报道相似。较张显浩等[7]报道的猪场阳性率38.1%,血清样品野毒抗体阳性率14.96%相比均要偏高,可见该区域PRV 野毒感染较为严重,呈地方流行性。对本区域而言,有必要采取一定的防控及净化措施。统计发现,能繁母猪与育肥猪PRV gE抗体阳性率并不直接相关。其病毒感染与猪场生物安全管理、区域病毒变异及猪群自身免疫水平相关。这与有关报道结论相吻合[9]。控制该病的关键在于母猪的免疫质量,做好母猪伪狂犬病病毒野毒抗体检测,及时清除带毒猪,并结合进行免疫抗体的监测和评估,对伪狂犬病的控制和净化至关重要[10]。
本试验掌握了该市PRV 疫苗免疫效果和野毒感染的基本情况,为该市制定区域性防控和净化方案提供参考资料。猪伪狂犬病病毒基因缺失疫苗和gE ELISA检测试剂盒的配合应用,为猪伪狂犬病净化提供了可行的技术方案,并得到了充分实施和验证[11-14]。该市应提高对该病的重视,选择优质高效疫苗,提高免疫密度,改进免疫程序。建议母猪采取普免措施,3次/年~4次/年;商品猪采取1日龄~3日龄滴鼻,30 日龄肌注的两次免疫程序。选择gB ELISA和gE ELISA 检测试剂盒,对后备和种猪猪群加强监测,对不产生免疫抗体和gE抗体阳性的种猪和后备猪坚决予以淘汰,并持续改进生物安全管理措施。
[1] Schmidt J,Gerdts V,Beyer J,et al.Glycoprotein D-independent infectivity of pseudorabies virus results in an alteration of in vivo host range and correlates with mutations in glycoproteins B and H[J].J Virol,2001,75(21):10054-10064.
[2] Bo Dong,Dante S.An overview of live attenuated recombinant pseudorabies viruses for use as novel vaccines[J]J Immunol Res,2014,824630.doi:10.1155/2014/824630
[3] Verpoest S,Cay A B,De Regge N.Molecular characterization of Belgian pseudorabies virus isolates from domestic swine and wild boar[J].Vet Microbiol,2014,172(1-2):72-77.
[4] 庄金秋,李 峰,梅建国,等.2012-2013年山东滨州及周边地区3种猪病血清抗体检测与统计分析[J].养猪,2014(3):128.
[5] 戴爱玲,凌明发,黄思琼,等.某规模化猪场猪伪狂犬gE和gB抗体的检测与分析[J].安徽农业科学,2014,42(32):11324-11325,11375.
[6] 杨正玉,汤细彪,董 超,等.2013年全国规模化猪场主要疫病血清学调查分析[J].养殖与饲料,2014(9):6-8.
[7] 张显浩,陈瑞爱,李 冰,等.2012年-2013年我国集约化猪场猪伪狂犬病病毒感染情况的调查[J].动物医学进展,2015,36(3):133-6.
[8] 张三军.某猪场伪狂犬野毒感染情况跟踪调查及分析[J].黑龙江畜牧兽医,2015(4):86-88.
[9] 焦显芹,杜红喜,贺纪云,等.我国规模化猪场伪狂犬病野毒感染规律的调查[J].畜牧与兽医,2014,46(11):92-96.
[10] 毕峻龙,杨培昌,肖 俊,等.2009年-2013年云南省楚雄地区猪伪狂犬病血清流行病学调查和防控措施研究[J].动物医学进展,2015,36(4):117-120.
[11] 占松鹤,刘 华,周迎春,等.安徽省规模化种猪场猪伪狂犬病血清学调查[J].动物医学进展,2015,36(3):124-127.
[12] 杨文萍,顾真庆,孙海凤,等.伪狂犬病毒流行毒株的抗原性和血清中和特性分析[J].畜牧与兽医,2014,46(10):11-14.
[13] 陈 冈,高 洪,严玉霖,等.云南省楚雄地区猪伪狂犬病病毒野毒株的血清学调查[J].黑龙江畜牧兽医,2014(3):106-108.
[14] 孙 华,宋忠旭,曾德芳,等.猪伪狂犬病野毒抗体不同检测单位的比对试验[J].湖北农业科学,2013,52(24):6124-6126.