犊牛睾丸生殖干细胞与支持细胞体外共培养体系的建立
2015-06-25齐晓楠杨文浩李华涛曹荣峰田文儒
张 倩,齐晓楠,杨文浩,丛 霞,李华涛,曹荣峰,田文儒
(青岛农业大学动物科技学院,山东青岛266109)
牛雄性生殖干细胞(male germ stem cell,mGSC)是位于睾丸曲细精管基膜上,具有增殖和分化潜能的干细胞,能够产生精子,将遗传信息传给后代[1]。Brinster R L等[2]将可育小鼠的雄性生殖干细胞移植到不育小鼠的睾丸中建立了精子发生。生殖干细胞技术的发展和应用,为克隆动物[3]、治疗雄性不育以及一些人类遗传疾病的细胞治疗[4]提供了新的机遇与途径。
目前mGSC的研究主要包括其分离纯化与鉴定,构建稳定增殖的mGSC体外培养体系[5]。Kanatsu-Shinohara M 等[6]首次建立了小鼠生殖干细胞体外长期培养体系,并成功获得了多能性生殖干细胞。然而,睾丸生殖细胞的研究多集中在鼠等小动物上,大动物生殖干细胞的体外研究比较困难,其分离和培养条件扔处于摸索阶段[7]。总结近年来的研究发现,牛睾丸生殖干细胞所采用的培养条件相差各异,且一直未建立稳定的体外长期培养体系。睾丸生殖干细胞的分离和培养是进行生殖干细胞功能活性鉴定和精子发生机理等研究的基础。因此,建立牛睾丸生殖干细胞体外培养体系具有重要科研意义。
目前体外培养睾丸生殖干细胞多采用将分离纯化到的生殖干细胞接种于支持细胞或成纤维细胞饲养层上的方法,同时培养基中成分复杂,多添加多种营养因子如干细胞生长因子(stem cell factor,SCF)、胶质细胞源性神经生长因子(glialcellline derived neurotrophic factor,GDNF)、分化诱导因子(differentiation inducing factor,DIF)和谷氨酰胺等[8],然而,生精干细胞的分离纯化不仅工作繁琐而且细胞密度选择仍需摸索,同时所添加的营养因子价格昂贵。为此,本试验探索了在培养基不添加营养因子的情况下,通过优化睾丸支持细胞密度的方法共培养睾丸生殖干细胞。
1 材料与方法
1.1 材料
1.1.1 样品采集 取初生犊牛睾丸,酒精消毒后用PBS或生理盐水冲洗,浸泡于含100mL/L双抗的PBS缓冲液中,于冰上2h内带回实验室。
1.1.2 主要试剂 胶原酶Ⅳ、胰蛋白酶为Sigma公司产品;DMEM F-12、新生牛血清为Gibco公司产品;AKP试剂盒为碧云天公司产品;100×青链霉素混合液为索莱宝公司产品;RNA提取试剂盒为原平皓公司产品;反转录试剂盒为TaKaRa公司产品;LightCycler®480SYBR GreenⅠ Master为Roche公司产品;试验用水均为超纯水,本试验中所用试剂除特别说明的以外,其余均为分析纯试剂。
1.2 方法
1.2.1 睾丸支持细胞和生殖干细胞混合细胞悬液的制备和培养 犊牛睾丸曲细精管上皮只有2种细胞,即睾丸支持细胞和睾丸生殖干细胞。获取犊牛睾丸曲细精管上皮细胞悬液采用两步酶消化法。除去附睾、脂肪垫、微血管及睾丸白膜,拨散睾丸组织小块后吸管吹打、静置离心获取曲细精管小段。1.5g/L胶原酶溶液室温振荡消化10min后1 000 r/min离心5min,然后2.5g/L胰酶溶液37℃消化5min,终止消化后400目筛网过滤,1 000r/min离心5min,弃上清后用含100mL/L胎牛血清的DMEM-F12重悬细胞,得到支持细胞和生殖干细胞的混合细胞悬液。
1.2.2 HE染色 待混合培养的犊牛睾丸曲细精管上皮细胞铺满培养皿时进行HE染色:用PBS清洗细胞后加入950mL/L乙醇室温固定15min;洗涤后加入苏木精室染8min,自来水蓝化10min后加入10mL/L伊红水溶液染色15s,水洗拍照。
1.2.3 AKP(碱性磷酸酶)染色鉴定 待混合培养的两种细胞出现细胞集落时进行AKP鉴定:洗涤细胞后用40mL/L多聚甲醛室温固定2min,洗弃固定液后加入2mL BCIP/NBT工作液(用2mL碱性磷酸酶显色缓冲液、6.67μL BCIP(300×)和13.3μL NBT(150×)配制 BCIP/NBT 染色工作液)充分覆盖样品,然后室温避光孵育1h,去除工作液后蒸馏水洗涤终止显色反应并拍照。
1.2.4 睾丸生殖干细胞的纯化及试验分组 为获取纯度较高的生殖干细胞悬液,对于原代培养的牛睾丸细胞在接种培养12h后吸取上清。此时支持细胞已贴壁完全,干细胞部分贴壁,因此获取的上清细胞悬液为睾丸生殖干细胞。以1 000r/min离心5min,调整细胞密度为1×104个/mL,准备接种与支持细胞上。选择不同生长密度的支持细胞共培养睾丸生殖干细胞。待纯化培养的第3代支持细胞分别长到约225、1 300、5 600个/cm2时接种密度为1×104个/mL的生殖干细胞细胞悬液1mL,用25 mL/L血清浓度的培养基培养。培养6d时,任选5个视野,记录集落数并计算集落与支持细胞的比例。
1.2.5 RT-PCR方法检测特异性基因SCF、OCT-4的表达 提取不同密度支持细胞共培养体系的总RNA,反转录后检测支持细胞的标志基因SCF和生殖干细胞OCT-4的表达(表1),引物由上海生工生物工程技术服务有限公司合成。反应条件为94℃5min;94℃30s,60℃30s,72℃20s,40个循环;72℃7min。
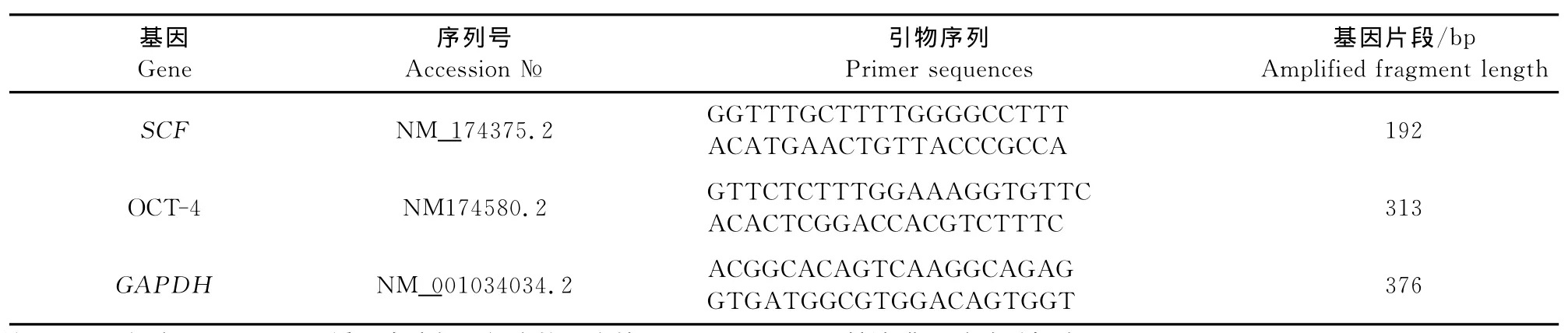
表1 引物列表Table 1 Primer information of RT-PCR
1.2.6 荧光定量PCR方法检测SCF、OCT-4mRNA表达 提取不同密度支持细胞共培养体系的总RNA,反转录后将合成的cDNA产物做一系列浓度梯度稀释,用 Roche Light Cycler 480Ⅱ荧光定量PCR仪进行定量反应,反应体系(10μL):ddH2O 3.6μL;SYBR Green Real-time PCR Master Mix 5μL;上、下游引物(20pmoL/μL )各0.2μL(表1);cDNA 1μL。反应条件:95℃ 10min;95℃10s,60℃20s,72℃30s,45个循环。反应结束后,各组细胞以GAPDH做为内参基因,采用2-ΔΔCT方法进行相对定量分析,其中ΔCT=目的基因CT-内参基因 CT;ΔΔCT= 试验组 ΔCT-对照组ΔCT[1]。
2 结果
2.1 犊牛睾丸支持细胞和生殖干细胞的形态特点
睾丸支持细胞贴壁后呈长条形,贴壁生长性强,在培养皿底壁逐渐生长成树枝状;支持细胞的细胞核多位于细胞基部,呈椭圆形,核仁明显,常有多个(图1和图2);HE染色后,支持细胞胞核嗜碱性弱,染色较浅(图2)。
睾丸生殖干细胞较支持细胞贴壁晚,常贴于支持细胞上或其附近,细胞贴壁后呈圆形或椭圆形;细胞核呈圆形或卵圆形,核质比较大;生精细胞常聚集生长,形成细胞团,随培养时间延长增殖能力强的生殖干细胞逐渐形成细胞集落;细胞集落亮度大,多呈圆形,突出生长(图1和图2);HE染色后,睾丸生殖干细胞细胞膜多数完整光滑,细胞核嗜碱性较强染色较深(图2)。
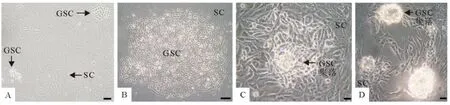
图1 犊牛睾丸支持细胞和生殖干细胞混合培养(A~B.Bar=100μm,C~D.Bar=30μm)Fig.1 The mixed culture of calf testis SCs and GSCs(A-B.Bar=100μm;C-D.Bar=30μm)
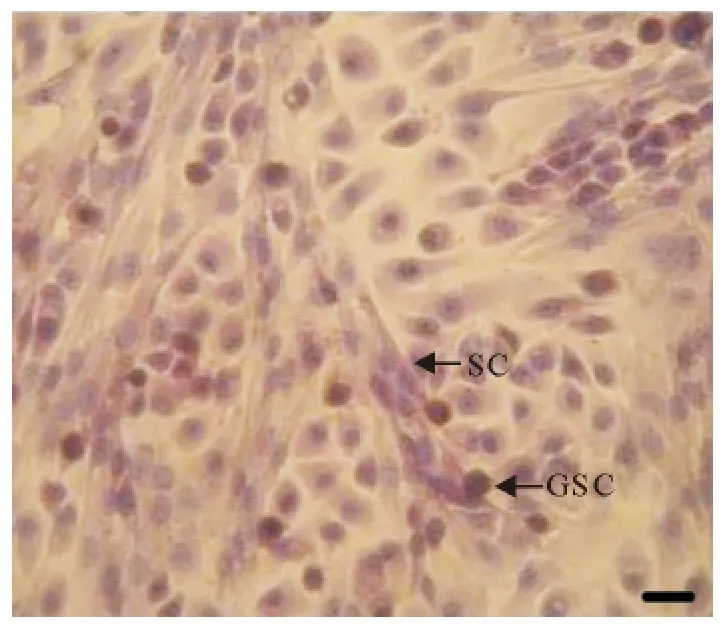
图2 犊牛睾丸支持细胞和生殖干细胞混合培养(HE,Bar=100μm)Fig.2 The mixed culture of calf testis SCs and GSCs(HE,Bar=100μm)
2.2 共培养体系中牛睾丸生殖干细胞的生长特征
培养睾丸曲细精管上皮细胞悬液12h后弃上清并将血清浓度换成25mL/L继续混合培养两种细胞,3d后生殖干细胞增殖较快,多集中生长并渐渐出现发亮的集落(图3a),4d后生殖干细胞生长进入指数阶段,于支持细胞上层生长旺盛(图3b),6d时集落数进一步增加(图3c),然而培养皿中细胞总量已很大,继续培养出现接触抑制。原代培养的混合细胞,当干细胞基本铺满上层时进行AKP染色,原代干细胞集落染色多呈辐射状(图4)。
2.3 不同密度的第3代支持细胞培养生殖干细胞
用低接种密度(225个/cm2)支持细胞共培养生殖干细胞时,长出的生殖干细胞集落比例最大,且干细胞集落纯度较大、集落体积也较大(图5a)。用中接种密度(1 300个/cm2)和高接种密度(5 600个/cm2)支持细胞共培养生殖干细胞时,支持细胞增长速度快于生精细胞,干细胞集落比例较低,体积较小,由于支持细胞细胞速度生长较快,铺满平皿后出现接触抑制(图5b和图5c)。

图3 犊牛睾丸曲细精管上皮细胞培养(Bar=100μm)Fig.3 The cultute of calf testis seminiferous tuble epithelial cells(Bar=100μm)
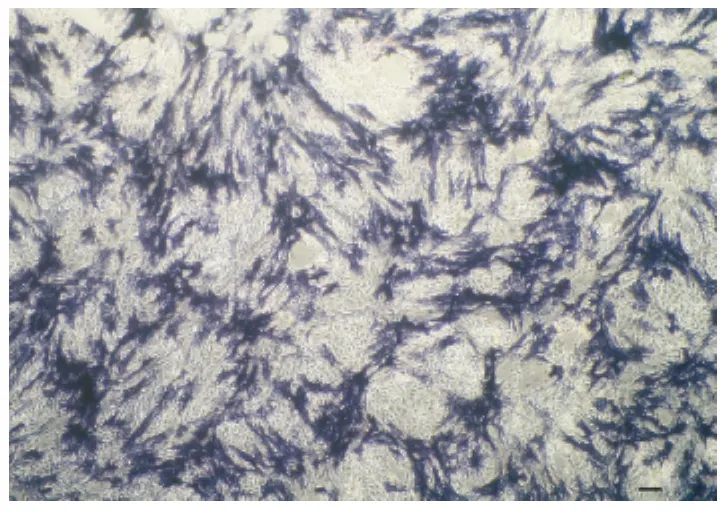
图4 犊牛睾丸生殖干细胞的AKP染色(Bar=60μm)Fig.4 The calf testis GSCs with AKP-staining(Bar=60μm)
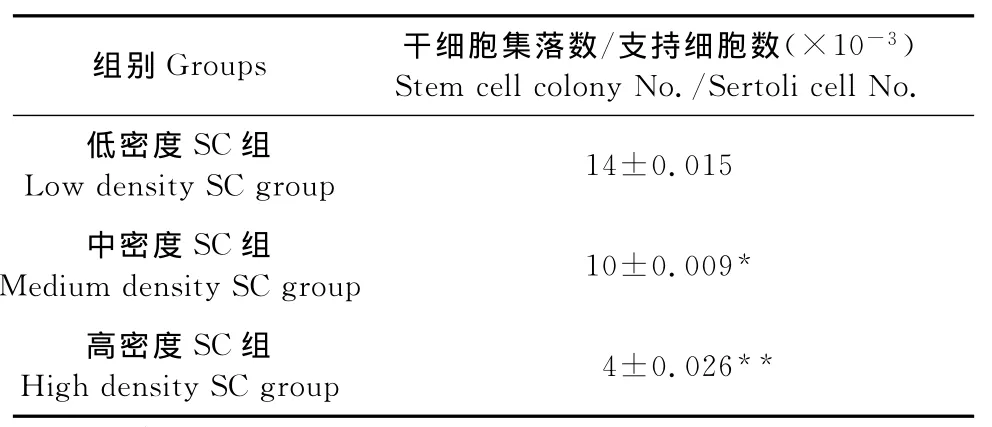
表2 各组共培养体系中生殖干细胞集落比例数Table 2 The clones′proportion in different co-culrute system
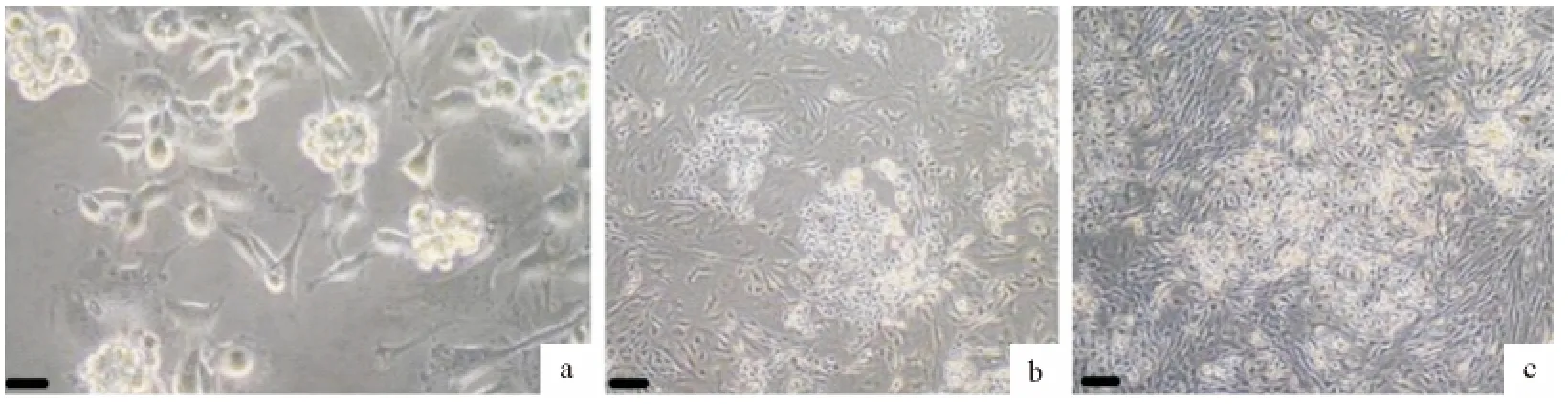
图5 4d时不同密度支持细胞共培养体系细胞图(a.Bar=50μm;b~c.Bar=100μm)Fig.5 The co-culture system with different density of SCs on the fourth day(a.Bar=50μm,b-c.Bar=100μm )
2.4 牛睾丸支持细胞和生殖干细胞特异性基因的鉴定
RT-PCR结果显示分析不同密度SC培养GSC时,各密度培养体系均表达干细胞特异基因OCT-4和支持细胞特异基因SCF(图6)。
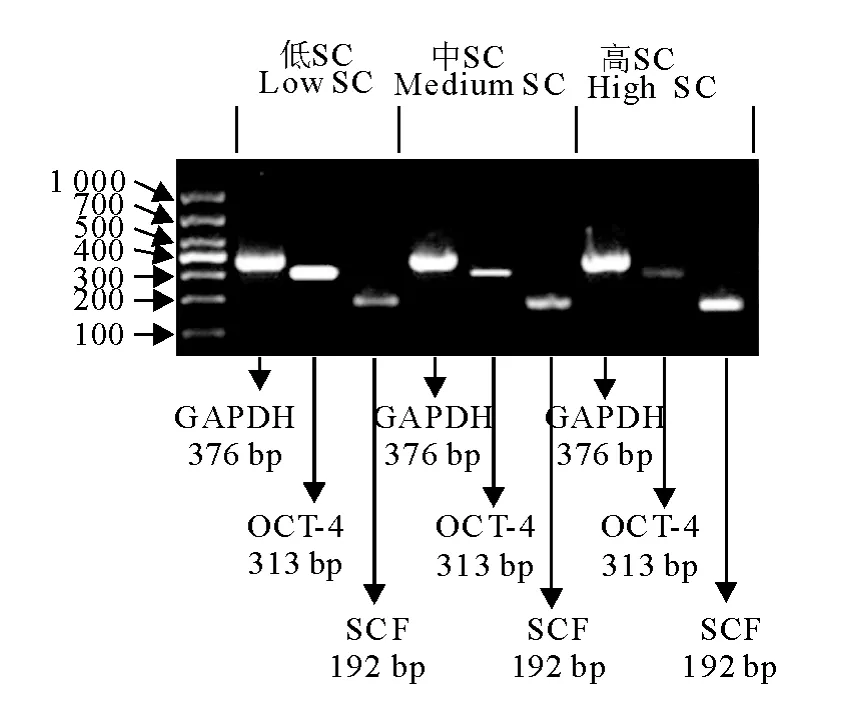
图6 不同密度共培养体系中牛睾丸生殖干细胞和支持细胞标志基因RT-PCR鉴定Fig.6 Identification of calf mGSC and SC markers by RT-PCR in different density co-culture systems
2.5 不同密度支持细胞共培养体系中SCF、OCT-4的相对表达量
荧光定量PCR结果显示,采用低密度SC培养干细胞特异性基因OCT-4的相对表达量极显著高于中密度SC培养和高密度SC培养(P<0.01);中密度和高密度间无显著性差异(P>0.05)。
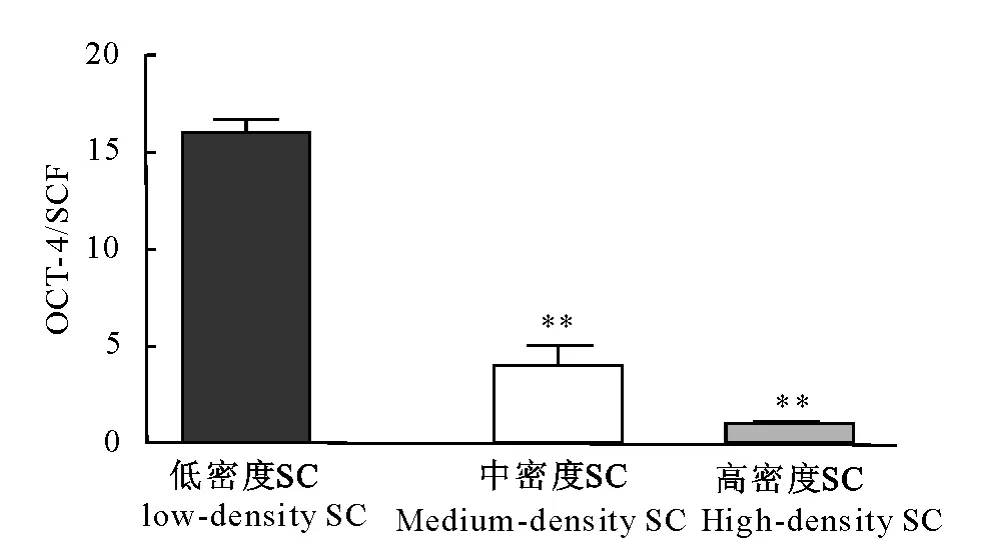
图7 OCT-4和SCF灰度比值Fig.7 The gray value of OCT-4/SCF
3 讨论
构成曲细精管的上皮是一种特殊的复层上皮,管壁上皮细胞分支持细胞和生精细胞两类,支持细胞分布在各级生精细胞之间[9],对生精细胞具有营养、支撑、保护等多种作用[10]。以支持细胞为饲养层体外共培养时,支持细胞贴壁较早,能够产生较大的伸展面积,有利于生殖干细胞贴壁[11];同时支持细胞会分泌多种生物活性因子,如神经胶质细胞源营养因子(GDNF1)[12]、干细胞因子(SCF)[13]等以促进干细胞的增殖;此外,支持细胞之间以及支持细胞和干细胞之间形成的特殊连结构成了生精细胞生长的微环境,同时有利于某些调节因子的信号传导[14]。
因此,目前培养睾丸生殖干细胞多采用以支持细胞或者成纤维细胞做饲养层[15],同时为促进生殖干细胞增殖,选用的培养基条件严格,通常加入多种昂贵的营养因子[8]。其目的是更好的促进干细胞生长,以期进一步纯化干细胞,提高干细胞在共培养体系中的比例。鉴于此,本试验对接种睾丸干细胞前的支持细胞饲养层密度进行了选择,在不添加SCF、GDNF等昂贵营养因子的条件下,简便、经济、有效地培养睾丸生殖干细胞。
3.1 共培养体系中睾丸支持细胞和生殖干细胞的鉴定
根据李德雪等的研究方法[16-19],本试验HE染色结果、光学显微镜观察结果以及AKP染色结果显示,体外混合培养的犊牛睾丸曲细精管上皮细胞呈现睾丸支持细胞和生精细胞的两种形态特征。根据于磊等[20]对睾丸支持细胞及张仕强等[21]对睾丸生殖干细胞特异性标志物的鉴定,本试验经RTPCR发现,共培养的细胞均能够表达睾丸支持细胞特异基因SCF和干细胞特异基因OCT-4;同时荧光定量PCR结果说明,随着支持细胞密度的不同,SCF和OCT-4的相对表达量发生变化,即生殖干细胞和支持细胞数量比发生变化,OCT-4/SCF比值越高则干细胞比例越大。
3.2 共培养时睾丸支持细胞密度的选择
曲细精管上皮内的支持细胞和生精细胞须要保持一定的比例,有利于生精细胞的发育及精子的产生[22]。本试验发现,低密度的支持细胞培养生殖干细胞能够显著增加干细胞集落比例数及集落体积;同时显著升高干细胞特异性基因OCT-4/支持细胞特异性基因SCF。说明虽然支持细胞是体外培养生殖干细胞的不可或缺因素,但是,支持细胞跟生精细胞的比例却不是越大越好。高密度的支持细胞并不利于生殖干细胞集落的生成,即高密度支持细胞不利于生殖干细胞的增殖。其原因可能是:支持细胞密度高,其吸收营养过多、产生的细胞代谢产物也较多,同时支持细胞增殖速度较快不能给生殖干细胞足够的生长空间,从而抑制生殖干细胞的增殖;而较低密度的支持细胞共培养既能满足生殖干细胞的生长要求,又不至于吸收过多的营养、产生过多代谢产物以及抢占生存空间,因此干细胞集落纯度较大。
体外培养睾丸生殖干细胞时,采用较低密度的支持细胞共培养可获得理想的睾丸生殖干细胞。这种方法既节省了昂贵的外加营养因子,同时操作简便、效果理想。然而,根据理论猜测,密度并非越低越好,因此还需进一步试验,以筛取更佳的支持细胞共培养密度。
[1]Schlatt S.Spermatogonial stem cell preservation and transplantion[J].Mol Cell Endocrinol,2002,187(1-2):107-111.
[2]Brinster R L,Zimmermann J W.Spermatogenesis following male germ-cell transplantation[J].Proc Natl Acad Sci USA,1994,91:11298-11302.
[3]Hiroshi K,Brinster R L.Technology insight:invitroculture of spermatogonial stem cells and their potential therapeutic uses[J].Nat Rev Endocrinol,2006(2):99-108.
[4]Honaramooz A,Megee S,Zeng W X,et al.Adeno-associated virus(AAV)-mediated transduction of male germ linestem cells results in transgene transmission after germ cell transplantation[J].Faseb J,2008,22:374-382.
[5]Cheng G,Feng S T.Studies on spermatogonial stem cells culturedinvitroof Wuzhishan mini porcine[J].Chinese J Biotechnol,2006,22(4):689-693.
[6]Kanatsu-Shinohara M,Miki H,Inoue K,et al.Long-term culture of mouse male germline stem cells under serum-or feeder-free conditions[J].J Biol Repord,2005,72(4):985-991.
[7]Goel S,Sugimoto M,Minami N,et al.Identification,isolation,andinvitroculture of porcine gonocytes[J].J Biol Reprod,2007,77(1):127-137.
[8]Nasiri Z L,Hosseini S M,Hajian M,et al.Effects of different feeder layers on short-term culture of prepubertal bovine testicular germ cellsinvitro[J].Theriogenology,2012,77(8):1519-28.
[9]Russell L D,Tallon-Doran M,Weber J E,et al.Three-dimensional reconstruction of a rat stage V Sertoli cell:III.A study of specific cellular relationships[J].J Anatomy,1983,167:181-192.
[10]Bardin W C,Gunsalus G L,Chemgh C Y.The cell biology of the Sertoli cell[J].Cell Mol Biol Test,1993,189-219.
[11]Saitou M,Barton S C,Surani M A.A molecular programme for the specification of germ cell fate in mice [J].Nature,2002,418:293-300.
[12]Simon L,Ekman G C,Tyagi G.Common and distinct factors regulate expression of mRNA for ETV5and GDNF,Sertoli cell proteins essential for spermatogonial stem cell[J].Exp Cell Res,2007,313(14):3090-3099.
[13]Ohta H,Yomogida K,Dohmae K,et al.Regulation of proliferation and differentiation in spermatogonial stem cells:the role of c-kit and its ligand SCF[J].Development,2000,127:2125-2131.
[14]Wang R S,Yeh S,Chen L M,et al.Androgen receptor in Sertoli cell is essential for germ cell nursery and junctional complex formation in mouse testes[J].Endocrinology,2006,147(12):5624-33.
[15]刘慧莲,赵光强.Sertoli细胞饲养层对小鼠精原干细胞增殖的影响[J].中国生物工程杂志,2007,27(2):95-98.
[16]李德雪,张学明,赖良学,等.小鼠精原干细胞体外培养的一般特性[J].中国兽医学报,2001,21(1):160-163.
[17]Dirk G.Proliferation and differentiation of spermatogonial stem cells[J].Reproduction,2001,121:347-354.
[18]Izadyar F,Den-Ouden K,Creemers L B,et al.Proliferation and differentiation of bovine type A spermatogonia during long-term culture[J].Biol Reprod,2003,68:272-281.
[19]Zheng P,Huang Z J,Lv Z H,et al.Study of several factors affecting on preparation of mouse embryonic stem cells[J].Life Sci J,2009,6(1):1-4.
[20]于 磊,郑 鹏,荣恩光,等.新生牛睾丸支持细胞的体外培养及鉴定分析[J].吉林农业大学学报,2013,35(1):63-66.
[21]张仕强,毕聪明,彭树英,等.不同培养条件对牛精原干细胞增殖的影响与特性鉴定[J].畜牧兽医学报,2007,38(6):542-547.
[22]Allan D J,Harmon B V,Robrets S A.Spermatogonial apoptosis has three morphologically recognizable phases and shows no circadian rhythm during normal spermatogenesis in the rat[J].Cell Prolif,1992,25:241-250.