奶牛乳房炎致病菌的分离鉴定及耐药性研究
2015-06-25李新圃李宏胜罗金印王旭荣
李新圃,李宏胜,罗金印,杨 峰,王旭荣
(中国农业科学院兰州畜牧与兽药研究所 农业部兽用药物创制重点实验室 甘肃省新兽药工程重点实验室,甘肃兰州730050)
乳房炎是奶牛的常见病和多发病,由于防治难,治疗花费大,给奶牛业带来了巨大的经济损失[1-2]。奶牛乳房炎病因十分复杂,但主要是病原微生物通过受损乳头和乳导管入侵乳腺组织引发感染。调查研究及生化鉴定试验显示,大约85%左右的临床型乳房炎乳汁中能够检出细菌,细菌种类多达20余种,其中80%以上的病原菌为无乳链球菌、停乳链球菌、金色葡萄球菌、大肠埃希菌和乳房链球菌[3-4]。目前国内外有关奶牛乳房炎病原菌的研究多集中在上述主要致病菌[5-6],对其他细菌的研究较少。而传统的生化鉴定试验特异性低,对大部分乳汁细菌无法确定其菌种,很难满足当前乳汁细菌的鉴定要求。近年来,随着PCR技术的发展和应用,细菌有了更加方便、准确的分子生物学鉴定方法,但由于使用成本较高、并需要一定的操作技术,尚未能在国内普及使用[7-8]。本研究主要采用较为成熟的16SrDNA PCR鉴定技术,对采集的数百份临床型乳房炎乳样,进行致病菌的分离鉴定,并对其中检出率较高的条件性致病菌进行毒性研究,目的是为了进一步了解乳汁细菌的菌群分布,以及条件性致病菌的致病性和耐药性,为奶牛乳房炎的防控提供更全面的研究数据。
1 材料与方法
1.1 材料
1.1.1 主要仪器设备和试剂 PCR扩增仪,凝胶成像仪,显微镜,电泳仪,培养箱,16SrDNA PCR试剂盒,细菌DNA提取试剂盒,药敏纸片青霉素10U、氨苄西林10μg、氯霉素30μg、红霉素15μg、卡那霉素30μg、氧氟沙星5μg、链霉素10μg、四环素30μg、万古霉素30μg,质控菌株金黄色葡萄球菌ATCC25923、肺炎链球菌ATCC49619,MHA培养基,增菌肉汤,琼脂血平面,营养肉汤等。
1.1.2 实验动物 清洁级昆明小鼠,雌雄各半,6周~8周,16g~20g,由兰州大学GLP实验室提供。
1.2 方法
1.2.1 乳样采集 302份奶牛临床型乳房炎乳样,采自甘肃、陕西、山西、宁夏等地奶牛场。用温水清洗患病乳区,酒精棉消毒乳头,弃去头2把乳,挤取适量乳汁在灭菌试管中,远途乳样挤在琼脂斜面上。采集乳样需冷藏保存,并尽快进行细菌分离。
1.2.2 细菌分离 挑取均匀乳样(或琼脂斜面上的菌落)划分在血平面上,同时接种增菌肉汤一管,37℃孵育16h~48h。从血平面上挑选单个菌落,接种到增菌肉汤中,37℃温孵育16h~48h。进行载玻片涂片、革兰染色、显微镜观察,已分离纯化的细菌可进入细菌鉴定程序,未分离纯化的细菌需重新进行血平面划分,直至细菌分离纯化方可进入细菌鉴定程序。若血平面上未长菌,而相应的增菌肉汤管长菌,则挑取肉汤管中的细菌培养物进行血平面划分、纯化。分离纯化菌株可以加入到脱脂乳中冷冻保存。
1.2.3 细菌鉴定 使用OMEGA试剂盒提取细菌DNA,并以此作为DNA模板,使用16SrDNA PCR试剂盒进行前500bp的DNA反应(必要时进行全序列DNA反应),以及PCR扩增、10g/L琼脂糖凝胶电泳,凝胶成像。对符合测序标准的目的片段,送北京六合华大基因科技股份有限公司进行基因测序。使用PubMed数据库的在线Blast,对所得序列片段进行搜索比对,确定细菌种属。
1.2.4 试验菌悬液 取试验菌的分离纯化株,接种到增菌肉汤中,在37℃温箱中培养16h~48h,使细菌浓度达到5麦氏浊度,采用平板菌落计数法测定试验菌浊度,计算每毫升菌悬液中菌落形成单位(CFU/mL)。必要时用增菌肉汤稀释细菌到试验浊度。
1.2.5 小鼠致病性研究 选择检出率较高的16株粪肠球菌、18株屎肠球菌和15株化脓隐秘杆菌等条件性致病菌进行小鼠致病性试验。每种菌作为一个试验组,设立对照组,每株菌使用5只小鼠,按0.5mL的注射量,小鼠腹腔注射试验菌悬液,对照组小鼠注射增菌肉汤。连续观察15d,每天记录小鼠的病理变化及死亡情况,对发病死亡小鼠进行剖解,观察内脏器官的病理变化,并通过培养肝、脾组织进行病原重分离。挑取少许肝、脾组织划分在血平面上,37℃孵育16h~48h,挑取单个菌落进行涂片、染色和镜检,如果细菌形态特征符合试验菌,说明试验菌具有致病性。根据试验组小鼠的死亡情况,在0.2mL~0.8mL之间增减试验菌注射量,同时设立相应的增菌肉汤对照组,测定小鼠半数致死量。
1.2.6 耐药性研究 对以上的条件性致病菌,参照CLSL2013和卫生行业标准 WS/T-125-1999,进行耐药性试验。粪肠球菌和屎肠球菌使用MHA培养基,化脓隐秘杆菌使用含50mL/L羊血的MHA培养基。制备0.5麦氏浊度的试验菌悬液,吸取200μL均匀点种在直径90mm的MHA培养基上,涂布均匀,放置5片抗菌素药敏纸片,倒置在培养箱中,37℃孵育16h~48h,测定抑菌圈直径,判断耐药(R)、高敏(S)和中敏(I)。同一菌株进行3次平行试验,结果取其平均值,使用ATCC质控菌株确保试验准确性。
2 结果
2.1 乳汁细菌的分离鉴定
共采集302份临床型乳房炎乳样,246份检出细菌,其中11份同时检出两种细,细菌检出率为81.5%。本次试验共检出257株细菌,总共包括27个种属。常见的主要致病菌中无乳链球菌检出率最高,为27.6%,其次是金色葡萄球菌检出率7.0%,大肠埃希菌检出率4.7%。条件性致病菌中检出率较高的是屎肠球菌、粪肠球菌和化脓隐秘杆菌,它们的检出率分别为7.0%、6.2%和5.8%。检出菌中还包括益生菌乳酸乳球菌、棉籽糖乳球菌、蒙氏肠球菌和海氏肠球菌等,它们的总检出率为10.1%。其他菌肉毒梭菌检出率较高,为8.9%(表1)。
2.2 条件致病菌的致病性
腹腔注射7.5×108CFU~1.0×109CFU的粪肠球菌和屎肠球菌,小鼠未出现明显的病理症状和死亡情况;腹腔注射2.4×108CFU~1.4×109CFU化脓隐秘杆菌,小鼠出现不同程度的精神萎靡、被毛粗乱、皮肤发暗,并在感染后1d~7d内出现死亡。剖解死亡小鼠,发现肝脏明显肿大,发黑、质脆,肺脏严重充血。接种死亡小鼠的肝、脾组织到血平面上,长出单一细菌,形态特征符合化脓隐秘杆菌。化脓隐秘杆菌对小鼠的半数致死量为4.0×107CFU~2.4×108CFU。
2.3 条件致病菌的耐药性
粪肠球菌对氨苄西林和万古霉素高度敏感,对青霉素和链霉素耐药。屎肠球菌对氨苄西林、氯霉素和万古霉素高度敏感,对青霉素、卡那霉素和链霉素耐药。化脓隐秘杆菌对卡那霉素、四环素、红霉素和链霉素既有高敏株,也有耐药株,对其他抗生素则呈高度敏感(表2)。
3 讨论
本试验从302份乳样中共检出257株细菌,主要致病菌无乳链球菌、金色葡萄球菌、大肠埃希菌、停乳链球菌和乳房链球菌的总检出率为42.4%。无乳链球菌的单一检出率就是27.6%,其中90.8%的菌株来自甘肃奶牛场的乳样。由于无乳链球菌属于接触性感染菌,主要通过挤奶员和挤奶设备传播扩散,因此本次试验涉及的甘肃奶牛场,在挤奶方式和挤奶设施方面可能存在较大的卫生隐患。山西奶牛场乳样中的检出菌比较特别,有肉毒梭菌、柠檬酸杆菌、粪产碱杆菌、水拉恩菌和普罗维登斯菌等,原因尚不清楚,有待进一步调查研究。
宁夏地区奶牛场的乳样,检出菌多为乳酸菌。乳酸菌是一类能发酵葡萄糖(或可利用的碳水化合物)产生大量乳酸的细菌,由于能够分泌过氧化氢和细菌素,具有抑制病原菌生长的作用,常作为益生菌被研究应用[9],并且已被用于奶牛乳房炎的防治研究[10-12]。尽管益生菌可以抑制一些病原菌的生长,起到防病治病的目的,但是能从临床型乳房炎乳汁中检出,并且具有一定的检出率,说明益生菌进入乳腺组织,也能引发乳
房炎。因此,一般健康乳汁中能够检出细菌[13],并不代表健康乳腺中原本存在细菌[14],而是可能外界细菌入侵乳室的结果。简单将益生菌注入乳室内防治奶牛乳房炎的方法[15]是否可行,还需要进一步探讨。
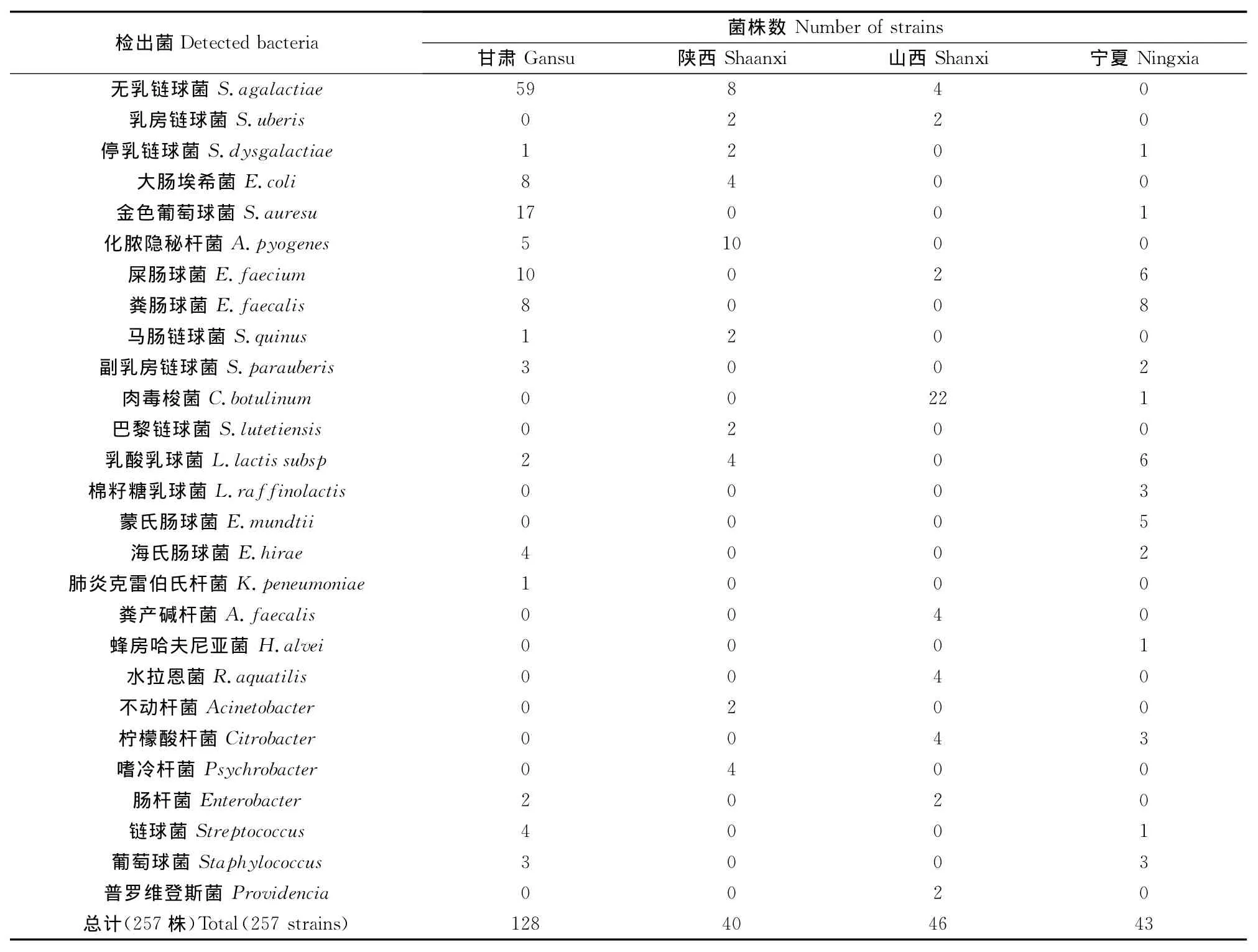
表1 奶牛乳房炎致病菌的菌群分布Table 1 Microflora distribution for pathogenic bacteria of dairy cow mastitis
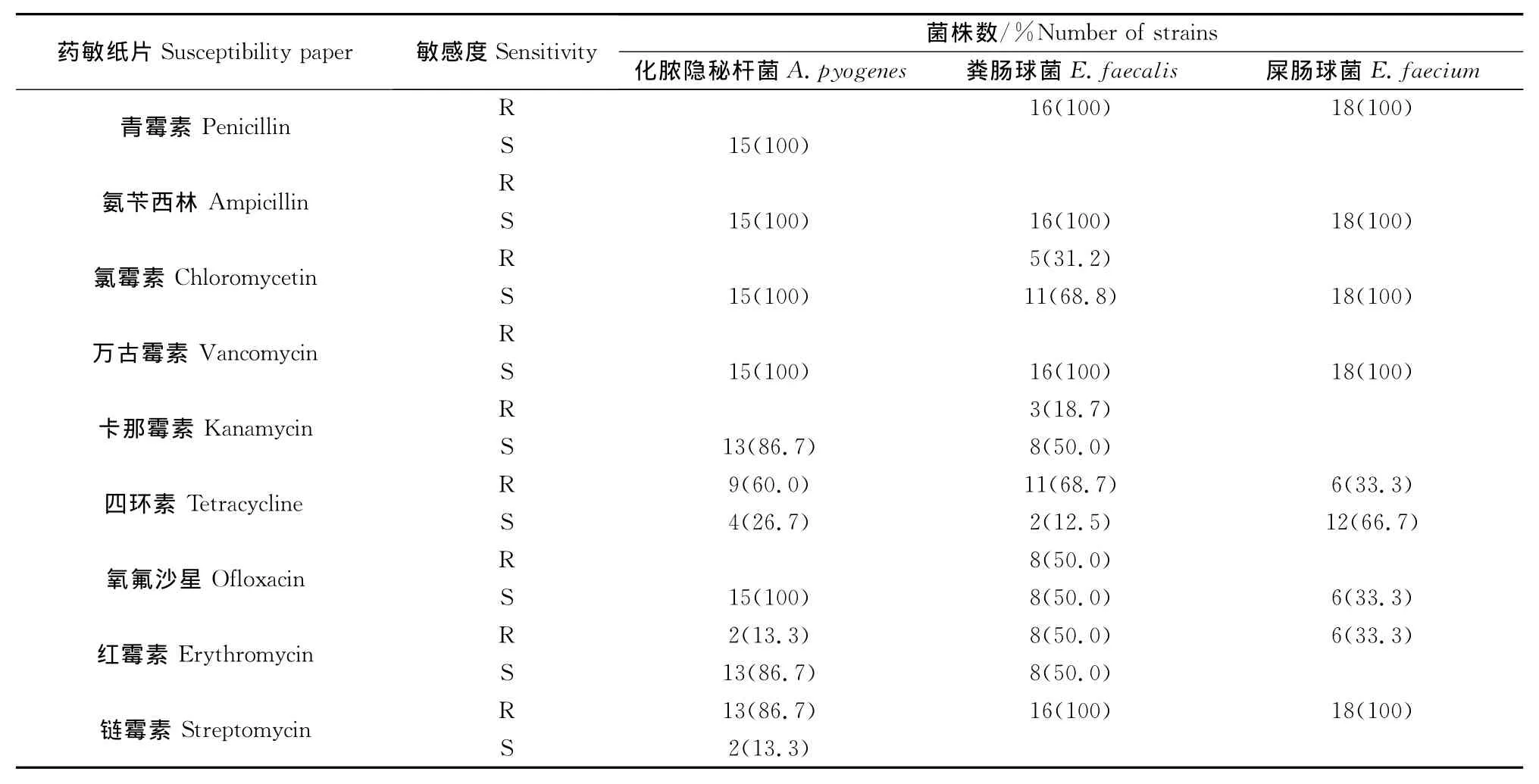
表2 条件致病菌的耐药性Table 2 Drug resistance of opportunistic pathogens
屎肠球菌和粪肠球菌属于乳酸菌,在2008年1126号公告中作为益生菌被规定为饲料微生物添加剂,并被研究应用至今。但研究显示,这两种肠球菌均能引起人类疾病,因此也被作为条件性致病菌进行研究报道[16]。本试验将这两种肠球菌作为条件性致病菌,进行小鼠致病性研究,发现对小鼠没有明显的致病性,但对试验抗生素表现出一定的耐药性。说明奶牛乳房炎致病菌的分布具有多样性和复杂性,可以分为主要致病菌、条件致病菌、乳酸菌和其他细菌。除主要致病菌外,条件性致病菌对小鼠也有明显的致病性,乳酸菌一般作为益生菌使用,对小鼠没有明显的致病性,但是进入到乳腺组织中,就会成为条件性致病菌引发奶牛乳房炎。
[1]高鹏飞,程 斌,张善亭,等.复合乳酸菌制剂在防治奶牛乳房炎方面的应用研究[J].中国畜牧杂志,2014,50(12):41-47.
[2]吕 平,韦丽君,黄 强,等.中草药提取物与酶复合物对牛乳房炎病原菌的抑菌效果[J].西北农业学报,2012,21(3)32-37.
[3]王方正,田中杰,田文儒.噬菌体内溶素对奶牛乳房炎致病菌的溶解作用[J].动物医学进展,2015,36(4):113-116.
[4]王 凤,宋 立,汤德元,等.奶牛乳房炎病原菌的分离、血清型及耐药性研究[J].动物医学进展.2013,34(6):62-67.
[5]Osman K M,Mustafa A M,Aly M A,et al.Serotypes,virulence genes,and intimin types of shiga toxin-producingE.coliand enter-opathogenicE.coliisolated from mastitic milk relevant to human health in Egypt[J].Vector Borne Zoonotic Dis,2012,12(4):297-305.
[6]Kumar R,Yadav B R,Singh R S.Antibiotic resistance and pathogenicity factors inStaphylococcusaureusisolated from mastitic Sahiwal cattle[J].J Biosci,2011,36(1):175-188.
[7]Boss R,Naskova J,Steiner A,et al.Mastitis diagnostics:quantitative PCR forStaphylococcusaureusgenotype B in bulk tank milk[J].J Dairy Sci,2011,94(1):128-137.
[8]韩 旭,武 瑞.孙东波.奶牛乳房炎主要病原菌基因检测技术研究进展[J].中国畜牧兽医,2012,39(3):230-232.
[9]朱丹丹,刘 宇,徐 铭,等.微生态制剂防制奶牛乳房炎的研究进展[J].中国畜牧兽医,2013,40(9):218-221.
[10]Giannino M L,Aliprandi M,Feligini M,et al.A DNA array basedassay for the characterization of microbial community in raw milk[J].J Microbiol Meth,2009,78(2):181-188.
[11]Espeche M C,Pellegrino M,Frola I,et al.Lactic acid bacteria from raw milk as potentially beneficial strains to prevent bovine mastitis[J].Anaerobe,2012,18(1):103-109.
[12]马 晨,高鹏飞,张和平.乳酸菌在奶牛营养与疾病诊疗中的应用研究进展[J].中国畜牧杂志,2014,50(24):32-36.
[13]袁永隆,张礼华,刘纯传,等.我国奶牛乳房炎常见病原菌的区系调查[J].中国农业科学,1992,25(4):70-76.
[14]Espeche M C,Otero M C,Sesma F,et al.Screening of surface,properties and antagonistic substances production by lactic acid bacteria isolated from the mammary gland of healthy and mastitic cows[J].Vet Microbiol,2009,135(3-4):346-357.
[15]杨 静,高淑琴,王庆奎,等.微生态活菌制剂防制奶牛隐性乳房炎的效果试验[J].畜牧与饲料科学,2012,33(8):105-106.
[16]黄仁刚,杨兴祥,喻 华,等.肠球菌属血流感染92例临床及病原菌特点分析[J].中国感染与化疗杂志,2015,15(1):6-10.
