托氟沙星纳米乳的体内外抗菌作用研究
2015-06-11欧阳五庆杨鸣琦王波臻李梦云
高 娴,欧阳五庆*,杨鸣琦*,王波臻,郑 寅,李梦云,刘 岳
(1.西北农林科技大学动物医学院,陕西杨凌712100;2.石河子大学动物科技学院,新疆石河子832003;3.河南科技大学动物科技学院,河南洛阳471003)
托氟沙星(tosufloxacin,T-3262)又名妥舒沙星、托磺沙星,化学名为(±)-7-(3-氨基-1-吡咯烷基)-1-(2,4-二氟苯基)-6-氟-4-氧代-1,8-萘啶-3-羧酸,是日本富山化学工业公司综合研究所首先研制成功的一种广谱、高效的新型氟喹诺酮类抗菌药物。托氟沙星除具有氟喹诺酮类药物的共同特点,即对需氧革兰阴性杆菌包括绿脓杆菌抗菌活性高,对细胞、组织穿透力强,吸收后在体内分布广泛,组织液药物浓度高,不良反应轻微等外,与已上市的同类药品相比,它还具有对葡萄球菌属、链球菌属、肠球菌属等需氧革兰阳性菌以及厌氧菌抵抗活性增强的优点。但托氟沙星难溶于水,现有的片剂和胶囊,只能采取拌料方式为畜禽用药,不易拌匀,可能造成畜禽中毒或对疾病无效的情况,严重影响其在养殖行业的推广应用。
本实验室自行研制的托氟沙星纳米乳(以下简称为TFLX-NE)易溶于水,可兑水给予患病畜禽,成功解决了托氟沙星在临床应用中存在的问题。本试验首次对托氟沙星纳米乳的体外抑菌活性和体内药效作用进行考察,以期对兽医临床用药提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要药品与试剂 托氟沙星,河南天耀科技有限公司产品;盐酸左氧氟沙星,西安市临泽科技有限公司产品;二甲基亚砜(DMSO)、磷酸氢二钾,天津市博迪化工有限公司产品;蛋白胨、琼脂粉,北京索莱宝科技有限公司产品;氯化钠,成都市科龙化工试剂厂产品;牛肉膏,北京奥博星生物技术有限公司产品;聚氧乙烯醚(40)氢化蓖麻油(RH-40),天津市恒兴化学试剂有限公司产品;乳酸,天津市天力化学试剂有限公司产品;牛至油,江西吉安中香天然植物有限公司产品;胎牛血清,浙江天杭生物科技有限公司产品。
1.1.2 试验菌株 无乳链球菌(Streptococcus agalactiae)、多杀巴氏杆菌(Pasteurella multocida)、大肠埃希菌O 78(Escherichia coli)、痢疾志贺菌(Shigella dysenteriae)、鼠伤寒沙门菌(Salmonella typhimurium),由西北农林科技大学动物医学院微生物实验室惠赠;甲型副伤寒沙门菌(Salmonella paratyphi-A),分离自患病的赛鸽;金黄色葡萄球菌(Staphylococcus aureus)ATCC6538,购自北京北纳创联生物技术研究院。
1.1.3 主要仪器 电热恒温培养箱,黄石市恒丰医疗器械有限公司产品;超净工作台,苏州净化设备有限公司产品;AUY220电子天平,日本岛津公司产品。
1.1.4 试验用动物 1日龄海兰褐雏鸡200只,购自陕西省武功镇友民种鸡场。试验鸡喂给无抗生素的全价雏鸡饲料,自由饮水和采食,鸡只按组分笼饲养,饲养环境经严格灭菌消毒,无病原微生物。
1.1.5 病料 病料采自陕西西安某赛鸽公棚。剖检病死赛鸽,无菌采取肝脏、脾脏等器官。
1.2 方法
1.2.1 TFLX-NE及空白纳米乳的制备
1.2.1.1 TFLX-NE的制备 TFLX-NE由本实验室研发。室温下,按照TFLX-NE的配方,精确称取托氟沙星(0.136g/kg)溶于牛至油(0.324g/kg)中,再加入乳酸(0.260g/kg),充分搅拌使托氟沙星全部溶解,然后加入RH-40(2.598g/kg)混匀,最后边搅拌边逐滴加入蒸馏水(6.682g/kg),即可制得淡黄色澄清透明的TFLX-NE。
本组甲状腺癌单发占70.0%,多发占比30.0%;甲状腺良性结节单发占比37.5%,多发占比62.5%。甲状腺癌与甲状腺良性结节的数目比较,差异有统计学意义,P<0.05。
1.2.1.2 空白纳米乳的制备 精确称取TFLX-NE配方量的牛至油、乳酸、RH-40、蒸馏水,按照“1.2.1.1”所述方法即可制得淡黄色澄清透明的空白纳米乳。
1.2.2 甲型副伤寒沙门菌的分离鉴定 无菌操作采集患病赛鸽的肝脏、脾脏,将剪切面涂抹麦康凯琼脂培养基,37℃培养24h。挑取白色菌落,革兰染色,光学显微镜下观察;该菌落的另一半接种营养肉汤培养基增殖。将菌悬液接种于各种生化发酵管中,37℃培养48h,观察发酵管的颜色变化、有无气泡产生。
1.2.3 TFLX-NE的MIC测定 采用美国临床实验室标准化协会(CLSI)M7-A6推荐的肉汤稀释法[1]测定不同药物对无乳链球菌、金黄色葡萄球菌、多杀巴氏杆菌、大肠埃希菌、痢疾志贺菌、鼠伤寒沙门菌、甲型副伤寒沙门菌的最低抑菌浓度。
1.2.3.1 培养基的配制 参照《微生物培养基的制造与应用》,分别配制营养琼脂培养基、血清琼脂培养基、营养肉汤培养基和缓冲肉汤培养基,121℃高压蒸汽灭菌20min,备用。
1.2.3.2 菌悬液的制备 分别将金黄色葡萄球菌、多杀巴氏杆菌、大肠埃希菌、痢疾志贺菌、鼠伤寒沙门菌、甲型副伤寒沙门菌划线接种于营养琼脂培养基,无乳链球菌划线接种于血清琼脂培养基,37 ℃培养24h活化。挑单个菌落,将无乳链球菌接种于缓冲肉汤,其他菌株接种于营养肉汤,37 ℃培养16h。根据不同浓度菌液在600nm 处吸光值的不同,用生理盐水调节菌液浓度为2×105CFU/mL。
1.2.3.3 药物储备液的制备 将托氟沙星溶解于DMSO,配成质量浓度为1 280μg/mL 的溶液,参考CLSI的M27-T方案,用各种菌株的培养液稀释药物浓度为256μg/mL[2]。将TFLX-NE、空白纳米乳、盐酸左氧氟沙星用蒸馏水分别配制浓度为256μg/mL的溶液。所有药液均用0.22μm 滤器过滤除菌,备用。
1.2.3.4 接种和培养 采用96孔微量培养板,取100μL配制好的肉汤培养液加入第1~12孔,再向第1孔加入100μL配置好的TFLX-NE储备液,混合均匀后,吸出100μL液体加入第2孔中,以此类推,直至第10孔,从第10孔吸出100μL液体弃去。经过二倍稀释后,向第1~11孔中各加入5μL金黄色葡萄球菌悬液,第12孔加入5μL营养肉汤培养液,混合均匀。此时,第1~10孔,含有TFLX-NE浓度为128.00 μg/mL~0.25μg/mL,每孔体积为105μL。第11孔未加TFLX-NE,作为阳性对照;第12孔只含有营养肉汤培养液,作为阴性对照。培养板的第1~4行分别对应4种药物,依次为TFLX-NE、托氟沙星原料药、盐酸左氧氟沙星原料药、空白纳米乳。将培养板置于37℃培养箱培养18h~24h。当阴性对照孔澄清透亮(无细菌生长),阳性对照孔明显浑浊(细菌生长良好)时,较澄清透亮的试验孔对应的最低浓度为药物的最低抑菌浓度(MIC)。
按照上述方法,分别接种无乳链球菌、多杀巴氏杆菌、大肠埃希菌、痢疾志贺菌、鼠伤寒沙门菌和甲型副伤寒沙门菌,其中无乳链球菌的培养液为缓冲肉汤培养基。每种药品储备液的MIC测定试验平行操作3次。
1.2.4 TFLX-NE 的MBC 测定 将药物的MIC 对应孔及前面试验孔的液体用微量移液器分别移至营养琼脂培养基,其中无乳链球菌对应的液体移至血清琼脂培养基,37℃培养24h,以菌落数少于5个的平皿对应的最低药物浓度为该待测药物的最低杀菌浓度(MBC)值[3]。
1.2.5 TFLX-NE的体内药效试验 营养肉汤培养的鼠伤寒沙门菌感染14日龄雏鸡,鸡只出现明显的临床症状后,用TFLX-NE 进行治疗性预试验,找出TFLX-NE对鼠伤寒沙门菌感染雏鸡的治疗窗,在该剂量范围内拟定由低到高的3个剂量组,进行体内药效试验[4]。
1.2.5.1 动物分组和处理 试验雏鸡14日龄时,挑选体重相近者180羽,随机分为6组,每组30羽,雌雄各半。试验当天,A 组~E 组分别灌胃1.8×108CFU/mL的鼠伤寒沙门菌(1.2mL/羽),F组灌胃同样剂量的生理盐水作为阴性对照。感染鼠伤寒沙门菌后第2天,雏鸡群出现不同程度的禽副伤寒临床症状。此时,A 组~C组雏鸡分别给予含TFLX-NE的饮水(80、60、40mg/L),D组雏鸡按中剂量TFLX-NE(60mg/L)的用药量拌料给予托氟沙星原药,连续用药5d。E组不给药,作为阳性对照,所有试验雏鸡的其他饲养条件均一致。仔细观察并记录各组雏鸡的临床症状、死亡情况等,剖检死亡雏鸡,观察病理变化,用肝脏组织块涂抹营养琼脂培养基分离鉴定感染菌株,连续观察7d。试验最后1d将所有雏鸡空腹称重,并解剖观察病理变化,记录各组雏鸡平均增重、平均增重率和死亡率。
1.2.5.2 数据处理 数据用“平均值±标准差”表示,试验前、后的雏鸡体重及平均增重运用SPSS17.0软件进行邓肯多重比较(Duncan)分析,死亡率应用卡方检验(chi-square test)分析。
2 结果
2.1 甲型副伤寒沙门菌分离鉴定
该菌在麦康凯培养基上为白色、表面光滑湿润、边缘整齐的小菌落,革兰染色后,光学显微镜下观察为革兰阴性、两端钝圆的短杆菌,其生化反应结果见表1,参照《人及动物病原细菌学》[5]判断,该细菌为甲型副伤寒沙门菌。

表1 分离细菌生化试验结果Table 1 The biochemical test results of bacteria isolated
2.2 TFLX-NE的MIC测定
每次试验均以金黄色葡萄球菌ATCC6538 作为质控菌株,盐酸左氧氟沙星对该菌的MIC 为2μg/mL,符合CLSI规定的标准范围(0.50μg/mL~2μg/mL),说明本试验结果准确可靠。TFLXNE对无乳链球菌、金黄色葡萄球菌、多杀巴氏杆菌、鼠伤寒沙门菌、甲型副伤寒沙门菌、大肠埃希菌、痢疾志贺菌的MIC 为0.25μg/mL~2μg/mL,托氟沙 星 对 这7 种 菌 株 的MIC 为0.5 μg/mL~4μg/mL,表明托氟沙星经纳米化后可提高体外抗菌效果。盐酸左氧氟沙星对这些菌株的MIC 为2μg/mL~4μg/mL,抗菌作用较托氟沙星差或相当,但明显弱于TFLX-NE(表2)。
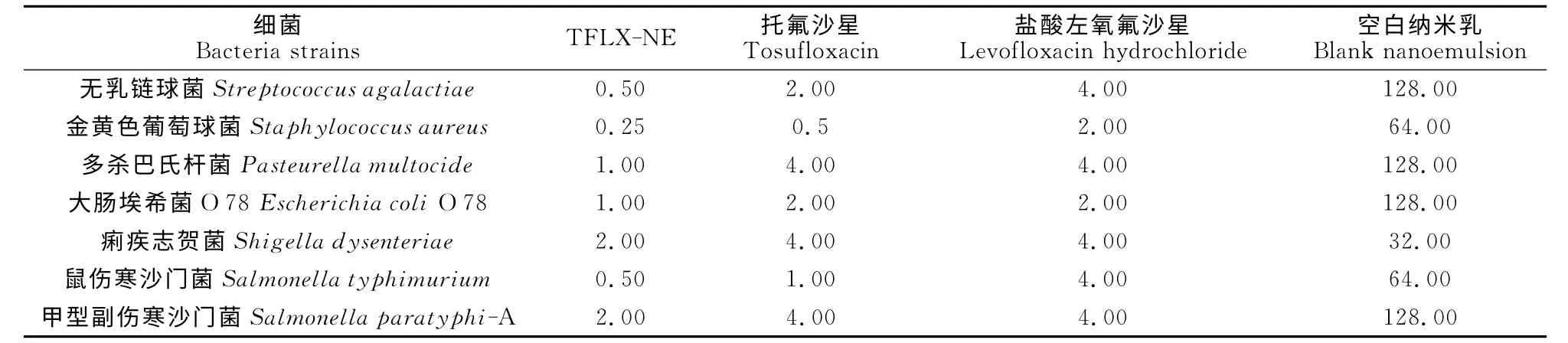
表2 各试验药物对不同细菌的MIC值Table 2 The MICs of test drugs against various bacteria μg/mL
2.3 TFLX-NE的MBC测定
TFLX-NE对无乳链球菌、金黄色葡萄球菌、多杀巴斯得菌、大肠埃希菌、痢疾志贺菌、鼠伤寒沙门菌、甲型副伤寒沙门菌的体外杀菌效果明显优于托氟沙星和盐酸左氧氟沙星(表3)。
2.4 TFLX-NE的体内药效试验
灌胃给予14日龄雏鸡鼠伤寒沙门菌,12h内鸡只陆续出现禽副伤寒临床症状[6],表现为畏冷喜扎堆,闭目,垂翅,松毛,厌食,水样下痢,肛门黏结粪便,或有眼结膜炎等。剖检死亡鸡只,肝脏肿大,表面有灰白色如“雪花样”的坏死灶(图1);肺脏发生灶性坏死;脾脏肿大,表面有点状出血灶;肾脏肿大;心包炎、心肌炎等(图2)。给药后第3天,B组雏鸡的临床症状明显减轻,其他给药组雏鸡的临床症状稍减轻;第5天B组雏鸡的临床症状完全消失,其他组雏鸡的临床症状明显减轻。试验期间,TFLX-NE 给药组的平均增重极显著大于感染对照组(P<0.01),表明TFLXNE能够抑制鼠伤寒沙门菌在雏鸡体内的增殖,减少感染雏鸡的体重损失。同时,雏鸡的存活率可由 56.67%提高至93.33%(表4和表5)。

表3 各试验药物对不同细菌的MBC值Table 3 The MBCs of test drugs against various bacteria μg/mL
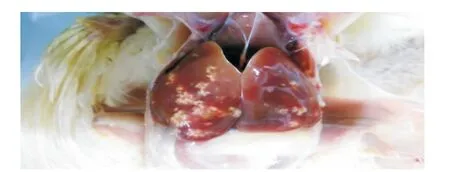
图1 感染雏鸡肝脏表面有“雪花样”坏死灶Fig.1 The liver surface snowflake-like necrosis in infected chicks
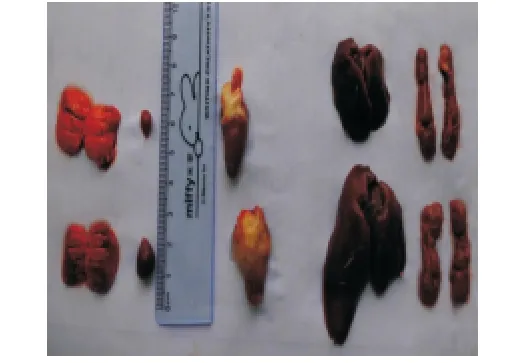
图2 正常雏鸡脏器(后排)与感染雏鸡脏器(前排)Fig.2 Organs of normal chicks(back row)and organs of infected chicks(front row)
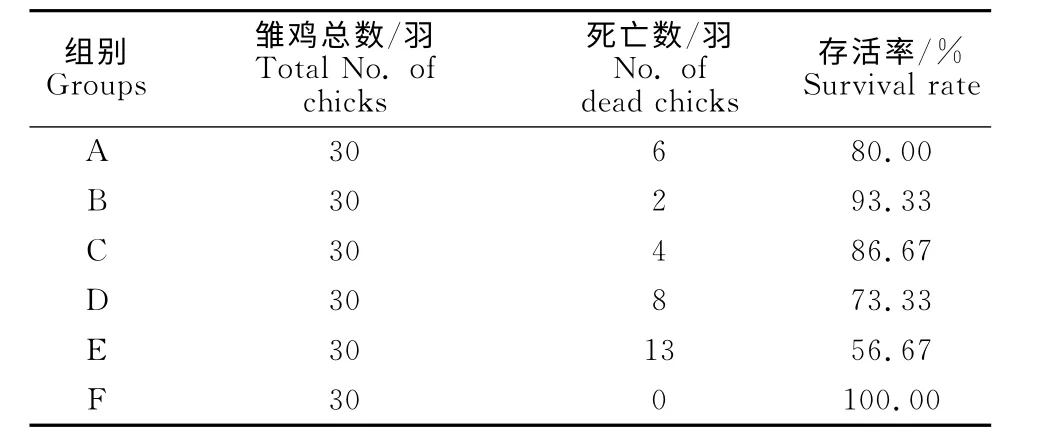
表4 各试验组雏鸡的存活情况Table 4 The survival rate of chicks in each test group
3 讨论
纳米乳作为一种理想的新型药物载体,乳滴的比表面积远大于其他剂型,有着显著的表面效应和小尺寸效应,可以增强药物的稳定性,促进药物在体内的吸收与分布,提高药物的生物利用度。Cilek A 等[7]研究了重组人胰岛素纳米乳制剂对糖尿病大鼠的降糖作用,灌胃给药后,大鼠血糖浓度降低约30%,降糖作用维持90min,与皮下注射溶液剂降糖效果相似。纳米乳出众的剂型优势,使其在21世纪越来越多的受到医药研究领域的关注[8]。托氟沙星为氟喹诺酮类抗菌药物,主要用于治疗呼吸道、泌尿道、肠道、口腔等感染。托氟沙星通过抑制细菌DNA 回旋酶,干扰DNA的正常转录与复制,同时抑制拓扑异构酶Ⅱ,干扰复制的DNA 分配到子代细胞中去,使细菌死亡。将托氟沙星制成纳米乳,其体外抑菌活性较托氟沙星原药提高2倍~4倍,且TFLX-NE的最低抑菌浓度与最低杀菌浓度相差较小,显著提高了托氟沙星的抗菌性能,兽医临床应用中可降低用药量,减少药物使用带来的毒副作用,缩短畜禽上市前的休药期。TFLX-NE的这种低浓度抑菌优势,可能由于纳米级的粒径更易穿透细菌细胞壁,导致大量载药纳米乳滴进入细菌细胞内发挥抗菌作用;另一方面,纳米乳中的药物成分包被在乳滴内相,外相基质可以很好的保护药物,避免其被细菌细胞内的物质分解,从而延长药物的作用时间,提高药物的抗菌作用。

表5 各试验组雏鸡的体重变化情况Table 5 The weight change of chicks in each test group
用鼠伤寒沙门菌肉汤培养物灌胃雏鸡,模拟雏鸡自然条件下感染禽副伤寒沙门菌的途径,建立人工染病模型。灌胃给予鼠伤寒沙门菌后第2天,雏鸡均表现明显的临床症状,如垂翅,闭目,厌食,畏冷,水样下痢,肛门黏结粪便等,与文献报道相符[9],表明本试验成功建立禽副伤寒沙门菌病模型。试验前各组雏鸡的体重无显著性差异,说明组间差异较小,分组合理。临床用药结果表明,TFLX-NE中剂量组的治疗效果比低剂量组、高剂量组以及托氟沙星原药拌料组的效果好。雏鸡感染禽副伤寒后厌食甚至食欲废绝,但是饮欲增加[10],O/W 型TFLX-NE可饮水给药,将药物溶于饮水,使患病雏鸡摄入更多的治疗药物;另外,不溶于水的托氟沙星包被于纳米乳的内核中,口服给药,载药纳米乳进入胃内,胃酸分解的主要是纳米乳的外相物质,托氟沙星顺利进入肠道发挥抗菌作用。
[1] 宋冠男,欧阳五庆,郭建军,等.环吡酮胺纳米乳的体外抑菌活性及透皮性能研究[J].畜牧兽医学报,2013,44(3):453-458.
[2] 芮 弦,欧阳五庆,吴敬超,等.那他霉素纳米乳的制备及其体外抑菌效果研究[J].西北农林科技大学学报:自然科学版,2012,40(3):23-28.
[3] 宋 冰,欧阳五庆,刘梅雪,等.乙酰异戊酰泰乐菌素纳米乳的制备及其体外抑菌活性和急性毒性测定[J].西北农林科技大学学报:自然科学版,2012,40(1):15-20.
[4] Wen L,Xia N,Chen X H,et al.Activity of antibacterial,antiviral,anti-inflammatory in compounds andrographolide salt[J].Eur J Pharmacol,2014,740:421-427.
[5] 杨正时,房 海.人及动物病原细菌学[M].河北石家庄:河北科学技术出版社,2003:497-528.
[6] Saif Y M.禽病学[M].12版.高 福,苏敬良,索 勋,译.北京:中国农业出版社,2012:723-781.
[7] Cilek A,Celebi N,Timaksiz F,et al.A lecithin-based microemulsion of rhinsulin with aprotinin for oral administration:Investigation of hypoglycemic effects in non-diabetic and STZ-induced diabetic rats[J].Int J Pharmac,2005,298(1):176-185.
[8] Lawrence M J,Rees G D.Microemulsion-based media as novel drug delivery systems[J].Adv Drug Deliv Rev,2000,45(1):89-121.
[9] 陈建红,张济培.禽病诊治彩色图谱[M].北京:中国农业出版社,2001:78-84.
[10] 陈理盾,李新正,靳双星.禽病彩色图谱[M].辽宁沈阳:辽宁科学技术出版社,2009:116-117.