不同MLST 型禽源空肠弯曲菌致病性研究
2015-06-11吕嘉敏张宗尧罗开健
吕嘉敏,黄 武,张宗尧,王 媚,罗开健
(华南农业大学兽医学院,广东广州510642)
空肠弯曲菌(Campylobacter jejuni)是一种广泛分布于自然界引起肠道功能紊乱的常见人兽共患病原菌。现已发现该菌除引起牛和绵羊流产,火鸡的肝炎和蓝冠病,童子鸡和雏鸡坏死性肝炎,雏鸡、犊牛、仔猪的腹泻等多种疾病外,还可引起人类急性肠炎和格兰-巴雷(Guillain-Barre)综合征[1-2]。家禽是人和动物感染弯曲菌的主要储存宿主,该菌对禽产品的安全、人类健康构成了严重的威胁。
人弯曲菌感染90%以上是由空肠弯曲菌和结肠弯曲菌引起的[3]。由于缺乏适当的试验模型,目前对空肠弯曲菌的毒力因子和致病机理了解甚少。近几年的研究显示,弯曲菌的毒力因素主要包括黏附、定植、侵入、产毒素、分子模拟等[4]。本试验挑取6个不同分离地区和9种不同MLST 分型的空肠弯曲菌代表菌株进行致病性试验,以了解广东地区禽源空肠弯曲菌菌株致病性特点、致病性与毒力因素的相互关系,为空肠弯曲菌致病机制的分析提供依据。
1 材料与方法
1.1 材料
1.1.1 菌 株、实 验 动 物、细 胞 系 10 株9 种 不 同MLST 分型(多位点序列分型)的空肠弯曲菌、Vero细胞、Hela细胞由华南农业大学兽医学院农业部新兽药创制重点实验室保存(表1);菌株NCTC11168由美国菌种保藏中心提供;1日龄SPF 鸡由广东大华农动物保健品股份有限公司提供。
1.1.2 主要试剂 改良CCD 琼脂培养基、哥伦比亚血琼脂均购于青岛海博有限责任公司;脱纤维绵羊血 购自广州蕊特生物技术公司;Triton-100,购自上海化学试剂公司;DMEM 高糖培养基、EDTA胰酶和胎牛血清为美国Life Technologies公司产品;庆大霉素为美国Amerso公司产品;焦性没食子酸、无水碳酸钠,购自广州丛源生物仪器有限公司。
1.1.3 器材与设备 细胞培养瓶、细胞培养板、移液管为Nest公司产品;微量可调移液器为法国Gilson公司产品;Elix100超纯水器为美国Millipore公司产品;LRH-250Ⅱ型生化培养箱为广东省医疗器械厂产品;JY200电子天平为上海精密科学仪器有限公司天平仪器厂产品;YJ-1450 型超净工作台为苏州净化设备厂产品;AvantiTMJ-20型高速低温离心机为美国Beckman公司产品;GSP-9160MBE 隔水式恒温培养箱为上海博迅实业有限公司医疗设备厂产品;手提式蒸汽高压灭菌锅为上海医用核子仪器厂产品。
1.2 方法
1.2.1 空肠弯曲菌的复苏及培养 无菌条件下,挑取少许-80℃脱脂牛奶冷冻保存的空肠弯曲菌接种于哥伦比亚血琼脂上,42℃微需氧条件(5%O2、10%CO2、85%N2)下培养48h。再扩增培养2代,待菌株活力处于最佳状态,用于下一步试验。
1.2.2 SPF雏鸡致病性试验 用pH7.2的PBS收集在哥伦比亚血琼脂平板上培养48h的空肠弯曲菌,将菌液3 000r/min离心10min,然后用PBS重悬细菌,稀释至紫外分光光度计波长600nm 测OD值约0.6,通过活菌计数确认剂量约2×107CFU/mL,置于冰中,尽快进行后续试验。
每组菌经口接种6只1日龄SPF 雏鸡,并分别设接种生理盐水和NCTC1168 菌液对照组。每日观察试验鸡精神状况、食欲、饮水、粪便等情况。在攻毒后第0、7、14天称量每组试验鸡平均体重;攻毒后第2、4、7、14、21天采集肛拭子,检测带菌情况,第21天处死并剖检,观察试验鸡病变情况。
1.2.3 细胞致病性试验
1.2.3.1 细胞培养 将冻存细胞取出,快速放入37℃水浴中,待细胞融化后立即取出,超净台上转至细胞瓶中,然后缓慢加入培养基,边加边摇动细胞瓶,最后加100mL/L血清。复苏1h~2h,待细胞贴壁后,缓慢倒出培养液,加入血清(100 mL/L)新鲜培养基,培养36h后观察细胞状态。
细胞来源于人子宫颈癌细胞(Hela)和非洲绿猴肾细胞(Vero)。在DMEM 培养基中添加100 mL/L的胎牛血清(Gibco)。细胞在37℃、体积分数为5%的CO2条件下培养传代。
1.2.3.2 Vero、Hela细胞黏附试验 将培养好的Vero或Hela细胞消化后,接种于24 孔(浓度1×105/mL)细胞培养板,24h长成单层(每孔约3×105个细胞);DMEM 培养液洗涤,各组每孔分别加入0.9mL DMEM 培养液(含10 mL/L 胎牛血清)和0.1mL PBS菌悬液(2×107CFU/mL);37℃孵育2h;吸去菌液,PBS漂洗3次;各孔加入1mL 含0.1 mL/L TritonX-100 的PBS 裂解单层细胞;吸出各孔悬液,混匀,经1:100 稀释后各取100μL 涂布于改良CCD 培养基,48h计数菌落。试验中有弯曲菌代表株试验组10 组、空肠弯曲菌标准株NCTC11168阳性对照组,共11个组每个样本重复3次,每次做3个平行。
1.2.3.3 Vero、Hela细胞入侵试验 分组、单层细胞培养、加入菌悬液共培养等均同黏附试验;吸去菌液,PBS洗涤3次,每孔加入1mL含100μg/mL庆大霉素的培养液,杀死细胞外的空肠弯曲菌(此处理不影响细胞内细菌存活);继续孵育2h,吸去菌液,PBS 漂洗3次,加入1 mL 裂解液,裂解单层细胞;吸出各孔悬液,1∶100 稀释,各取100μL 涂布于改良CCD 培养基,48h 培养计数菌落数,侵袭力用入侵细菌数比黏附细菌数百分率表示(即庆大霉素处理后存活细菌与黏附细菌数的百分率)。试验中弯曲菌代表株试验组10 组、空肠弯曲菌标准株NCTC11168阳性对照组,共11个组每个样本重复3次,每次做3个平行。
1.2.4 统计分析 用g/w 记录SPF雏鸡的增重情况数据,黏附能力用黏附细菌数log10CFU/mL 值表示,入侵能力用百分比的换算方式表示[5]。使用Microsoft Excel 2007中的数据分析功能,对上述数据进行相应的t-test,以分析其中的差异显著性。若P<0.05,则判断数据在统计学意义上有显著差异,反之则判断数据在统计学意义上无显著差异[6]。

表1 菌株的来源、ST 序列型及攻毒的SPF鸡的周增重与死亡情况Table 1 Source and MLST of CJ strains and the week weight gain and mortality of challenged SPF chickens
2 结果
2.1 SPF雏鸡致病性试验结果
2.1.1 试验鸡攻毒后不同时间内肛拭子带菌、增重及死亡情况 试验鸡感染鸡源或鸭源空肠弯曲菌分离菌株后,都随着时间的推移,排菌比例增加。到达攻毒后的第21天,除CJ006和CJ030组的试验鸡肛门拭子带菌率为83%外,其余组均为100%。其中鸡源株CJ079攻毒组分别在第6、8、9天死亡1只;在周体重增长方面,CJ079组由于死亡超过50%未进行体重称量。CJ018 试验组对SPF 雏鸡未见明显体重变化,其他攻毒试验组对SPF雏鸡体重增长产生一定的影响,但相互之间差异不大(P>0.05)。
2.1.2 鸡攻毒后临床症状和剖检变化
2.1.2.1 临床症状 攻毒后试验鸡饮水量明显减少,采食量未见异常,羽毛蓬乱无光泽,初期轻度腹泻,后期腹泻严重且带有便血现象,肛门周围污染粪便,昏睡或伏地不愿走动,部分鸡鸡冠苍白。感染CJ001株的临床症状为盲肠轻微鼓气和内红色内容物(图4、图5),感染CJ004株的临床症状为肝脏针尖状出血、十二指肠膨大,盲肠膨大充满气泡,感染CJ013株的临床症状为肝脏少量白色状坏死灶(图6)、盲肠轻微鼓气和内红色内容物,感染CJ030 株的临床症状为盲肠轻微鼓气和内红色内容物,感染CJ035株的临床症状为胆汁稀薄,肝脏针尖状出血、盲肠内红色内容物,感染CJ018株的临床症状为肝脏少量针尖状坏死灶、泄殖腔黏膜出血、盲肠膨大和内红色内容物,感染CJ050株的临床症状为盲肠轻微鼓气和内红色内容物,感染CJ079株的临床症状为试验鸡消瘦、死亡、胆囊破裂、肠壁变薄、盲肠内水样粪便,感染CJ044株的临床症状为盲肠内壁有出血点(图1)、充满红色内容物,感染CJ041株的临床症状为病鸡心脏有出血点、盲肠乳头状坏死,充满内容物,感染空肠弯曲菌标准株NCTC11168的临床症状为小肠壁出血(图2)、肠壁白色坏死(图3)、盲肠内壁有出血点、充满红色内容物,空白对照无异常。
2.1.2.2 剖检变化 肠壁充血出血(图1、图2)、变薄或出现白色坏死(图3);盲肠内充满红色内容物(图4)或水样粪便、有的膨大充满气泡(图5);泄殖腔黏膜出血;心脏外膜有出血点;肝脏针尖状出血、可见白色状坏死灶(图6),胆汁稀薄;脾脏充血肿大。

图1 盲肠出血Fig.1 Caecum hemorrhage

图2 小肠出血Fig.2 Small intestine hemorrhage

图3 小肠壁白色坏死灶Fig.3 Small intestine with white caseation

图4 盲肠红色内容物Fig.4 Caecum with red contents

图5 盲肠鼓气Fig.5 Caecum flatulence
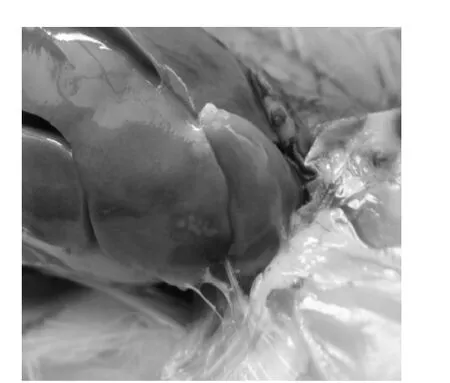
图6 肝脏白色坏死灶Fig.6 Liver with white caseation
2.2 空肠弯曲菌代表株黏附入侵试验结果
11株弯曲菌中10株(9株实验室分离的空肠弯曲菌代表株、1 株空肠弯曲菌标准株)同时具有黏附、侵袭能力,CJ013对Vero细胞没有黏附入侵能力。黏附力、侵袭力结果显示:黏附力的log值变化范围为4.32~5.51,侵袭率的变化范围为0.24~71.4;试 验 中CJ079 入 侵 力 最 高,CJ030、CJ050、CJ004入侵力较高。Hela细胞黏附入侵试验:11株弯曲菌中8 株同时具有黏附、侵袭能力,CJ004、CJ079、C对Hela细胞无黏附入侵能力。黏附力、侵袭力结果显示:黏附力的变化范围为3.3~4.97,侵袭率的变化范围为1.06~6.41;从图3~图6可以看出弯曲菌对Vero细胞的黏附入侵能力整体高于Hela细胞,鸡源分离株略低于于鸭源分离株(CJ042和CJ040)的黏附力和侵袭力。将9株代表株分别与人源标准株NCTC11168进行比较,可发现半数以上(60%)的菌株对Vero细胞的入侵和对Hela的入侵能力均低于从腹泻病人分离得到人源标准株NCTC11168(P<0.001)。而黏附情况则和标准株无明显差异(P>0.05)。

表2 菌株对Vero、Hela细胞的黏附、入侵情况Table 2 Adherence and invasiveness of CJ strains to Vero and Hela cells
3 讨论
本研究挑取广东省6个地区分离到的9种不同MLST 分型的10株弯曲菌代表株,对SPF 雏鸡和细胞进行试验。结果显示,不同MLST 分型的空肠弯曲菌对SPF鸡进行攻毒试验后,试验鸡肛拭子带菌率比较高(83%以 上),结果与Konkel M E 等[7-8]的研究相似。但不同组别的SPF 试验鸡体重增长差异不大(P>0.05)。其中,菌株CJ079(ST51)攻毒SPF鸡后死亡超过50%,菌株CJ(ST6501)和CJ(ST50)均为17%,其余组别没有出现死亡。另外,大多数菌株对Vero细胞的入侵力和对Hela的入侵能力均低于从腹泻病人分离得到人源标准株NCTC11168(P <0.001)。Newell D G 等[9]从环境中分离得到的空肠弯曲菌,侵袭Hela细胞的能力远不如从腹泻病人中分离得到的细菌。Everest P H等[10]研究发现从患有肠炎病人分离的空肠弯曲菌与从无腹泻症状病人分离的空肠弯曲菌,在侵袭水平上具有明显的统计学差异。鸡源CJ079株对Vero细胞的侵袭力高于NCTC11168,这些具有高侵袭力的禽源分离株有可能对人类存在一定的威胁性,在公共卫生上具有重要意义。
通过序列型与毒力之间的关系进行分析,CJ001和CJ079 同属于ST51 型,其中菌株CJ079对SPF雏鸡、细胞黏附入侵力都较强,而菌株CJ001与其他MLST 分型的菌株相比并无明显差异。这也显示来源于不同环境中同一种序列型中的不同菌株也可能具备不同的毒力特征,MLST 型与毒力特征之间不存在某种确定的关系。多数禽源空肠弯曲菌对鸡致死率较低[11],因此也没有引起国内养殖业的重视。然而,世界卫生组织已将该病列为最常见的食源性传染病之一,中国国家食源性疾病监测网已于2003 年将弯曲菌病列入监测体系中[12]。此外,空肠弯曲菌感染还可能会导致严重的继发病格林-巴利综合征(GBS),该病属于脱髓鞘障碍导致急性神经肌肉麻痹,可对人类健康产生严重威胁。由于该菌在禽类的高带菌率,特别是禽源弯曲菌是造成人感染弯曲菌的主要来源,只有控制弯曲菌在禽类的感染发病,才能杜绝动物源弯曲菌感染人的问题。因此,对于养禽业者和兽医工作者来说要重视解决这一问题。
[1] Dasti J I,Tareen A M,Lugert R,et al.Campylobacter jejuni:a brief overview on pathogenicity-associated factors and disease-mediating mechanisms[J].Int J Med Microbiol,2010,300:205-211.
[2] van Doorn P A,Ruts L,Jacobs B C.Clinical features,pathogenesis,and treatment of Guillain-Barre syndrome[J].Lancet Neurol,2008,7:939-950.
[3] Tauxe R V.Emerging foodborne diseases:an evolving public health challenge[J].Emerg Infect Dis,1997,3:425-434.
[4] Muller J,Schulze F,Muller W,et al.PCR detection of virulence-associated genes in Campylobacter jejuni strains with differential ability to invade Caco-2cells and to colonize the chick gut[J].Vet Microbiol,2006,113:123-129.
[5] Louwen R,Heikema A,van Belkum A,et al.The sialylated lipooligosaccharide outer core in Campylobacter jejuni is an important determinant for epithelial cell invasion[J].Infect Immun,2008,76:4431-4438.
[6] Asakura H,Taguchi M,Ekawa T.Continued widespread dissemination and increased poultry host fitness of Campylobacter jejuni ST-4526and ST-4253in Japan[J].J Appl Microbiol,2013,114(5):1529-1538.
[7] Konkel M E,Christensen J E,Dhillon A S,et al.Campylobacter jejuni strains compete for colonization in broiler chicks[J].Appl Environ Microbiol,2007,73:2297-2305.
[8] Hanel I,Muller J,Muller W,et al.Correlation between invasion of Caco-2eukaryotic cells and colonization ability in the chick gut in Campylobacter jejuni[J].Vet Microbiol,2004,101:75-82.
[9] Newell D G,Shreeve J E,Toszeghy M,et al.Changes in the carriage of Campylobacter strains by poultry carcasses during processing in abattoirs[J].Appl Environ Microbiol,2001,67:2636-2640.
[10] Everest P H,Goossens H,Sibbons P,et al.Pathological changes in the rabbit ileal loop model caused by Campylobacter jejuni from human colitis[J].J Med Microbiol,1993,38:316-321.
[11] Hardy C G,Lackey L G,Cannon J,et al.Prevalence of potentially neuropathic Campylobacter jejuni strains on commercial broiler chicken products[J].Int J Food Microbiol,2011,145:395-399.
[12] 吴蜀豫,张立实,冉 陆.弯曲菌及弯曲菌病的流行现状[J].中国食品卫生杂志,2004(1):58-61.
