番鸭细小病毒VP3基因克隆和序列分析
2015-06-11张丹俊沈学怀赵瑞宏胡晓苗侯宏艳潘孝成周学利
张丹俊,戴 银,沈学怀,赵瑞宏,胡晓苗,侯宏艳,潘孝成,周学利
(安徽省农业科学院畜牧兽医研究所,安徽合肥230031)
番鸭细小病毒病是由番鸭细小病毒(Muscovy duck parvovius,MDPV)引起的急性传染病,主要侵害1周龄~3周龄的雏番鸭[1-2]。该病具有高度的传染性,其发病率较高,病死率可达50%~80%;病雏番鸭常表现为喘气、消瘦、拒食、软脚和腹泻等主要临床症状,剖检可见消化道(尤其是小肠)病变[3-6]。MDPV 属于细小病毒科、细小病毒属成员,核酸为单链、线性DNA,大小约为5kb。基因组有2个主要开放阅读框架,分别编码非结构蛋白(NS)和结构蛋 白(VPl、VP2、VP3),其 中 VP3 基 因 全 长1 605nt,编码534个氨基酸,是病毒的重要保护性抗原蛋白[7]。
目前,我国多地雏番鸭因番鸭细小病毒病大量死亡,该病已是严重危害番鸭养殖业的主要疫病,造成了严重的经济损失[8-11]。近期安徽省部分番鸭群也发现了类似病症,且呈现暴发的趋势,前期课题组对病毒进行了分离鉴定,确定为番鸭细小病毒病。本研究进一步克隆了番鸭细小病毒的VP3基因,并进行了序列分析,为研究该病的流行发病趋势和基因遗传进化特征,以及制备更有效的细小病毒疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒 番鸭细小病毒毒株由本实验室分离鉴定并保存。
1.1.2 菌株和质粒 大肠埃希菌BL21 和载体pMDl8-T 为宝生物工程(大连)有限公司产品。
1.1.3 工 具 酶 和 试 剂 DNA 提 取 试 剂、DNA Marker DL 2 000、T4连接酶等购自宝生物工程(大连)有限公司;dNTP、Taq 酶、琼脂糖(电泳纯)为上海生工生物工程技术服务有限公司产品;DNA 清洁/PCR 产物清洁试剂盒、DNA 凝胶回收试剂盒为杭州维特洁生化技术有限公司产品。
1.2 方法
1.2.1 引物设计 经Oligo 6.0 软件分析,参照GenBank数据库中登录的番鸭细小病毒基因序列(登录号:KC171936),设计一对特异性扩增引物。P-1:5′-CCGAACCTGTGGCAGCATCTAAAATGGCAGAG-3′,P-2:5′-TGATTGGCTGGTTCGAACGAACGAA-3′。预期目的扩增片段大小为1 733bp,命名为AH-MDPV-VP3。引物由宝生物工程(大连)有限公司合成。
1.2.2 基因组DNA 的提取 将MDPV 分离株接种13日龄番鸭胚,收集72h后死亡胚胎的尿囊液,将尿囊液经5 000r/min离心10min,取上清,分别加入100g/L的SDS至终浓度为20g/L,再加蛋白酶K 至50μg/mL,充分混匀,37℃水浴2h后,用等量饱和酚抽提1 次,再用等量饱和酚-氯仿抽提2次,用等体积氯仿抽提1次,加入1/10体积3mol/L NaAc(pH 5.2)和2倍体积预冷的无水乙醇,16 000 r/min离心10 min,沉淀病毒核酸,TE(pH 8.0)溶解,置-20℃保存备用[12]。
1.2.3 基因的扩增 以提取的基因组DNA 为模板,采用P1 和P2 为上、下游引物,扩增基因AHMDPV-VP3。PCR 反应体系:10×PCR buffer 5.0 μL,dNTP Mixture 3.0μL,上、下游引物各1.0 μL,DNA 2.5μL,Taq DNA 聚合酶0.5μL,加双蒸水补足60μL。按以下程序进行扩增:94℃5 min;94℃30s,56℃30s,72℃3min,30个循环;72℃延伸10 min。扩增产物经8g/L 琼脂糖凝胶电泳检测,阳性产物送上海生工生物工程技术服务有限公司测序。
1.2.4 基因序列分析 测序后的基因序列在NCBI(http://blast.ncbi.nlm.nih.gov/blast.cgi)数据库中进行相似性比对搜索,选择番鸭、鸭和鹅细小病毒株共9条参比序列作为分析样本,登录号分别为番 鸭 KC171936 和 KM093740,鹅 KC478066、KC996730、KC184133、FJ240170 和KP053633,鸭AY382891和AY382892。使用Clustal X 1.83 软件比对序列,采用DNAStar、MegAlign等软件分析各序列特征。
2 结果
2.1 基因组DNA 的提取
所提取的两个样品基因组DNA 在2 000bp上方均有明显的DNA 条带(图1),虽然部分条带有轻微降解拖尾现象,但由于PCR 的高敏感性,该模板能够满足后续实验的要求。
2.2 番鸭AH-MDPV-VP3基因的扩增
以提取的基因组DNA 为模板,P1和P2为引物PCR 扩增获得了一条约1 700bp 大小的特异性DNA 片段(图2),将扩增的基因产物纯化、测序。结果与GenBank中登录的相应基因序列进行比对。
2.3 同源性分析
测 序 结 果 表 明,AH-MDPV-VP3 基 因 全 长1 733bp,包含完整MDPV VP3蛋白阅读框,1 605 bp编码534个氨基酸。将AH-MDPV-VP3与其他在GenBank数据库获得的番鸭、鹅和鸭的相应VP3基因氨基酸序列进行同源性比较(图3)。结果表明,10条基因序列的同源性介于89.3%~100%之间;AH-MDPV-VP3与两个番鸭基因KC171936和KM093740序列同源性分别为100%和98.3%;与鹅细小病毒同源性均相对较低,介于96.1%~96.4%之间;而与台湾分离的鸭细小病毒基因AY382891和AY382892 同源性分别为91.6%和90.8%。同时可见,鹅细小病毒毒株间同源性均大于98.9%,两个鸭细小病毒毒株同源性为99.1%,说明各物种VP3基因较为保守。
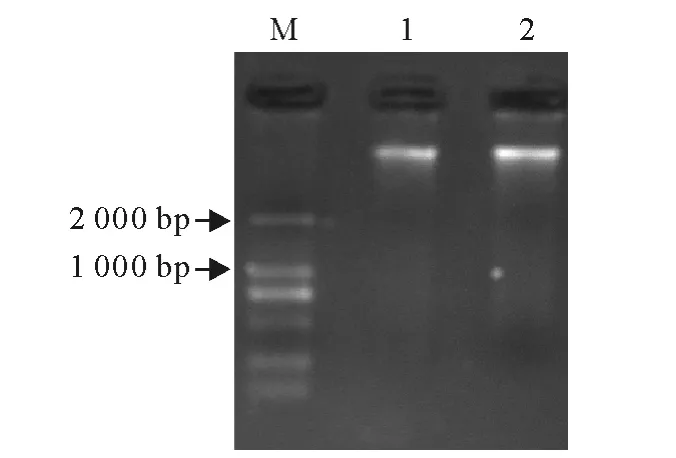
图1 基因组DNA 电泳图Fig.1 Electrophoresis of genome DNA
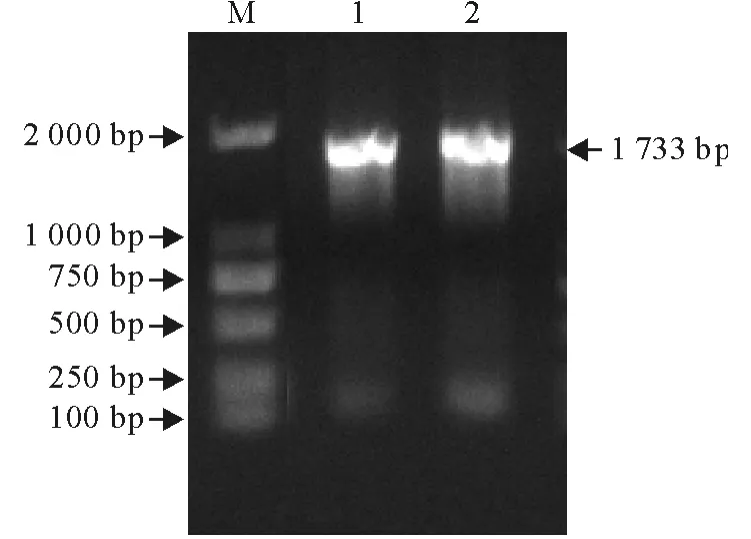
图2 AH-MDPV-VP3基因的PCR 扩增Fig.2 PCR amplification of AH-MDPV-VP3gene
2.4 序列进化分析
采用MEGA 分析软件,将获得的10条番鸭、鹅和鸭的细小病毒VP3氨基酸序列构建系统发育树(图4)。结果可见,所比对序列分为番鸭、鹅和鸭细小病毒3 个类群。AH-MDPV-VP3与国内两个番鸭细小病毒基因KC171936和KM093740聚集为一组,进一步证实三者亲缘关系较近,来源于共同祖先;而与5个鹅细小病毒和2个台湾分离的鸭细小病毒分离株VP3基因遗传距离则相对较远。

图3 VP3氨基酸序列同源性比对(%)Fig.3 The homology alignment of VP3amino acid sequences(%)

图4 VP3氨基酸序列系统发育树Fig.4 Phylogenetic tree of VP3amino acid sequences
3 讨论
近年来,随着番鸭养殖业的规模化发展,出现了许多新的疫病和重新流行的疫病,番鸭细小病毒已经成为危害世界番鸭养殖业较为严重的病毒之一[13]。本研究克隆了番鸭细小病毒结构蛋白的VP3基因,该基因包含全长1 605bp的完整蛋白阅读框,编码534个氨基酸。氨基酸序列同源性和进化分析表明,AH-MDPV-VP3与国内两个番鸭细小病毒基因同源性较高,来源于共同祖先;而与鹅细小病毒,尤其与台湾分离的鸭细小病毒同源性相对较低,遗传距离也相对较远;同时可见番鸭、鹅和鸭细小病毒的VP3基因各自均较为保守,仅有少数氨基酸发生变异。此外,多个研究也表明不同来源的鹅细小病毒株VP3基因核苷酸和氨基酸序列的同源性均较高,显示鹅VP3基因较为保守[14-16]。
鹅细小病毒是小鹅瘟这一烈性传染病的病原,鹅细小病毒既能感染鹅又可以感染番鸭,同样是危害极为严重的疫病之一。鹅细小病毒与番鸭细小病毒的病毒形态结构、基因组、病理变化和临床症状等方面较为相似,在实际生产中小鹅瘟雏鹅活疫苗和抗血清也能够提高雏番鸭对番鸭细小病毒的抵抗能力[12,17-19]。本研究也发现番鸭细小病毒与鹅细小病毒VP3基因同源性相对较低,但也均大于94.9%,说明两者的相似性较高。尽管鹅细小病毒与番鸭细小病毒有很多相似的特点,但感染的寄主却有不同,两者在抗原特征上存在较大差异,且不同分离株致病性也存在差异,因此研究其相关抗原基因的变异对于疫苗株的筛选有着极其重要意义。研究表明利用鹅细小病毒VP3基因制备的亚单位疫苗能够诱导鹅产生鹅细小病毒抗体,使新生雏鹅获得良好的免疫保护[20]。VP3是病毒的主要衣壳蛋白,约占总蛋白含量的80%,内含有主要抗原决定簇成分,且暴露于病毒粒子表面,是病毒刺激机体产生中和抗体的主要抗原蛋白[17,21]。所以该基因在细小病毒的免疫诊断及免疫防控中无疑具有不可替代的作用[21]。本研究克隆了番鸭细小病毒的VP3 基因,并分析其分子结构特征,可为深入研究番鸭细小病毒遗传学特点,以及获得更有效的预防控制方法奠定了基础。
[1] 万春和,朱海侠,黄 瑜,等.一株鹅细小病毒全基因特征分析[J].中国动物传染病学报,2011,19(4):19-24.
[2] 刘家森,姜 骞,司昌德,等.番鸭细小病毒与鹅细小病毒PCR 鉴别诊断方法的建立[J].中国兽医科学,2007,37(6):469-472.
[3] 陈 瑶,关 淼.雏番鸭细小病毒病的诊断与防制[J].现代畜牧兽医,2010(4):42-44.
[4] 崔国杰,陈少莺.番鸭细小病毒和小鹅瘟病毒混合感染的诊治[J].畜牧与兽医,2015,47(3):147-148.
[5] 谢丽基,谢芝勋,刘加波,等.番鸭细小病毒荧光定量PCR 方法的建立及初步应用[J].中国预防兽医学报,2013,35(3):218-221.
[6] 程晓霞,陈仕龙,陈少莺,等.番鸭细小病毒和鹅细小病毒的抗原相关性研究[J].福建农业学报,2013,28(9):869-871.
[7] 殷 震,刘景华.动物病毒学[M].2 版.北京:科学出版社,1997:1165-1167.
[8] 林世裳,郁晓岚,陈炳钿,等.一种新的雏番鸭病毒性传染病[J].中国畜禽传染病,1991,57(2):25-26.
[9] 宋永峰,吴发兴,宋延华,等.2008年-2009年广东番鸭细小病毒分子流行病学研究[J].中国动物检疫,2010(1):39-40.
[10] Woolcock P R,Jestin V,ShivaPrasad H L,et a1.Evidence of muscovy duck parvovirus in muscovy duckling in California[J].Vet Rec,2000(1):68-72.
[11] 王文秀,张松林,付 强,等.番鸭细小病毒ZQ 分离株非结构蛋白基因的克隆及序列分析[J].动物医学进展,2013,34(12):79-83.
[12] 季 芳,张毓金,杨增岐,等.番鸭细小病毒和鹅细小病毒广东株VPl基因的克隆与序列分析[J].中国预防兽医学报,2004,26(4):245-247.
[13] 张 云,耿宏伟,郭东春,等.鹅和番鸭细小病毒全基因克隆与序列分析[J].中国预防兽医学报,2008,30(6):415-419.
[14] 李雪梅,章金刚,向 华,等.鹅细小病毒国内分离株主要结构蛋白(Vp2-Vp3)基因的克隆和序列分析[J].动物科学与动物医学,2001,18(3):31-34.
[15] 张 鑫,李柏岁,徐 佳,等.鹅细小病毒四平分离株VP3基因的克隆与序列分析[J].吉林农业大学学报,2006,28(4):436-439.
[16] 邵红霞,吕亚楠,叶建强,等.2013年苏皖地区鹅细小病毒的分离鉴定及其VP3 基因序列分析[J].中国兽医学报,2014,34(12):1916-1921.
[17] Zadori Z,Stefancsik R,Rauch T,et al.Analysis of complete nueleotide sequence of goose and muscovy duck parvovirus indicates common ancestral origin with adeno-associated virus[J].Virol,1995,212:562-573.
[18] 范文胜,吴阳开,方文棋,等.番鸭细小病毒与鹅细小病毒鉴别诊断方法的建立及初步应用[J].中国家禽,2014,36(22):20-23.
[19] 刘 伟,程晓霞,陈少莺.番鸭源小鹅瘟病毒和番鸭细小病毒的结构蛋白及其抗原性[J].福建农林大学学报:自然科学版,2015,44(1):64-68.
[20] 杨焕章,王 凯,陈绍红,等.鹅细小病毒VP3亚单位疫苗的制备及其免疫效果[J].动物医学进展,2013,34(10):41-45.
[21] 黄 瑜,朱于敏,董世娟,等.雏番鸭细小病毒vp3基因的原核表达及增殖病毒的检测[J].生物工程学报,2015,31(1):65-74.