加速溶剂萃取-高效液相色谱法测定固体废物中多环芳烃
2015-06-09李红亮王维思王媛媛王晶晶
彭 华,陈 纯,王 楠,李红亮,王维思,王媛媛,王晶晶
河南省环境监测中心,河南 郑州 450004
加速溶剂萃取-高效液相色谱法测定固体废物中多环芳烃
彭 华,陈 纯,王 楠,李红亮,王维思,王媛媛,王晶晶
河南省环境监测中心,河南 郑州 450004
建立了固体废物中多环芳烃的快速溶剂萃取(ASE)-高效液相色谱(HPLC)检测方法。加速溶剂萃取仪在温度100 ℃、压强1.05 MPa条件下,以体积比1∶1的丙酮和二氯甲烷为萃取剂,萃取5 min,萃取液采用固相萃取柱或凝胶色谱净化。灰渣和污泥中的PAHs的方法检出限分别为1.03~1.96 μg/kg和4.71~7.04 μg/kg,相对标准偏差分别为4.0%~13.8%和3.3%~13%,加标回收率分别为73.2%~89.8%和67.7%~90.5%。
加速溶剂萃取;高效液相色谱;固体废物;多环芳烃
多环芳烃(PAHs)是指分子中含有2个或2个以上苯环结构的非极性或中性有机化合物。PAHs在环境中的来源分天然源和人为源,天然源即PAHs在环境中的背景值,主要来源于陆地和水生生物、微生物的生物合成,森林、草原的天然火灾以及火山活动,一般含量较低[1];人为源则主要来自化石燃料、木材、烟草等有机物的热解和不完全燃烧,是目前环境中PAHs的主要来源[2-3]。由于具有致癌、致畸、致突变作用,对人类健康危害极大,加之分布范围广且难以生物降解,PAHs已引起世界各国的广泛关注,美国环保局将16种PAHs列入优先控制处理的重点污染物名单;中国将7种母体PAHs列为水中优先控制污染物[4];德国安全性认证组织从2012年7 月将管控的PAHs 种类由16种扩大为18种。PAHs种类繁多,物理化学和光学性质均存在较大差异,如何同时准确地测定环境介质中各种PAHs,一直是环境监测的一个热点问题。
目前,我国现有的关于PAHs的标准分析方法也主要集中在水质、环境空气和固定污染源废气等环境介质方面,对固体废物中PAHs的监测则少有涉及,仅在《危险废物鉴别标准 浸出毒性鉴别》中对固废浸出液以附录的形式给出了参考方法。然而,在PAHs的人为源中,垃圾焚烧的贡献率非常大,产生的PAHs也往往存在于煤灰、炉渣中[5-6],其中的PAHs的浸出风险也不容忽视[7]。我国的固体废物污染防治起步较晚,随着工业固体废物的产生量逐年增加,固废污染防治面临着艰巨任务。为了控制和监测固体废物中的PAHs排放,有效监督和控制工业固体废物的污染,必须研究与之相配套的PAHs监测分析方法。
相比于其他方法,高效液相色谱法具有选择性好、灵敏度高的优点,是分析PAHs的推荐方法[8]。样品萃取方法可选用索氏提取法、超声提取法、超临界流体萃取、微波辅助萃取、加速溶剂萃取等方法,净化方法可选用固相萃取柱和凝胶色谱净化法。在样品提取方面,加速溶剂萃取(ASE)相比于传统方法具有溶剂用量少、快速、安全等突出特点,近些年被广泛用于固态样品的前处理[9-10]。本文对灰渣和污泥2种有代表性的固体废物采用加速溶剂萃取-高效液相色谱法测定,研究了样品净化方法和条件、最佳分离和检测条件,以期建立一套完整的固体废物PAHs监测方法。
1 实验部分
1.1 仪器设备
ASE-200型加速溶剂萃取仪;J2Accuprep型凝胶渗透色谱仪;Alliance 2695型高效液相色谱仪。
1.2 试剂和材料
1.2.1 有机溶剂
乙腈(CH3CN)、甲醇(CH3OH)、正己烷(C6H14)、戊烷(C5H12)、二氯甲烷(CH2Cl2)、丙酮(CH3OCH3),均为色谱纯;十氟联苯(纯度为99%)。
1.2.2 标准溶液

PAHs标准贮备液:质量浓度100~2 000 mg/L,于4 ℃以下温度冷藏;PAHs标准使用液:质量浓度10.0~200 mg/L,于4 ℃以下温度冷藏。
1.2.3 材料
干燥剂:无水硫酸钠(Na2SO4)或粒状硅藻土,400 ℃下焙烧2 h,然后将温度降至100 ℃,关闭电源转入干燥器中,冷却后装入试剂瓶中,于干燥器中密封保存。
固相萃取柱(硅胶):6 mL萃取柱中装填500 mg硅胶。
氮气:纯度大于或等于99.999%,用于样品的干燥浓缩。
1.3 样品的制备
选用较有代表性的灰渣和污泥,参照《工业固体废物采制样技术规范》(HJ/T 20—1998)有关要求进行采样和制样。其中污泥样品由于含水率较高(70%~80%),制样前于-80 ℃下冷冻干燥96 h后待用。
1.4 样品的提取
灰渣称样量为10 g,污泥称样量为2 g,加入适量硅藻土混匀后装入33 mL萃取池。
萃取溶剂:体积比1∶1的丙酮和二氯甲烷、体积比1∶1的丙酮和正己烷、体积比1∶1的二氯甲烷和正己烷。
加热温度60~100 ℃;压强7~14 MPa;静态萃取时间5 min(5 min预加热平衡);淋洗体积60%池体积;氮气吹扫60 s,1.05 MPa(可根据萃取池体积增加吹扫时间);静态萃取次数 2次。
在玻璃漏斗上垫上一层玻璃棉或玻璃纤维滤膜,铺加约5 g无水硫酸钠,将萃取液用漏斗直接过滤到浓缩器皿中,每次用少量萃取溶剂充分洗涤萃取容器,将洗涤液也倒入漏斗中,重复3次。最后再用少许萃取溶剂冲洗无水硫酸钠,氮吹浓缩至1 mL。
1.5 样品的净化
对比研究2种净化方法:固相萃取柱净化(SPE)和凝胶渗透色谱净化(GPC)。
SPE:填料为硅胶,依次用5 mL二氯甲烷和15 mL正己烷冲洗净化柱,弃去流出液。在溶剂流干之前,将1 mL萃取浓缩液转移到净化柱上,并用约0.5 mL的正己烷冲洗浓缩瓶,将洗涤液加入净化柱,然后再用2 mL二氯甲烷洗涤浓缩瓶,将洗涤液加入净化柱,用合适的容器接收流出液,最后用15 mL二氯甲烷洗涤净化柱,收集流出液于上述容器中。流出液经硫酸钠脱水、浓缩定容至1 mL以下,加入3 mL乙腈,再浓缩至1 mL,待测。
GPC:流动相为二氯甲烷。将第1.4节的提取浓缩液用流动相定容至2.5 mL于小瓶,混匀后用GPC法进行净化。流速为3 mL/min,定量环体积2 mL,收集9~13 min洗脱液,35 ℃下恒温浓缩至1.5~2.0 mL,氮吹至近干,环己烷定容至1 mL,待测。
1.6 仪器分析条件
色谱柱采用PAHs分析柱(250 mm×4.6 mm,5.0 μm),流动相为乙腈/水,流速为1.0 mL/min。梯度洗脱程序:先用乙腈/水(体积比3∶2)以1.0 mL/min的流速洗脱8 min,然后进行线性梯度洗脱,在10 min内乙腈体积分数由60%上升到100%,并保持10 min;紫外检测器和荧光检测器波长选择与《水质 多环芳烃的测定 液液萃取和固相萃取高效液相色谱法》(HJ 478—2009)一致。
1.7 样品测定
取10 μL待测试样注入高效液相色谱仪中。记录色谱峰的保留时间和峰高(或峰面积)。采用保留时间进行定性,或采取标准样品添加法定性,或借助其他仪器验证。外标法定量。
使用10 g河砂或石英砂替代样品,按照与样品的预处理、测定相同步骤进行分析。
2 结果与讨论
2.1 ASE萃取条件的选择
提高温度能极大地减弱由范德华力、氢键、目标物分子和样品基质活性位置的偶极吸引所引起的相互作用力;增加萃取池中的压力使溶剂沸点升高,保证目标物在此温度下的溶解能力。因此,合适的溶剂、压力、温度是保证ASE高萃取效能的关键。前期对土壤中PAHs的ASE萃取条件研究结果表明[11],体积比1∶1的丙酮和正己烷萃取效果明显高于正己烷或环己烷,对绝大部分PAHs回收率为85%~107%;温度高有利于PAHs的萃取,但在80~110 ℃之间回收率相差不大,除了萘、苊烯、二氢苊回收率较低,其他PAHs均在86%~120%之间;压强在7~14 MPa之间时,对PAHs萃取的回收率影响不大。基于这一成果对PAHs的ASE萃取条件进行进一步的研究,由于压力影响不大,侧重对溶剂和温度进行优化选择。
2.1.1 萃取溶剂的选择
大量研究表明,丙酮和二氯甲烷、丙酮和正己烷等混合溶剂对PAHs的萃取效果优于单独使用正己烷等溶剂。对不同溶剂的萃取效率进行了研究,结果如图1所示。
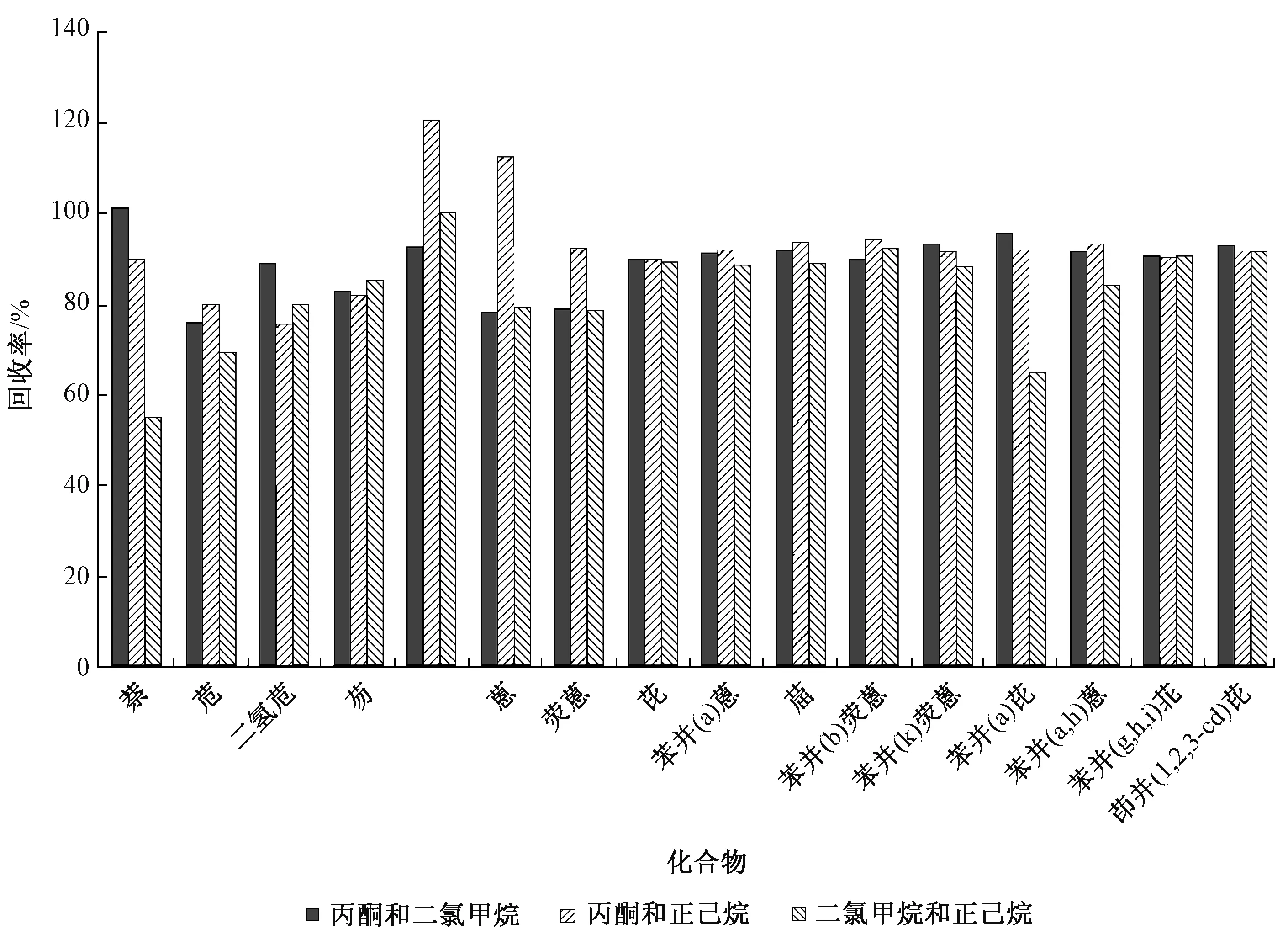
图1 不同萃取溶剂PAHs的回收率
从图1可以看出,体积比1∶1的二氯甲烷和正己烷相对于另外2种溶剂萃取效率略低,特别对于萘等低环PAHs回收率在70%以下。体积比1∶1的丙酮和二氯甲烷对16种PAHs的回收率为76.1%~101.3%,体积比1∶1的丙酮和正己烷为75.6%~120.5%。相对于体积比1∶1的丙酮和正己烷,体积比1∶1的丙酮和二氯甲烷对16种PAHs的回收率差别不大,萃取效果更好,可能与丙酮的强溶解能力和丙酮、二氯甲烷的强亲核性质有关[12]。
2.1.2 萃取温度的选择
用体积比1∶1的丙酮和二氯甲烷作萃取溶剂,研究了不同萃取温度对萃取效率的影响,结果见图2。
一般来讲,提高温度能极大地减弱由范德华力、氢键、目标物分子和样品基质活性位置的偶极吸引所引起的相互作用力,减小溶剂黏性和表面张力,从而使溶剂更好地渗透到基质中,快速、有效地萃取基质中的目标物[15]。从图2可见,相对于60 ℃和80 ℃,体积比1∶1的丙酮和二氯甲烷在100 ℃条件下萃取效果较好,在120、140 ℃下,各种PAHs回收率差别较大,个别PAHs萃取效果较差。
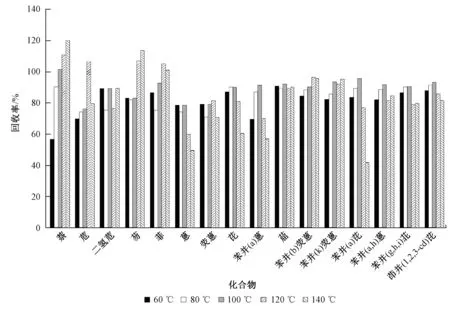
图2 不同萃取温度PAHs的回收率
2.2 净化条件的优化
2.2.1 SPE净化淋洗溶剂和淋洗体积的选择
在淋洗溶剂的选择上,以往研究得出的结论并不一致。《水质 多环芳烃的测定 液液萃取和固相萃取高效液相色谱法》(HJ 478—2009)中使用10 mL体积比1∶1的二氯甲烷和正己烷;黄东琴等[14]认为体积比3∶2的正己烷和二氯甲烷对土壤中PAHs洗脱效果最好;张茜等[10]认为二氯甲烷单独使用时对土壤中PAHs洗脱效果最好。本研究对比了这几种淋洗液对PAHs的淋洗效果,发现用二氯甲烷作为淋洗液时净化效果最好,既能除去杂质干扰,又能保证有较高的回收率。用二氯甲烷作为淋洗液时的淋洗曲线如图3所示。
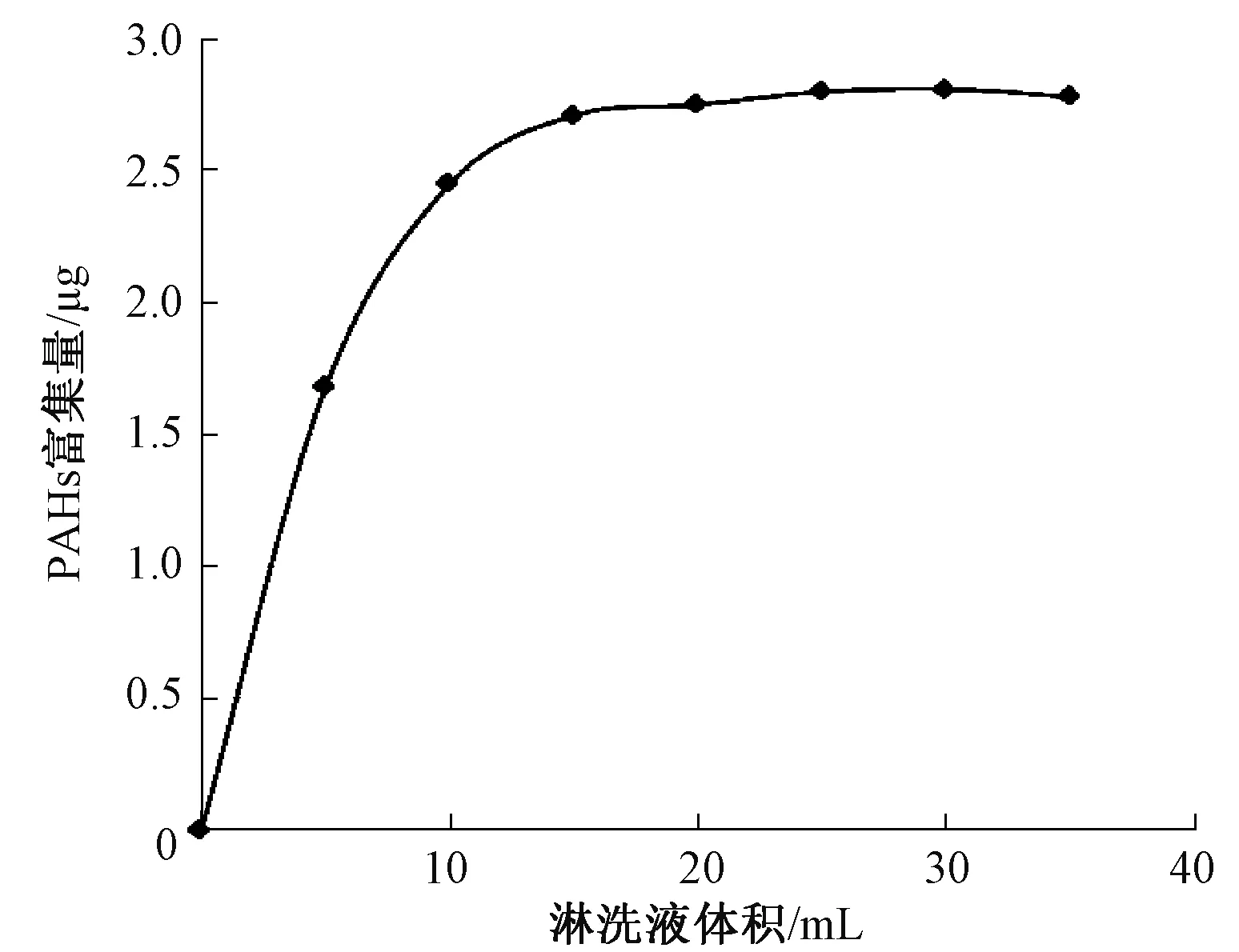
图3 二氯甲烷对灰渣中PAHs的淋洗曲线
从图3可以看出,PAHs的富集量随淋洗液体积的增加而增加,淋洗液体积增至15 mL后,PAHs富集量基本不变。因此,淋洗液体积选用15 mL。
2.2.2 GPC净化收集时间的选择
将配制好的16种PAHs混合标准样品置于GPC净化系统上,从1 100 s开始每隔120 s收集流出液于试管中,共收集20瓶,氮吹至近干,乙腈定容1 mL后进行检测,结果发现PAHs在1 340~3 380 s之间全部流出,故收集时间定为1 340~3 380 s。
2.2.3 SPE和GPC净化效果对比
SPE与GPC2种净化方式的回收率分别见图4和图5。图4显示了2种净化方式对灰渣中PAHs的回收率。可见,除了芴、蒽、苯并[a]蒽3种PAHs外,SPE与GPC无明显差别,回收率分别为71.1%~87.7%和73.6%~85.9%。而对于芴、蒽和苯并[a]蒽,用SPE时,芴、蒽和苯并[a]蒽回收率分别为82.9%、87.5%、87.7%,净化效果明显好于GPC(3种PAHs回收率分别为58.6%、61.1%、57.2%)。
图5显示了2种净化方式对污泥中PAHs的回收率。2种方式对芴、蒽和苯并[a]蒽的净化效果仍然有所区别,但GPC优于SPE。2种净化方式对污泥中PAHs的净化效果不如对灰渣的净化效果,SPE和GPC对16种PAHs的回收率分别为55.7%~94.1%和57.6%~96.1%,各物质间回收率差别较大。相对来讲,GPC对污泥的净化效果略优于SPE。
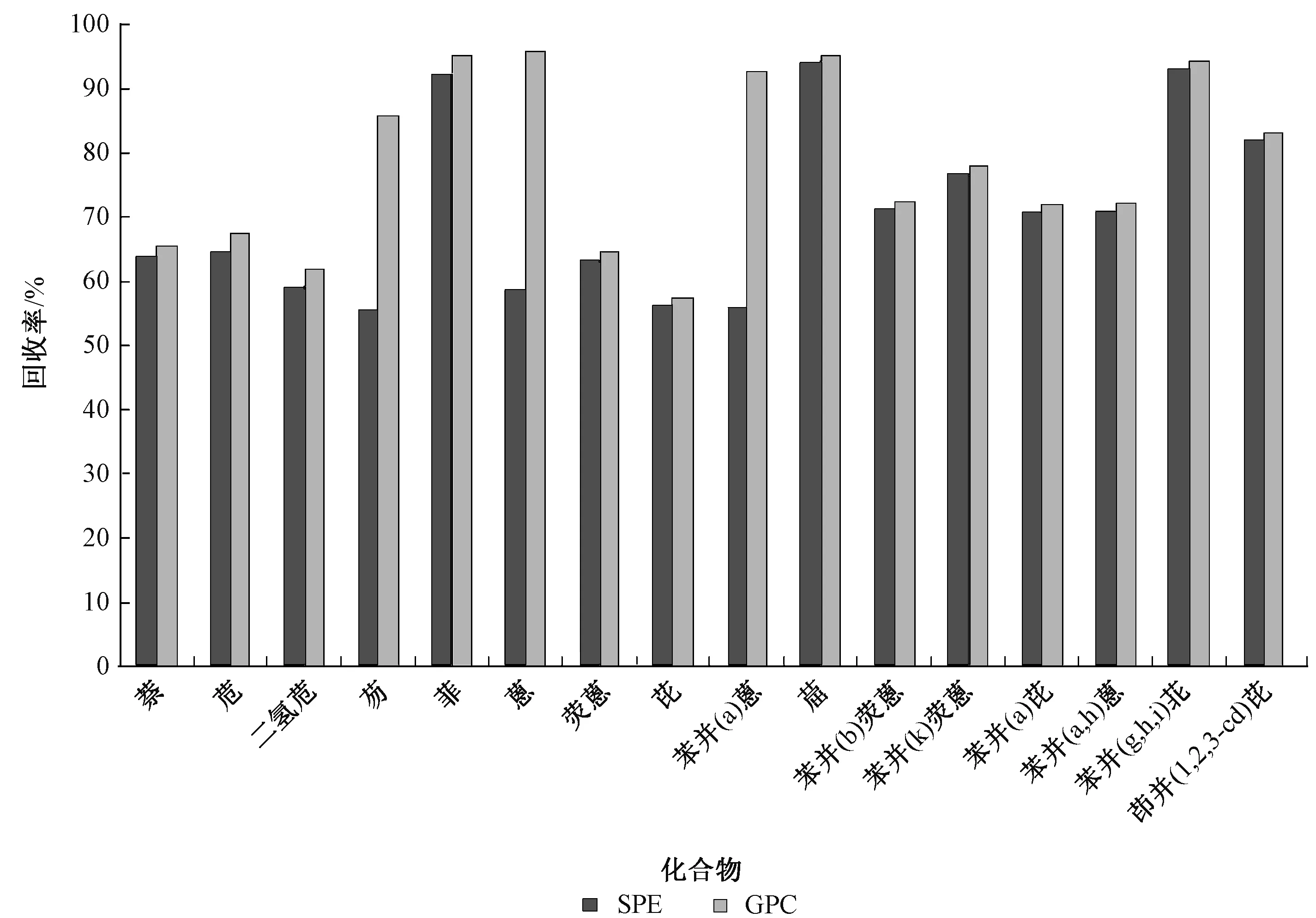
图4 灰渣中PAHs在不同净化方式下的回收率
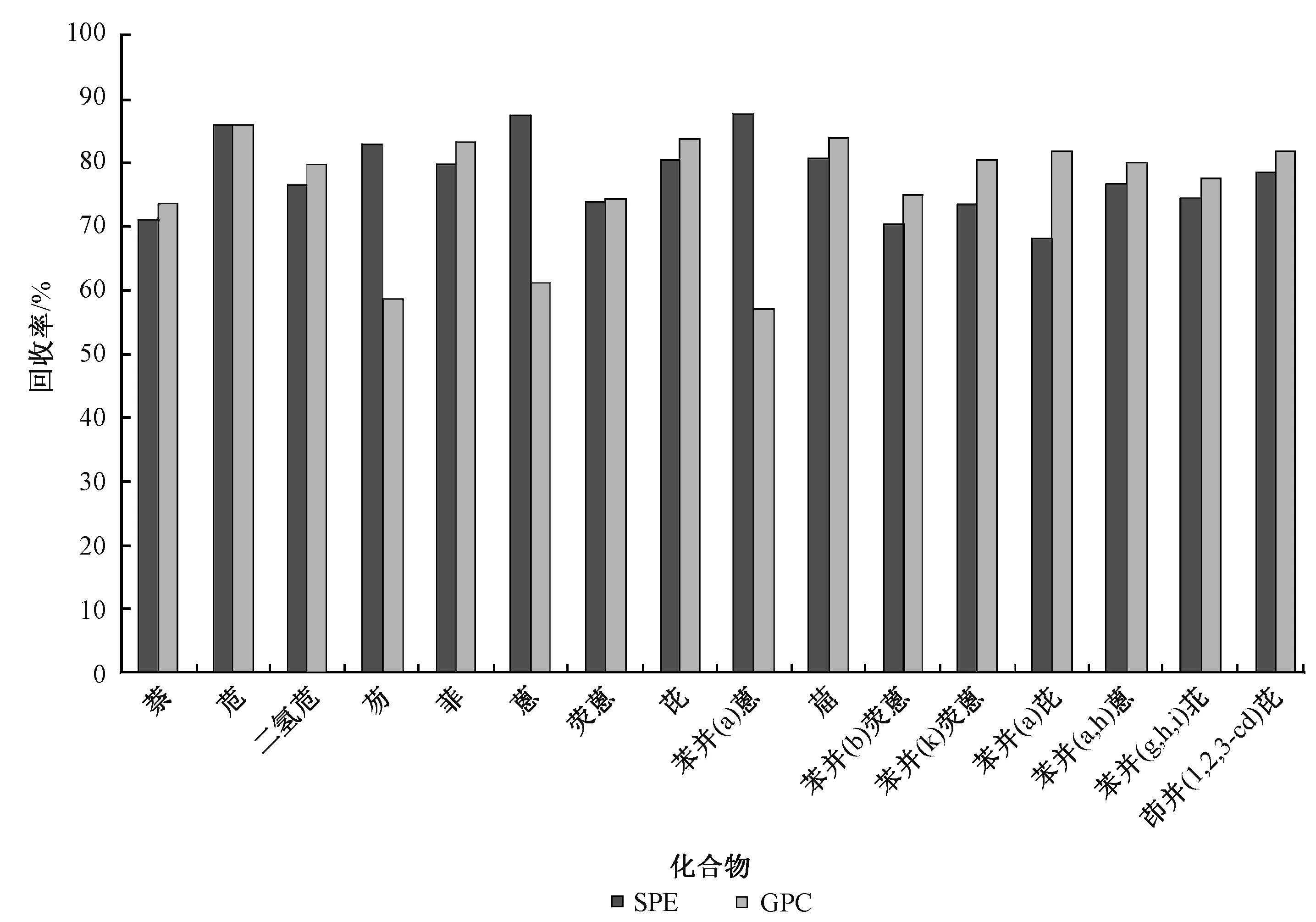
图5 污泥中PAHs在不同净化方式下的回收率
2.3 方法性能指标
本文以灰渣和污泥为例对方法的检出限、精密度和准确度进行了测定。灰渣称样量10 g,污泥称样量为2 g。
2.3.1 方法检出限和测定下限
按照全程序操作步骤重复7次空白加标实验,加标量为仪器检出限的3~10倍,使用与实际样品完全相同的试剂和全程序操作步骤进行测定,计算方法检出限(MDL),以4倍检出限为测定下限。
16种PAHs的方法检出限及测定下限分别见表1和表2。
黄东琴等[14]用ASE-HPLC法测定土壤中PAHs时,检出限为0.14~36 μg/kg;张茜等[10]用ASE提取、GPC联合SPE(固相萃取)、HPLC法测定土壤中PAHs时,检出限为0.1~6 μg/kg。固体废物中PAHs的液相色谱法检出限还未见文献报道。本文分别研究了荧光检测器和紫外检测器的液相色谱法检出限,由表1、表2可见,对灰渣样品中的PAHs,荧光检测器的方法检出限为1.03~1.96 μg/kg,紫外检测器的方法检出限为2.30~3.88 μg/kg;对污泥样品,荧光检测器的方法检出限为4.71~7.04 μg/kg,紫外检测器的方法检出限为7.36~11.1 μg/kg。
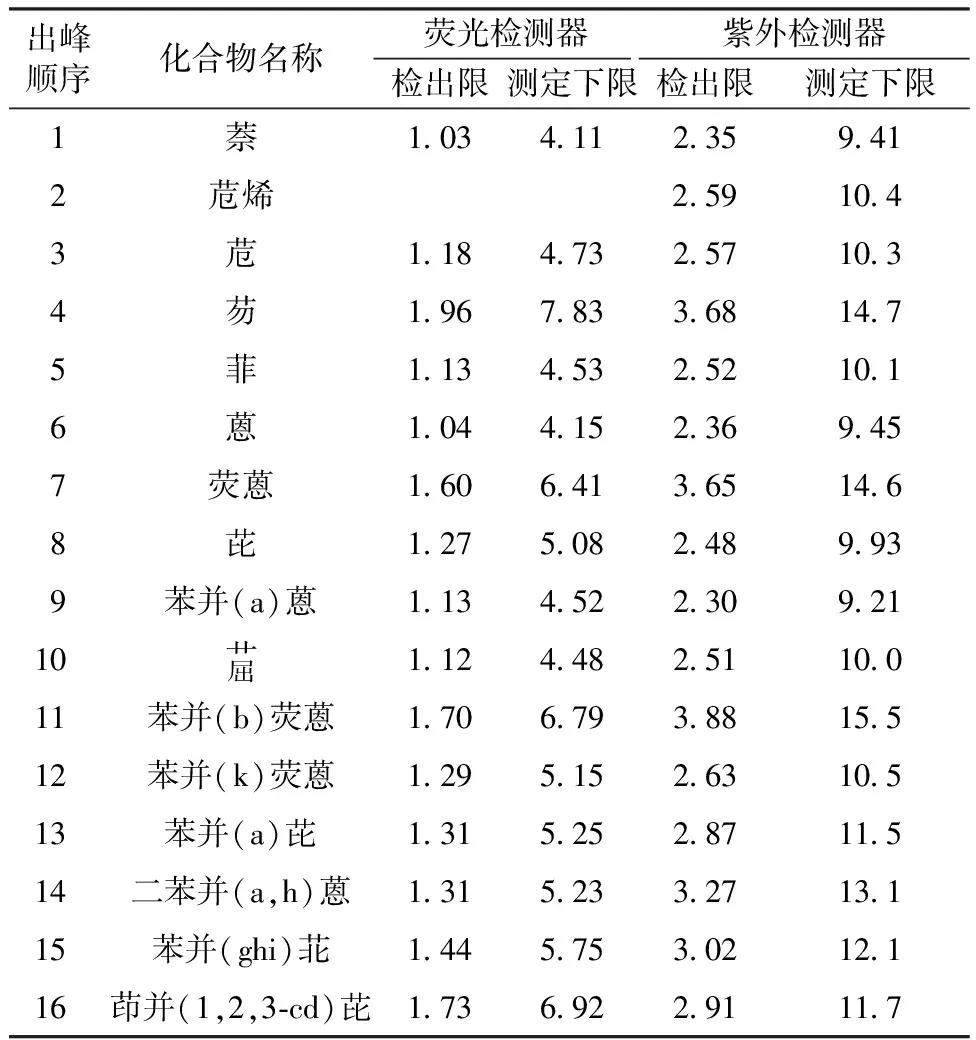
表1 16种PAHs的检出限、测定下限(灰渣) μg/kg
注:空表示荧光检测器检测时无信号值。下同。
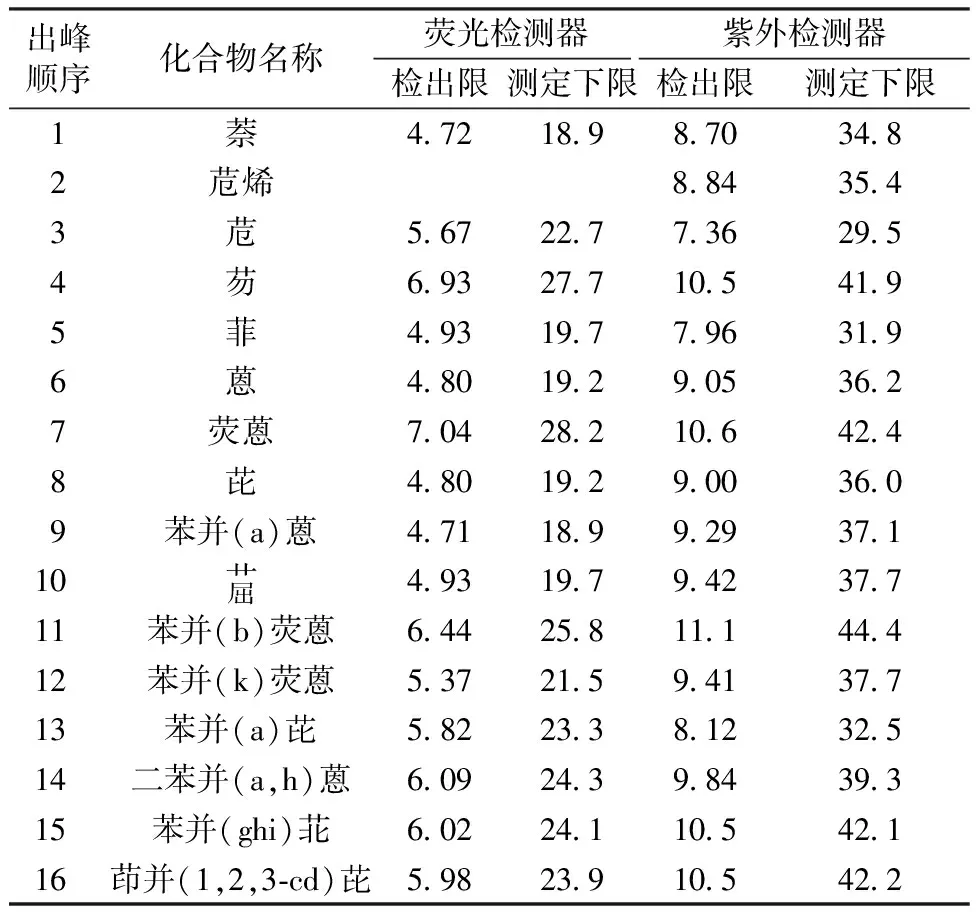
表2 16种PAHs的检出限、测定下限(污泥) μg/kg
2.3.2 方法精密度和准确度
精密度采用实际样品加标的方法测定,灰渣和污泥的加标量分别为3个水平:2.5~50、5~100、10~200 μg/kg和12.5~250、25~500、50~1 000 μg/kg,按照标准方法的分析步骤进行测定,分别测定6次,计算其相对标准偏差,结果分别见表3和表4。
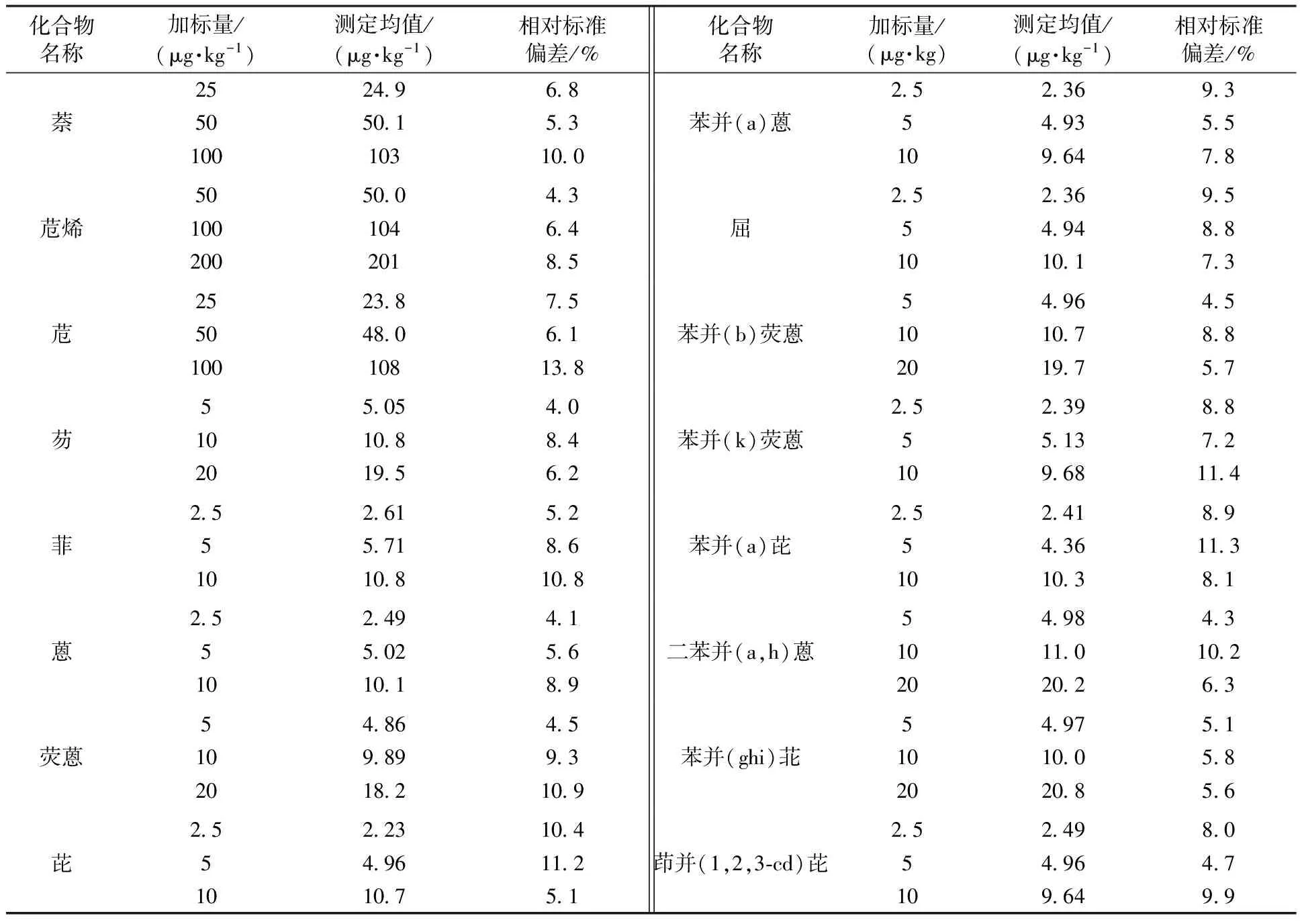
表3 方法的精密度测定结果(灰渣)
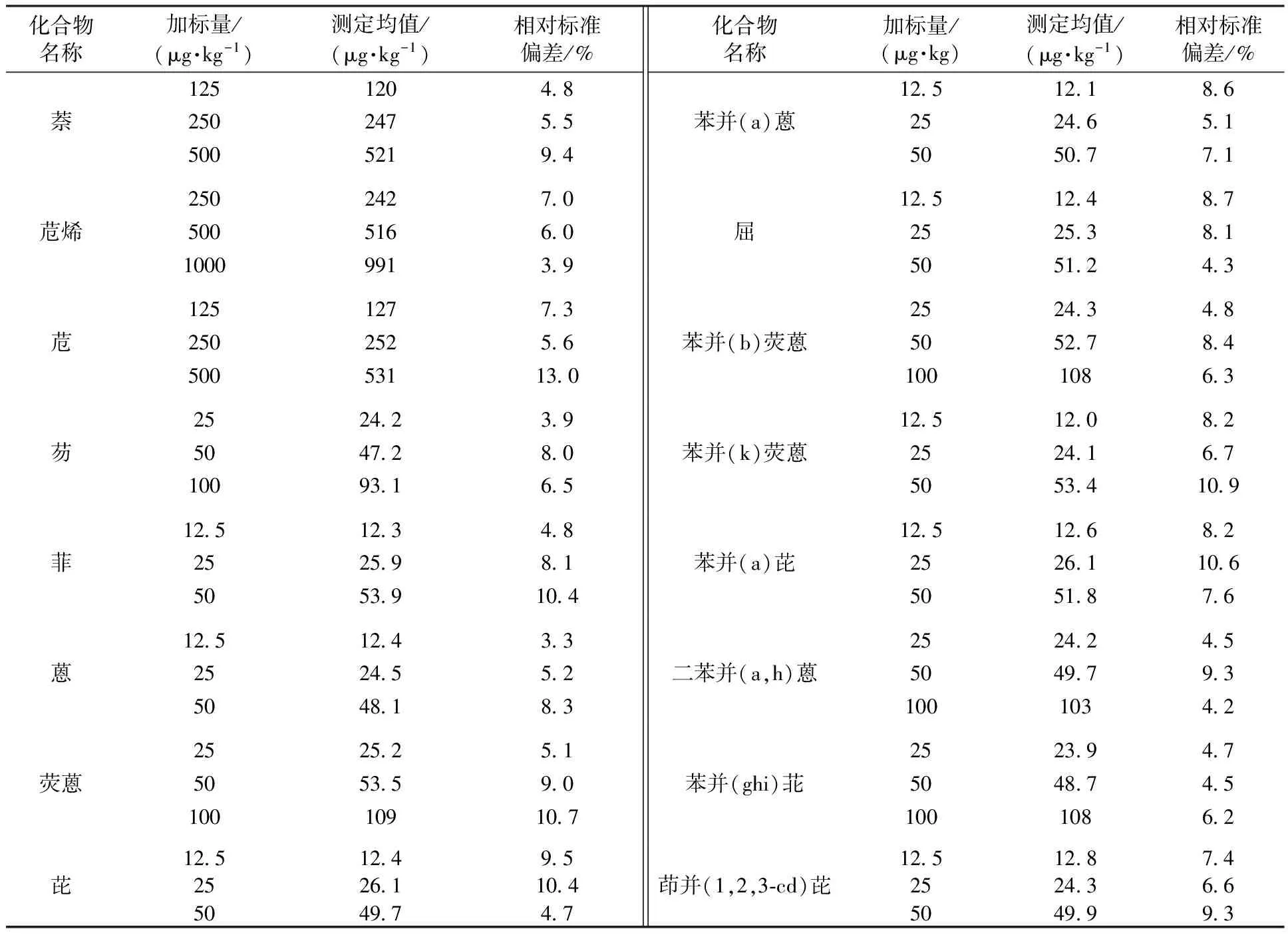
表4 方法的精密度测定结果(污泥)
由表3、表4可见,灰渣样品中PAHs的6次测定相对标准偏差为4.0%~13.8%;污泥样品中PAHs的6次测定相对标准偏差为3.3%~13.0%。16种PAHs在灰渣中的加标回收率为73.2%~89.8%,在污泥中的加标回收率为67.7%~90.5%。
准确度采用加标回收率进行评价,加标量为0.1~2 μg,结果见表5。
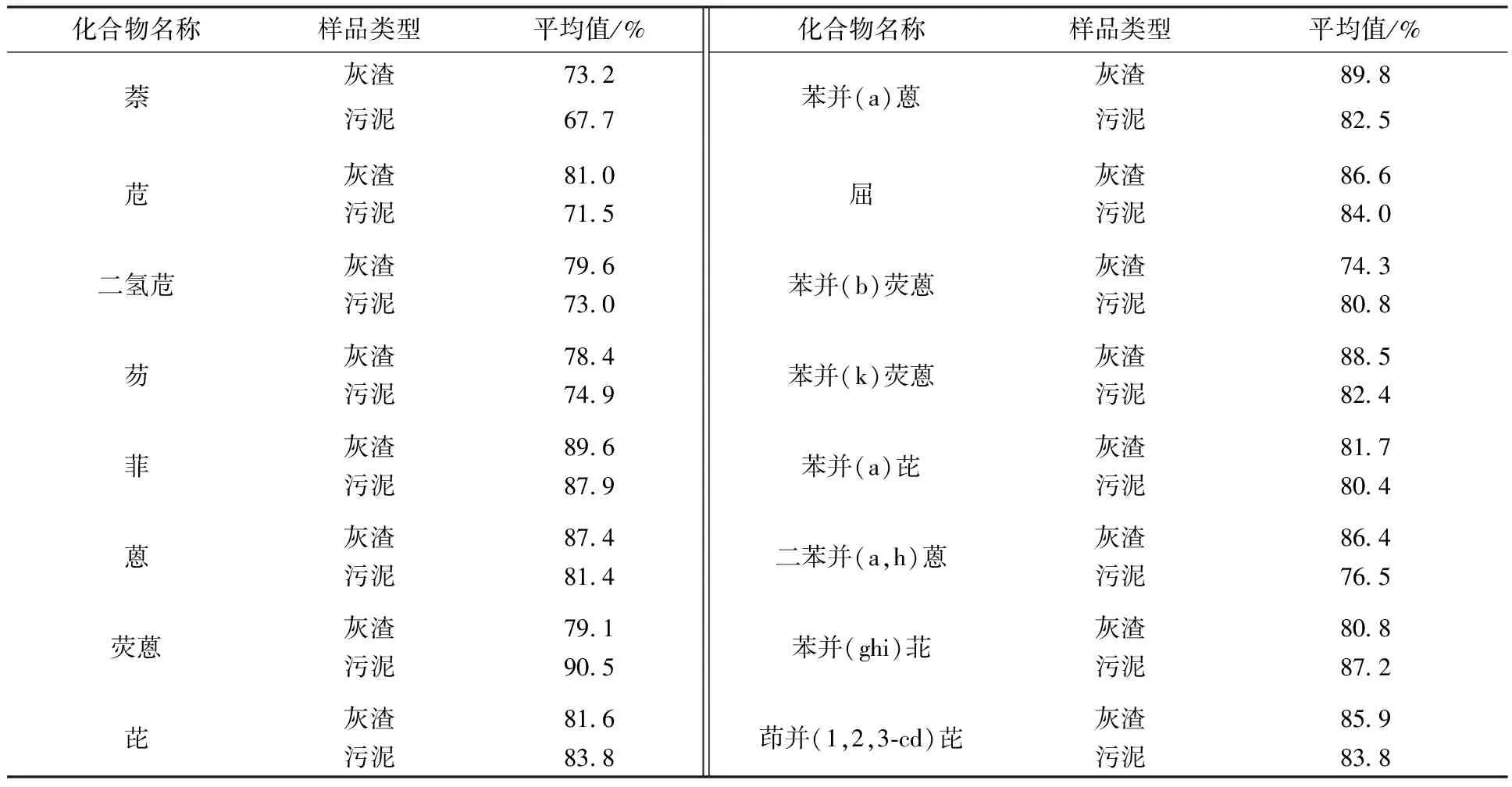
表5 加标回收率测定结果
3 结论
研究了固体废物中PAHs的ASE萃取、SPE和GPC法净化、HPLC检测方法。ASE萃取条件:体积比1∶1的丙酮和二氯甲烷作萃取剂;温度100 ℃;压力10.5 MPa;萃取时间5 min,重复萃取2次。萃取效率达到76.1%~101.3%。针对不同固体废物,应采用不同的净化方法,建议灰渣样品采取SPE法净化,污泥样品采用GPC法净化。选择优化后的萃取条件和净化条件,使用荧光检测器时,对灰渣和污泥中PAHs的方法检出限分别为1.03~1.96 μg/kg和4.71~7.04 μg/kg;相对标准偏差分别为4.0%~13.8%和3.3%~13%;加标回收率分别为73.2%~89.8%和67.7%~90.5%。该方法具有较低的检出限、良好的精密度和准确度,有一定的适用性。
[1] Perera F P,Rauh V,Whyatt R M,et al. Effect of prenatal exposure to airborne polycyclic aromatic hydrocarbons on neurodevelopment in the first 3 years of life among inner-city children [J]. Environmental Health Perspectives,2006,114(8):1 287.
[2] Joner E,Corgie S,Amellal N,et al. Nutritional constraints to degradation of polycyclic aromatic hydrocarbons in a simulated rhizosphere [J]. Soil Biology and Biochemistry,2002,34(6): 859-864.
[3] See S W,Karthikeyan S,Balasubramanian R. Health risk assessment of occupational exposure to particulate-phase polycyclic aromatic hydrocarbons associated with Chinese,Malay and Indian cooking [J]. Journal of Environmental Monitoring,2006,8(3): 369-376.
[4] 周文敏,傅德黔,孙宗光. 水中优先控制污染物黑名单 [J]. 中国环境监测,1990,6(4): 1-3.
[5] Wienecke J,Kruse H,Wassermann O. Organic compounds in the waste gasification and combustion process [J]. Chemosphere,1992,25(4): 437-447.
[6] Davies I W,Harrison R M,Perry R,et al. Municipal incinerator as source of polynuclear aromatic hydrocarbons in environment [J]. Environmental Science & Technology,1976,10(5): 451-453.
[7] 周德杰,刘锋,孙思修,等. 固体废物中多环芳烃类化合物 (PAHs) 的浸出特性研究 [J]. 环境科学研究,2005(增刊1): 31-35.
[8] HJ 478—2009 水质 多环芳烃的测定 液液萃取和固相萃取高效液相色谱法 [S].
[9] 张茜,刘潇威,罗铭,等. 快速溶剂 (ASE) 提取-凝胶渗透色谱 (GPC) 联合固相萃取 (SPE) 净化-高效液相色谱法测定土壤中的多环芳烃 [J]. 环境化学,2011,30(4): 771-777.
[10] 仲新华,周梦春. ASE 萃取——HPLC 法测定烟气中多环芳烃 [J]. 干旱环境监测,2010,24(004): 212-217.
[11] 王潇磊,王玲玲,李斐. 土壤中多环芳烃的 ASE 前处理方法研究 [J]. 环境科学导刊,2009,28(5): 1-2.
[12] 黄东勤,王盛才,陈一清,等. 加速溶剂萃取-高效液相色谱法测定土壤中16种多环芳烃 [J]. 中国环境监测,2008,24(3): 26-29.
[13] 牟世芬,刘克纳. 加速溶剂萃取技术及其在环境分析中的应用 [J]. 环境化学,1997,16(4): 387-391.
Determination of PAHs in Solid Waste Using ASE and HPLC
PENG Hua,CHEN Chun,WANG Nan,LI Hong-liang,WANG Wei-si,WANG Yuan-yuan,WANG Jing-jing
Henan Environmental Monitoring Centre,Zhengzhou 450004,China
The determination of PAHs in solid waste was studied in this paper.The results demonstrated the mothod with 100 ℃,1.05 MPa,1∶1 acetone: dichloromethane extract for 5 min. The cleanup procedures were examined using solid phase extraction (SPE) or gel permeation chromatography (GPC).The detection limits of PAHs in lime ash and sludge were 1.03-1.96 μg/kg and 4.71-7.04 μg/kg respectively;RSDare 4.0%-13.8% and 3.3%-13% respectively; Standard recovery rate were 73.2%-89.8%和67.7%-90.5%.
Accelerated solvent extraction;high performance liquid chromatography;solid waste;polycyclic aromatic hydrocarbons
2014-04-01;
2014-06-15
彭 华(1967-),女,河南信阳人,硕士,高级工程师。
X830.2
A
1002-6002(2015)04- 0111- 08
