OATPs家族在肿瘤中的表达及肿瘤治疗中的作用
2015-06-09温金华
温金华
(南昌大学第一附属医院药学部,江西 南昌 330006)
OATPs家族在肿瘤中的表达及肿瘤治疗中的作用
温金华
(南昌大学第一附属医院药学部,江西 南昌 330006)
药物转运体OATPs在一些肿瘤药物体内吸收、分布与排泄过程中有重要的作用,同时近年来较多的研究关注了OATPs在各类型肿瘤细胞及肿瘤组织中的表达,以及OATPs的表达对肿瘤的发生发展、治疗和诊断的影响,OATPs可能成为新的肿瘤治疗靶点。该文综述了OATPs家族在肿瘤中的表达及它们对肿瘤治疗的潜在作用和临床意义。
OATPs;肿瘤;表达;治疗;遗传多态性;药代动力学
药物转运体在药物体内吸收、分布与排泄过程及细胞膜转运过程中扮演了重要作用。在这些转运体中,有机阴离子转运体多肽家族(organic anion transporting polypeptides,OATPs)是摄入型转运体中的一大类,隶属于溶质转运体超家族(superfamily of solute carriers, SLC),对于内、外源性物质,尤其是药物的体内过程具有重要影响,其编码基因统称为SLCO 基因[1]。其家族成员包括 OATP1A2、OATP2A1、OATP3A1、OATP1B1、OATP1B3、OATP2B1、OATP1C1、OATP4A 、OATP4C、OATP5A1、OATP6A、OATP6B、OATP6C、OATP6D。OATPs家族可以在人体大部分正常组织中如小肠、肝、肾、脑等处均有表达,是组织细胞摄取内源性和外源性化学物质的关键因素[1-2]。同时,近来研究发现,OATPs在较多肿瘤细胞与肿瘤组织中亦有表达,并且呈上调或下调性表达。由于OATPs参与了肿瘤药物、一些肿瘤依赖性激素和肿瘤营养物质的转运,因此,这些摄取转运体可在肿瘤发生发展、诊断和治疗中扮演重要的角色[2]。该文章综述了OATPs家族在肿瘤组织中的表达情况,以及这些转运体在肿瘤发生发展和治疗中的重要作用。
1 OATPs家族在肿瘤组织中的表达
1.1 OATP1B1和OATP1B3在肿瘤中的表达OATP1B1和OATP1B3能特异性地表达于肝细胞基底膜上,但它们在肝癌细胞及组织中的表达却有所不同。研究显示,OATP1B1和OATP1B3的mRNA在Hep3B和HepG2肝癌细胞中的表达较低或检测不到[3],且与正常组织相比较,它们在肝癌组织中的表达减少[4]。Vavricka等[5]研究显示,OATP1B3在肝癌中的表达较周边正常组织减少了约60%,但OATP1B1在肝癌组织和正常肝组织中的表达却没有呈现显著性的差别。目前,OATP1B1和OATP1B3在肝癌组织中表达降低的机制尚不明确,这可能与肝癌细胞的分化有关。
除在肝癌中有表达,OATP1B1和OATP1B3在其它肿瘤细胞或组织中同样有表达。
研究显示,OATP1B1和OATP1B3的 mRNA在BXPC-3细胞与原发性胰腺癌细胞中均有较高的表达,并且在胰腺癌组织中呈高表达[6],它们可作为研究靶向抗胰腺癌药物的标记物。而在卵巢癌细胞和癌组织中,研究发现OATP1B1和OATP1B3亦均有表达,并且对肿瘤药物如紫杉醇呈现较高的摄取率[7]。因此,通过诱导OATP1B1和OATP1B3在卵巢癌细胞中高表达,有利于增强抗肿瘤药的治疗效果。
研究发现OATP1B1和OATP1B3 mRNA在恶性乳腺肿瘤中亦表达,但在良性乳腺肿瘤中并未表达[8]。此外,研究发现OATP1B1在结肠癌中亦有表达,并且表达高低与癌症的分化密切相关[9]。而OATP1B3在胃癌细胞、结肠癌细胞、膀胱癌细胞、前列腺癌细胞、肺癌细胞中均有表达[10-12]。
由于抗肿瘤药物如氨甲喋呤、多西他赛、伊立替康的代谢物SN-38和雷帕霉素均是OATP1B1和OATP1B3的底物[13],因此,OATP1B1和OATP1B3在肿瘤中的表达高低对肿瘤药物的治疗效果可产生较大的影响。
1.2 OATP1A2与OATP2A1在肿瘤中的表达OATP1A2可在正常组织如血脑屏障、肾脏和肠细胞及胆管上皮细胞中有较高的表达,而OATP2A1在人体较多正常组织有表达。同样,OATP1A2 与OATP2A1在肿瘤细胞和组织中的表达亦呈现多样性。研究显示,OATP1A2 在T47-D 和ZR-75-1 乳腺癌细胞中有较高的表达,而在MCF-7、MDA-MB-231和 MDA-MB-468 细胞中的表达却较低。与相毗邻的非癌症组织相比,OATP1A2在乳腺癌组织中有较高的表达,且在乳腺癌Ⅰ期和Ⅱ期时表达最高[14]。OATP1A2可能成为乳腺肿瘤发展的标记物。同时,通过对核受体PXR的激活可以增加乳腺癌中OATP1A2的表达而有可能增加抗肿瘤药物的摄取以增加疗效[14]。
同样,OATP2A1在乳腺肿瘤中均有表达,并且与良性乳腺癌细胞MCF-10A 相比,OATP2A1 mRNA水平在乳腺癌细胞MCF-7 和ZR-75-1中具有较高的表达,但在MDA-MB-231细胞中的表达却较低。与正常组织相比,OATP2A1 在乳腺肿瘤组织中的表达高出62%[15]。
OATP1A2在来自原发性肾癌的骨转移灶、恶性骨肉瘤细胞、结肠癌组织、胰腺癌组织、血瘤屏障中均有表达[2],并且由于OATP1A2在骨癌和胰腺癌中具有高表达,其功能的变化对其介导的抗肿瘤药物如氨甲喋呤和伊马替尼的治疗可能有影响。
OATP2A1在胃癌、肺癌、卵巢癌、肾脏肿瘤和结直肠肿瘤中有表达,但表达水平不高,并在一些直肠癌细胞中并没能检测到OATP2A1的表达[16],然而在胆管细胞癌与肝癌细胞中,OATP2A1的表达却高于正常细胞[17]。
1.3 OATP2B1在肿瘤中的表达OATP2B1在正常肝脏、血脑屏障、胎盘、肠道及心脏中有表达。相对于恶性乳腺癌,OATP2B1在良性乳腺肿瘤中的表达更高,并且OATP2B1在乳腺肿瘤中的表达随着肿瘤的发展而升高[18]。同时,OATP2B1在神经胶质瘤和结肠腺癌中均发现有表达[19],而在骨囊肿中OATP2B1 mRNA的表达比在骨肉瘤中的表达要高[20]。
尽管OATP2B1介导肿瘤药物的转运目前尚没有发现,但OATP2B1和类固醇激素具有高亲和力,并且类固醇激素可以调整正常组织中OATP2B1的表达[13]。因此,类固醇激素是否影响OATP2B1在肿瘤中的表达值得深入研究。
1.4 OATP3A1 和 OATP 4A1在肿瘤中的表达OATP3A1和 OATP4A1在体内大部分正常组织中均有表达,并且OATP3A1 和 OATP 4A1在较多肿瘤细胞如乳腺癌细胞、肺癌细胞、卵巢癌细胞、结肠腺癌细胞、骨肉瘤细胞及胰腺癌细胞均有表达[2]。在组织样本中还发现OATP3A1 mRNA在动脉瘤样骨囊肿的表达明显高于骨肉瘤中的表达[20]。除此以外,研究亦发现在患有结肠炎患者的结肠中OATP 4A1的表达明显高于正常结肠组织[21]。
1.5 其它OATPs成员在肿瘤中的表达OATPs其它成员在肿瘤中亦有表达,如OATP4C1在恶性肿瘤细胞MCF-7、MDA-MB-231、ZR-75-1呈现表达;OATP5A1在恶性乳腺癌标本中有表达,并在恶性乳腺癌细胞MCF-7和ZR-75-1中的表达明显低于非恶性的乳腺癌细胞MCF-10A;OATP6A1在食管癌组织、肺癌细胞和膀胱癌细胞中有表达[15,20,22];OATP1C1在骨肉瘤组织、肾癌组织及动脉瘤样骨囊肿中有表达[2]。OATPs家族成员在肿瘤组织和细胞中的表达见Tab 1所示。
2 OATPs在肿瘤治疗中的作用
2.1 OATPs在肿瘤药物和激素转运中的作用甲氨蝶呤、紫杉醇、多西他赛、伊马替尼、SN-38、伊立替康、雷帕霉素和一些激素等均证明是OATPs的底物[2]。OATPs功能改变可能影响这些化合物的体内转运而最终对它们的疗效产生潜在影响。
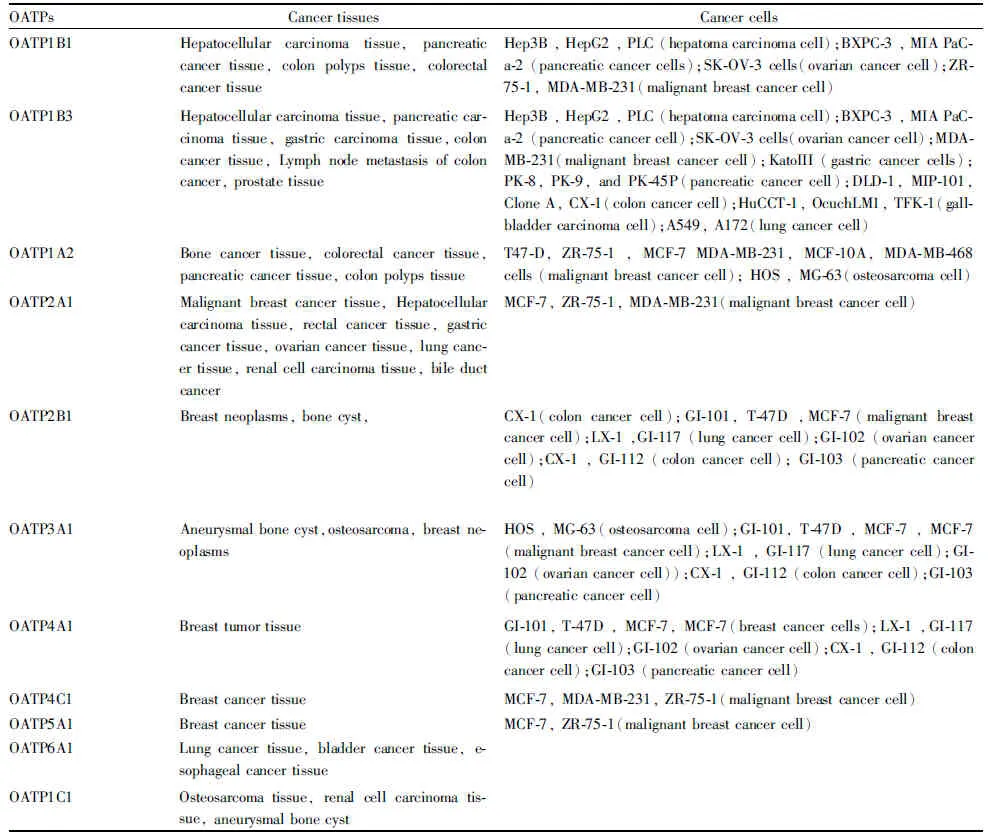
Tab 1 OATPs expression in cancer tissues and cancer cells
首先,肿瘤组织中OATPs的过表达可能会增加其对抗肿瘤药物的运输,从而可提高抗肿瘤药物的治疗效果。例如,在前列腺肿瘤中OATP1B1的过度表达,可增加酮康唑的运输而增加了前列腺癌对酮康唑治疗的敏感性[9]。同样,在前列腺癌和肺癌中,OATP1B3的高表达可增强多西他赛转运而增强其对肿瘤的治疗疗效[9]。OATP1B1基因表达的差异可能导致其对肝病治疗相关药物的药代动力学差异,如一项研究表明,静脉注射氨甲喋呤后,OATP1B1转基因小鼠肝脏中的氨甲喋呤的浓度是非转基因型小鼠的2倍[23]。
同时,目前研究发现,较多的激素及它们的轭合物被证明为OATPs的底物[2],而这些激素和轭合物在激素依赖性肿瘤的发生发展过程扮演了重要的角色。比如睾酮是导致前列腺癌、膀胱癌和睾丸癌发生和发展的重要原因,而雌酮和甲状腺激素分别在卵巢癌和甲状腺癌中起主要作用[9]。由于这些激素都是OATPs的底物并介导它们的转运,因此,OATPs对这些激素依赖性肿瘤的发生和发展可能会有影响。比如Nozawa等[24]研究发现OATP3A1和 OATP4A1参与了介导estrone-3-sulfate 进入T47-D乳腺癌细胞而增加了癌细胞的增殖。OATPs的表达可增加激素的转运而促进激素依赖性肿瘤的发展。
2.2 OATPs的表达对肿瘤的发生、发展的影响OATPs的表达和肿瘤的发生、发展亦有较大的关联,例如前列腺癌的复发和进展与OATPs相关。Pressler 等[9]研究发现OATP1B3的表达和前列腺癌的格里森评分密切相关,随着OATP1B3表达增加,前列腺癌评分增加至67倍。同时,亦有研究显示,OATP1A2亦与前列腺癌的发展相关。类固醇激素前体通过OATP1A2介导进入前列腺癌细胞内,转化为具有活性的雄激素前体药物脱氢表雄酮而进一步刺激前列腺癌的生长,因此,OATP1A2有望成为前列腺癌治疗的靶点[25]。
Muto 等[26]亦研究发现OATP1B3蛋白的表达与乳腺癌的各种病理参数包括肿瘤大小,复发和预后相关。虽然OATP1B1在肝癌中的表达降低,但其与肝癌的表达水平与分化相关;同样,OATP1B1的表达水平亦与结肠癌的分化密切相关。而OATP2B1和肝癌及甲状腺癌的分化密切相关[9]。
2.3 OATPs中的单核苷酸多态性(SNPs)对肿瘤药物的药代或疗效的改变OATPs具有遗传多态性,如OATP1B1常见的突变等位基因包括OATP1B1*1B、OATP1B1*5、OATP1B1*15;OATP1A2常见位点的突变包括R168C、E172D和 N278DEL;SLCO1B3 常见突变为334T>G和699G>A;OATP2B1常见突变为 935G>A[2,27]。随着研究的不断深入,更多的突变位点将被发现。这些位点的突变,对他们转运的不同药物可产生影响,导致药代动力学或药效学的改变。同样,OATPs基因突变亦可导致其对肿瘤药物转运的影响而导致药代动力学或药效学的个体差异。例如,与表达野生型OATP1B1*1A基因的细胞相比,表达OATP1B1*15的细胞可明显减少伊立替康的代谢物SN-38的摄取,意味具有这种基因多态性的患者可能会导致SN-38药代动力学的改变[28],而体内研究亦证实OATP1B1*15多态性患者表现出较高的SN-38血药浓度及较低的清除率[29]。OATP1A2的多态性也可能导致氨甲喋呤和伊马替尼的药代动力学的改变:如研究显示OATP1A2 I13T突变的患者,对甲氨喋呤的肠道的摄取增加,而R168C、E172D和 N278DEL 位点突变则降低其对甲氨喋呤的摄取[30];同时研究还发现伊马替尼在慢性粒细胞白血病患者中的清除率亦和OATP1A2基因突变有关[30]。目前,随着遗传药理学的发展,国内外学者对个体化用药的呼声越来越高, 基于OATPs的遗传多态性介导肿瘤药物的药代动力学及药效学影响及个体化给药必将引起更多学者的关注。
3 结语
OATPs在较多类型的肿瘤中具有表达,并且OATPs的表达可能成为肿瘤诊断和治疗的新靶点:一方面OATPs的过表达或基因多态性可改变其对肿瘤营养、激素、组织因子和药物在靶器官的摄取,从而影响肿瘤的发生发展和治疗;另一方面,OATPs表达水平与肿瘤的分期密切相关,OATPs的过表达可成为肿瘤发生发展的标记物,有利于对肿瘤的诊断和治疗。因此,OATPs在肿瘤的治疗和诊断或预后中有较大的发展价值和重要的临床意义。
[1] 张 伟, 贺毅憬, 周宏灏. 有机阴离子转运多肽1B1 的遗传药理学进展[J]. 中国临床药理学与治疗学,2008, 13(7):721-9.
[1] Zhang W, He Y J,Zhou H H. Progress and research in pharmacogenetics of OATP1B1[J].ChinJClinPharmacolTher, 2008, 13(7):721-9.
[2] Obaidat A,Roth M,Hagenbuch B. The expression and function of organic anion transporting polypeptides in normal tissues and in cancer[J].AnnRevPharmacolToxicol, 2012,52: 135-51
[3] Libra A, Fernetti C, Lorusso V, et al. Molecular determinants in the transport of a bile acid-derived diagnostic agent in tumoral and nontumoral cell lines of human liver[J].JPharmacolExpTher, 2006,319:809-17.
[4] Tsuboyama T, Onishi H, Kim T, et al. Hepatocellular carcinoma: hepatocytes elective enhacement at gadoxetic acid-enhanced MR imaging-correlation with expression of sinusoidal and canalicular transporters and bile accumulation[J].Radiology, 2010,255:824-33.
[5] Vavricka S R, Jung D, Fried M, et al. The human organic anion transporting polypeptide 8 (SLCO1B3) gene is transcriptionally repressed by hepatocyte nuclear factor 3β in hepatocellular carcinoma[J].JHepatol, 2004, 40:212-8.
[6] Valentinos K, Elli I, Martin S, et al. Expression of organic anion-transporting polypeptides 1B3, 1B1, and 1A2 in human pancreatic cancer reveals a new class of potential therapeutic targets[J].OncoTargetsTher, 2011,4:27-32.
[7] Svoboda M, Wlcek K, Taferner B, et al. Expression of organic anion-transporting polypeptides 1B1 and 1B3 in ovarian cancer cells: Relevance for paclitaxel transport[J].BiomedPharmacother, 2011,65(6):417-26.
[8] Katrin W, Martin S, Theresia T, et al. Altered expression of organic anion transporter polypeptide (OATP) genes in human breast carcinoma[J].CancerBiolTher, 2008; 7: 1450-5.
[9] Pressler H, Sissung T M, Venzon D, et al. Expression of OATP Family Members in Hormone-Related Cancers[J].PotenMarkProgress.PLoSOne, 2011,6(5): e20372.
[10] Abe T, Unno M, Onogawa T, et al. LST-2, a human liver-specific organic anion transporter, determines methotrexate sensitivity in gastrointestinal cancers[J].Gastroenterology, 2001, 120:1689-99.
[11] Monks N R, Liu S, Xu Y, et al. Potent cytotoxicity of the phosphataseinhibitor microcystin LR and microcystin analogues in OATP1B1-and OATP1B3-expressing HeLa cells[J].MolCancerTher, 2007, 6:587-98.
[12] Wright J L, Kwon E M, Ostrander E A, et al. Expression of SLCO transport genes in castration-resistant prostate cancer and impact of genetic variation in SCLO1B3 and SLCO2B1 on prostate cancer outcomes[J].CancerEpidemiolBiomarkPrev, 2011, 4:619-27.
[13] Veronika B A, Lena S, Katrin W, et al. Tumor-specific expression of organic anion-transporting polypeptides: transporters as novel targets for cancer therapy[J].JDrugDelivery, 2013, 2013: 863539.
[14] Meyer Z U,Schwabedissen H E,Tirona R G,et al. Interplay between the nuclear receptor pregnane X receptor and the uptake transporter organic anion transporter polypeptide 1A2 selectively enhances estrogen effects in breast cancer[J].CancerRes, 2008, 68:9338-47.
[15] Katrin W, Martin S, Theresia T, et al. Altered expression of organic anion transporter polypeptide (OATP) genes in human breast carcinoma[J].CancerBiolTher, 2008, 7: 1450-5.
[16] Holla V R, Backlund M G, Yang P, et al. Regulation of prostaglandin trans-porters in colorectal neoplasia[J].CancerPrevRes, 2008, 1:93-9.
[17] Wlcek K, Svoboda M, Riha J, et al. The analysis of organic anion trans-porting polypeptide (OATP) mRNA and protein patterns in primary and metastatic liver cancer[J].CancerBiolTher, 2011, 11(9):801-11.
[18] Al Sarakbi W, Mokbel R, Salhab M, et al. The role of STS and OATP-B mRNA expression in predicting the clinical outcome in human breast cancer[J].AnticancerRes, 2006, 26:4985-90.
[19] Tamai I, Nezu J, Uchino H, et al. Molecular identification and characterization ofnovel members of the human organic anion transporter (OATP) family[J].BiochemBiophysResCommun, 2000, 273:251-60.
[20] Liedauer R, Svoboda M, Wlcek K, et al. Different expression patterns of organic anion transporting polypeptides in osteosarcomas, bone metastases and aneurysmal bone cysts[J].OncolRep, 2009, 22:1485-92.
[21] Wojtal K A, Eloranta J J, Hruz P, et al. Changes in mRNA expression levels of solute carrier transporters in inmammatory bowel disease patients[J].DrugMetabDispos, 2009,37(9): 1871-7.
[22] Kindla J, Rau T T, Jung R, et al. Expression and localization of the uptake transporters OATP2B1, OATP3A1 and OATP5A1 in non-malignant and malignant breast tissue[J].CancerBiolTher,2011, 11(6):584-91.
[23] van de Steeg E, van der Kruijssen C M,Wagenaar E, et al. Methotrexate pharmacokinetics in transgenic mice with liver-specific expression of human organic anion-transporting polypeptide 1B1 (SLCO1B1) [J].DrugMetabDispos, 2009,37(2): 277-81.
[24] Nozawa T, Suzuki M, Yabuuchi H, et al. Suppression of cell proliferation by inhibition of estrone-3-sulfate transporter in estrogen-dependent breast cancer cells[J].PharmRes, 2005, 22:1634-41.
[25] Arakawa H, Nakanishi T, Yanagihara C, et al. Enhanced expression of organic anion transportingpolypeptides (OATPs) in androgen receptor-positive prostate cancer cells:Possible role of OATP1A2 in adaptive cell growth under androgendepletedconditions[J].BiochemPharmacol, 2012, 4(8): 1070-7.
[26] Muto M, Onogawa T, Suzuki T,et al. Human liver-specific organic anion transporter-2 is a potent prognostic factor for human breast carcinoma[J].CancerSci,2007, 98:1570-6.
[27] Christina F, Martin F F, Jorg K. Hepatic OATP and OCT uptake transporters: their role for drug-drug interactions and pharmacogenetic aspects[J].DrugMetabolRev, 2010, 42(3):380-401
[28] Xiang X, Jada S R, Li H H,et al. Pharmacogenetics of SLCO1B1 gene and the impact of *1b and *15 haplotypes on irinotecan disposition in Asian cancer patients[J].PharmacogenetGenomics, 2006, 16(9):683-91.
[29] Badagnani I, Castro R A, Taylor T R, et al. Interaction of methotrexate with organic-anion transporting polypeptide 1A2 and its genetic variants[J].JPharmacolExpTher, 2006,318:521-9.
[30] Yamakawa Y, Hamada A, Shuto T, et al. Pharmacokinetic impact of SLCO1A2 polymorphisms on imatinib disposition in patients with chronic myeloid leukemia[J].ClinPharmacolTher, 2011, 90(1):157-63.
OATPs family:Expression in tumors and role in tumor treatment
WEN Jin-hua
(DeptofPharmacy,theFirstAffiliatedHospitalofNanchangUniversity,Nanchang33006,China)
OATPs, the drug transporter, play an important role in absorption, distribution and excretion of some cancer drugs. More recent studies have focused on OATPs expressed in various types of tumor cells and tumor tissues, as well as the effect of OATPs expression on the development,treatment and diagnosis of tumors. OATPs may become a new tumor therapeutic target. This paper reviews the expression of OATPs in tumors and their potential role and clinical significance in tumor treatment.
OATPs; tumors; expression; treatment; genetic polymorphism; pharmacokinetics
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.006.html
2014-11-24,
2014-12-29
国家自然科学基金资助项目(No 81202583)
温金华(1981-),男,博士,副主任药师,研究方向:临床药学,通讯作者,E-mail:wenjh866@163.com
10.3969/j.issn.1001-1978.2015.03.006
A
1001-1978(2015)03-0319-04
R-05;R341.6;R394.2;R730.22;R730.5;R977.6