新型PDE4抑制剂Roflupram改善阿尔茨海默病大鼠的认知障碍及神经炎症
2015-06-09王灿茂程玉芳吴金刚甘丹娜蒋毅萍徐江平
王灿茂,程玉芳,吴金刚,甘丹娜,蒋毅萍,徐江平
(南方医科大学药学院药理学系,广州 广东 510515)
新型PDE4抑制剂Roflupram改善阿尔茨海默病大鼠的认知障碍及神经炎症
王灿茂,程玉芳,吴金刚,甘丹娜,蒋毅萍,徐江平
(南方医科大学药学院药理学系,广州 广东 510515)
目的 验证新型PDE4抑制剂罗氟普兰(roflupram)能否改善Aβ25-35诱导的阿尔茨海默病大鼠的学习记忆障碍,及可能的机制是否与缓解小胶质细胞激活引起的炎症相关。方法 SD大鼠双侧海马CA1区微量注射Aβ25-35(10 μg)造模。动物分组包括:假手术对照组、Aβ25-35注射组、Aβ25-35注射+盐酸多奈哌齐组、Aβ25-35注射+Rolipram组 、Aβ25-35注射+Roflupram低、中、高剂量。连续灌胃给药14 d后,进行Morris水迷宫实验,20 d后进行避暗实验。采用Western blot法检测海马cAMP下游信号分子(p-PKA、p-CREB),前致炎因子(iNOS、COX-2、 TNF-α、IL-1β),胶质细胞激活标记物(GFAP、Iba-1),炎症相关蛋白(p-p38、核内NF-κB p65)的蛋白水平变化,并用PCR的方法分析海马内iNOS、COX-2、TNF-α和IL-1βmRNA水平的变化。结果 行为学结果显示,Roflupram能明显改善由Aβ25-35造成大鼠的空间学习记忆能力和被动回避学习记忆能力障碍。分子生物学分析的结果如下:与Aβ25-35注射组比较,各药物处理后均可以使海马内p-CREB、p-PKA蛋白表达水平不同程度的升高,使NF-κB p65(核内)、p-p38、iNOS、 COX-2、TNF-α、IL-1β、GFAP和Iba-1的蛋白水平不同程度的降低,iNOS、COX-2、TNF-α和IL-1β mRNA水平下降。结论 Roflupram能够改善Aβ25-35诱导痴呆大鼠的学习记忆功能障碍,该效应与抑制小胶质细胞的活化、减少炎性因子的表达,从而缓解神经炎症有关。
Roflupram;阿尔茨海默病;PDE4抑制剂;神经炎症;β- 淀粉样蛋白;认知;小胶质细胞
阿尔茨海默病(Alzheimer’s disease, AD)是一种以渐进性记忆减退、认知障碍及人格改变为主要临床特征的中枢神经系统退行性变性疾病。脑内老年斑(senile plaques, SPs)形成、含有tau蛋白的神经纤维缠结(neurofibrillary tangles, NTFs)以及神经元缺失变性是其三大病理学特征[1]。AD的病因复杂,人们提出了诸多假说,如淀粉级联学说、tau蛋白异常修饰学说、胆碱能神经异常学说等[2],但没有一种机制能完全解释。近些年来神经炎症学说与AD的关系越来越引起学者的关注, 随着对AD炎症机制的重视,有人提出脑内的慢性炎症反应可能是其另一重要的病理特征[3],AD发病的炎症机制越来越被大家所重视。
磷酸二酯酶 4 (phosphodiesterase 4, PDE4)对于调节细胞内cAMP的浓度有重要作用。PDE4抑制剂在体内、体外实验中均有明确的抗炎作用,如罗氟司特(roflumilast)已经在哮喘、慢性阻塞性肺疾病等气道炎症性疾病中广泛使用。此外也有大量的研究表明PDE4抑制剂具有抗抑郁和改善认知的作用[4],例如经典的PDE4抑制剂咯利普兰(rolipram),可以改善不同AD模型实验动物的学习记忆,并且与其抗神经炎症的作用有关[5]。PDE4抑制剂常伴有的致呕吐不良反应限制了其在中枢神经系统疾病中的应用,roflupram是人工合成的新型PDE4抑制剂,化学结构不同于rolipram,通过比格犬灌胃给药的方式验证了其不具有致恶心、呕吐等不良反应,并且对氢溴酸东莨菪碱所致的大鼠学习记忆获得性障碍具有很好的改善效应(数据未显示)。本研究通过大鼠海马内注射Aβ25-35致AD模型的方法,进一步研究roflupram在抗神经炎症方面对大鼠学习记忆障碍的影响。
1 仪器、试剂与材料
1.1 仪器单臂脑立体定位仪(深圳瑞沃德生命科技有限公司) ;TECAN GENios Pro多功能酶标仪(瑞士 Tecan 公司);Biometra T-gradient 梯度PCR仪(德国 Biometra 公司);Bio-Rad WB 系统(美国 Bio-Rad 公司);UVP凝胶成像系统(美国 Spring Scientific 公司);注射泵(瑞典 CMA 公司)。
1.2 试剂Aβ25-35(Sigma-Aldrich),凝聚态Aβ25-35的制备:Aβ25-35用无菌生理盐水配制成浓度为5 g·L-1的溶液,置于37 ℃孵箱中老化7 d,使其变为凝聚态的Aβ25-35。roflupram(由北卡罗来纳州立大学柯衡明教授设计合成并赠送);rolipram(Sigma-Aldrich);盐酸多奈哌齐片(中国卫材药业);核蛋白提取试剂盒(上海生工生物工程有限公司);兔GAPDH单抗、兔iNOS单抗、兔COX-2单抗、兔CREB单抗、兔p-CREB单抗、兔PKA单抗、兔p-PKA单抗、兔NF-κB p65单抗、兔Histone H3单抗、兔p38单抗、兔p-p38单抗、兔IL-1β单抗和兔TNF-α单抗(均购于美国Cell Signaling Technology 公司);羊抗兔HRP-IgG,ECL发光液,TRIzol(均购于美国 Invitrogen 公司);Real Time RT-PCR逆转录试剂盒(大连宝生物工程有限公司);2×Taq PCR Mastermix(北京天根生化科技有限公司)。
1.3 实验动物♂SD大鼠、SPF级、3 月龄、70 只、体质量200~250 g,饲养环境SPF级,由南方医科大学医学实验动物中心提供、动物质量合格证号:SCXK(粤)2011-0015。
2 方法
2.1 动物分组及造模方法参考文献[6],取健康成年大鼠(200~250 g)70 只,随机分为7 组,每组10 只。分为假手术对照组,Aβ25-35注射组,Aβ25-35注射+盐酸多奈哌齐组(1.0 mg·kg-1·d-1), Aβ25-35注射+Rolipram组(0.5 mg·kg-1·d-1), Aβ25-35注射+Roflupram低(0.25 mg·kg-1·d-1)、中(0.5 mg·kg-1·d-1)、高(1.0 mg·kg-1·d-1)剂量组。大鼠腹腔注射水合氯醛(0.3 g·kg-1)麻醉后固定于脑立体定位仪上, 头顶部去毛、消毒, 分离骨膜使颅骨暴露。于双侧海马CA1区(坐标:AP-3.5 mm,ML ± 2.0 mm,DV-3.0 mm)注射Aβ25-35(2 μL),注射速度0.5 μL·min-1,注射完留针5 min使溶液充分弥散。假手术对照组注射生理盐水2 μL,各组动物手术后消毒并缝合切口皮肤。各组大鼠于注射24 h后开始灌胃给药,每天1次,连续给药23 d。假手术对照组和Aβ25-35注射组每天灌服等容积的生理盐水。
2.2 行为学检测
2.2.1 水迷宫实验 采用Morris水迷宫实验测试大鼠空间学习记忆能力,实验方法参考文献[6],并进行适当修改。实验周期为7 d,d 1将大鼠放入水迷宫(未放平台)自由游泳以适应环境3 min,d 2~d 6进行定位航行实验(平台为不可见,置于水面下1.5 cm),记录大鼠到达平台所需时间(逃避潜伏期)。d 7撤去平台进行空间探索实验,记录大鼠在90 s内于平台所在象限(目标象限)内探索时间。
2.2.2 避暗实验 水迷宫实验结束24 h后进行避暗实验,用以测试大鼠的被动回避学习记忆能力。避暗箱(50 cm×16 cm×10 cm)分为明箱和暗箱两部分, 之间有孔相通。暗箱底部铺有可通电的铜栅, 电流0.5 mA。实验由4部分组成,对仪器环境的适应阶段、电击训练阶段、3 h后的短时记忆测试以及24 h的长时记忆测试。实验分3 d完成,d 1将大鼠头朝外放入避暗箱明箱,让其自由活动4 min。d 2将动物重新放置进明箱内,让其在明箱内活动60 s后将两室间的门打开,待动物进入暗箱后将明暗箱间的门关闭,并给予0.5 mA的电击,时间为3 s,使之巩固刺激性记忆。电击后3 h进行第1次测试,记录动物从放入明室到首次进入暗室的时间,即为3 h潜伏期,或3 h保留时间(3 h-retention),若动物在300 s内未能进入暗室,则保留时间记录为300 s。24 h后对其保留时间再次进行测试,实验方法与保留时间的记录方法同上。
2.3 免疫印迹法测定目标蛋白表达避暗实验结束后次日给药后30 min,处死动物并断头取脑,分离双侧全海马组织,用预冷的PBS 洗净余血(除用于本部分实验外,其他剩余组织存放于液氮中保存),然后置于预冷的玻璃匀浆器中,并加入适量RIPA裂解液(含1%的蛋白酶抑制剂和磷酸酶抑制剂),冰上匀浆,4 ℃静置裂解30 min后,14 000r·min-1离心15 min,取上清后用BCA法进行总蛋白定量。将上清与上样缓冲液混合(核蛋白提取按试剂盒说明书中的步骤进行),混合液煮沸变性10 min后备用。取40 μg总蛋白进行SDS-PAGE实验,再转移至PVDF 膜上,5% 脱脂奶粉室温封闭2 h,分别加入抗PKA、p-PKA、CREB、p-CREB、NF-κB p65、p-p38、p38、COX-2、iNOS、IL-1β、TNF-α、GFAP、Iba-1、GAPDH和Histone H3一抗; 4 ℃孵育12 h后加入对应的二抗室温孵育2 h,TBST洗膜,ECL显色,置于暗室曝光显影。将胶片扫描后用Image J 1.42软件进行条带灰度值扫描。
2.4 RT-PCR检测目标基因mRNA水平从液氮中取出的海马组织,按TRIzol试剂说明书提取总RNA。cDNA的合成按RT-PCR逆转录试剂盒操作进行。PCR扩增混合体系混匀后置PCR 仪上扩增,扩增条件:94 ℃变性5 min,随后94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,20~35 个循环,最后72 ℃延伸5 min 终止。以GAPDH为内参, 引物序列详见Tab 1。1.5%琼脂糖电泳,凝胶成像仪下观察拍照。图像用Image J 1.42软件进行条带灰度值扫描。
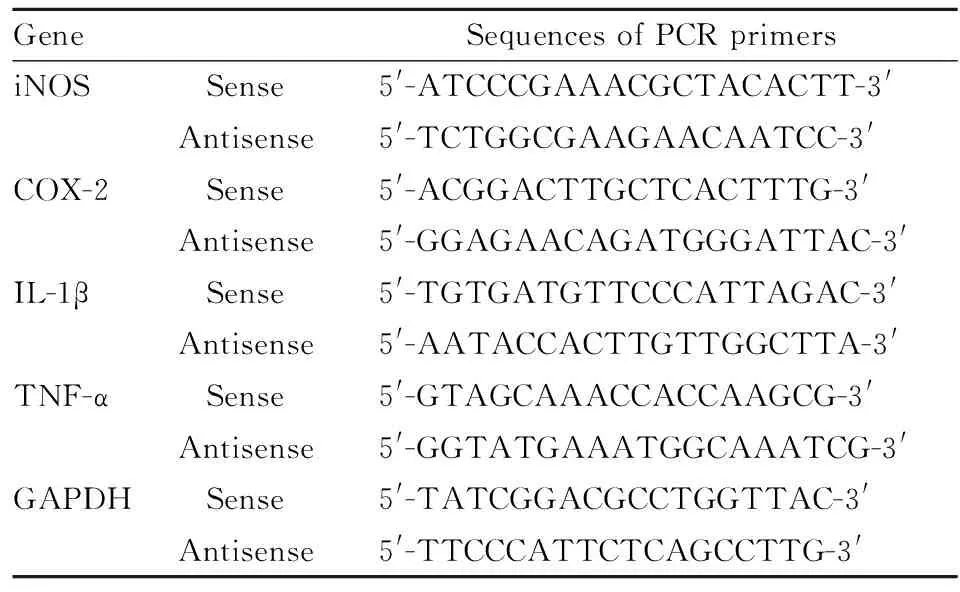
Tab 1 Sequences of PCR primers
3 结果
3.1 行为学检测结果
3.1.1 水迷宫实验 水迷宫定位航行实验潜伏期结果见Fig 1A,与假手术对照组比较,Aβ25-35注射组的逃避潜伏期显著延长,差异具有统计学意义(P<0.01)。与Aβ25-35注射组相比较,多奈哌齐、rolipram和roflupram高剂量均能明显缩短逃避潜伏期,差异具有统计学意义(P<0.05)。
空间探索实验显示(Fig 1B),与假手术组相比,Aβ25-35注射组大鼠在目标象限中探索时间明显短于假手术对照组,差异有统计学意义(P<0.01);而给予rolipram、多奈哌齐和roflupram高剂量后能明显延长大鼠在目标象限中的探索时间 (P<0.05,P<0.01);这说明Aβ25-35能损害大鼠空间记忆功能,而roflupram能改善Aβ25-35造成的空间学习记忆障碍。
3.1.2 避暗实验 电击后3 h,各组大鼠间潜伏期没有显著差异(结果未显示),表明各组间短时记忆没有差异。电击后24 h对各组大鼠长时记忆检测,结果见Fig 2,Aβ25-35注射组动物与假手术对照组相比, 潜伏期明显缩短,差异具有统计学意义(P<0.01);rolipram组、盐酸多奈哌齐组、roflupram中和高剂量组较Aβ25-35注射组的潜伏期明显延长(P<0.05,P<0.01),这说明roflupram能改善避暗实验中由Aβ25-35造成的长时记忆障碍。

Fig 1 Effects of Roflupram on Aβ25-35-induced spatial cognitive
A: Mean daily escape latency in place navigation test; B: Probe trial test performed 24 h after the last place navigation test. Don: Donepezil hydrochloride; Rol: Rolipram; Rof: Roflupram.**P<0.01vsVeh+Veh group;#P<0.05,##P<0.01vsAβ + Veh group.
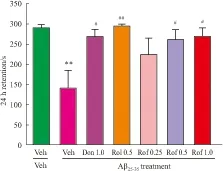
Fig 2 Effects of Roflupram on performance in presence of Aβ25-35in step-through passive avoidance test in ±s, n=10)
Don: Donepezil hydrochloride; Rol: Rolipram; Rof: Roflupram.**P<0.01vsVeh + Veh group;#P<0.05,##P<0.01vsAβ + Veh group.
3.2 Roflupram对Aβ25-35引起大鼠海马p-PKA、p-CREB、NF-κB p65(核内)和 p-p38蛋白表达的影响如Fig 3A所示,PKA和CREB总蛋白的表达各组间无差异。与对照组相比,Aβ25-35注射组海马内p-PKA和p-CREB水平明显下降(P<0.01);给予rolipram、盐酸多奈哌齐、roflupram中剂量和高剂量处理之后可明显对抗Aβ25-35引起的p-PKA和p-CREB蛋白表达水平下降(P<0.05,P<0.01)。
如Fig 3B所示,海马内给予Aβ25-35后,可使NF-κB p65(核内)和p-p38的蛋白水平明显升高(P<0.01),而总的p38蛋白表达各组间无明显变化,给予rolipram、盐酸多奈哌齐、roflupram中剂量和高剂量之后可明显逆转Aβ25-35引起的NF-κB p65(核内)和p-p38水平上升。
3.3 roflupram对Aβ25-35引起大鼠海马iNOS、COX-2、TNF-α和IL-1β mRNA水平和蛋白表达的影响RT-PCR检测如Fig 4A所示,Aβ25-35注射组海马内iNOS、COX-2、TNF-α和IL-1β的mRNA水平较假手术对照组明显升高,差异具有统计学意义(P<0.01)。而各个给药处理组则能不同程度地降低这些基因的mRNA转录水平。
蛋白表达检测结果如Fig 4B所示,假手术对照组大鼠海马内iNOS、COX-2、TNF-α和IL-1β蛋白含量表达量较少,Aβ25-35注射组给予海马内注射Aβ25-35后蛋白表达明显升高,而各个药物处理组则能不同程度地降低这些蛋白的表达水平。
3.4 roflupram对Aβ25-35引起大鼠海马Iba-1和GFAP蛋白表达的影响如Fig 5所示,海马内给予Aβ25-35后,与假手术对照组相比,可使小胶质细胞特异性标识蛋白Iba-1表达明显升高(P<0.01)。给予rolipram、多奈哌齐和roflupram高剂量后能明显抑制Iba-1的蛋白表达(P<0.05,P<0.01);与假手术对照组相比,Aβ25-35注射组星形胶质细胞特异性标识蛋白GFAP表达明显升高(P<0.05),给予rolipram和roflupram高剂量后能明显抑制GFAP的蛋白表达(P<0.05)。
4 讨论
脑内老年斑形成是AD主要的病理学特征,而β-淀粉样蛋白是老年斑的主要成分,已有研究证明,大鼠海马内注射Aβ25-35可以导致学习记忆和认知功能下降[7],是一种广泛用于研究AD的动物模型。本研究应用此模型来观察新型PDE4抑制剂roflupram对Aβ25-35引起大鼠认知功能障碍及神经炎症的影响。

Fig 3 Effect of roflupram on protein expression of p-PKA,p-CREB,NF-κB p65(nuclear) and
A: Protein expression of p-CREB and p-PKA in the hippocampus in rats; B: Expression of NF-κB p65(nuclear) and p-p38 in the hippocampus in rats. Upper panel is representative immunoblots of p-PKA, PKA, p-CREB, CREB, NF-κB p65(nuclear), p-p38, p38, Histone 3(nuclear loading controls) and GAPDH (control),lower panels are respective quantifications. The bands in the respective panels are: 1: Veh + Veh; 2: Aβ + Veh; 3: Aβ + Don 1.0 mg·kg-1; 4: Aβ+Rol 0.5 mg·kg-1; 5: Aβ + Rof 0.25 mg·kg-1; 6: Aβ + Rof 0.5 mg·kg-1; 7: Aβ + Rof 1.0 mg·kg-1.**P<0.01vsVeh+Veh group;#P<0.05,##P<0.01vsAβ+Veh group.
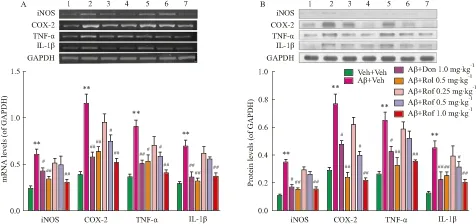
Fig 4 Effect of roflupram on mRNA level and protein expression of iNOS,COX-2,TNF-α and
A: mRNA level of iNOS, COX-2, TNF-α and IL-1β in the hippocampus in rats; B: Protein expression of iNOS, COX-2, TNF-α and IL-1β in the hippocampus in rats. Upper panel is representative immunoblots of iNOS, COX-2, TNF-α, IL-1β and GAPDH (control),lower panels are respective quantifications. See Fig 3 for treatments.**P<0.01vsVeh+Veh group;#P<0.05,##P<0.01vsAβ + Veh group.

Upper panel is representative immunoblots of Iba-1, GFAP and GAPDH (control), lower panels are respective quantifications. See Fig 3 for treatments.*P<0.05,**P<0.01vsVeh+Veh group;#P<0.05,##P<0.01vsAβ+Veh group.
通过Morris水迷宫和避暗实验测试发现,Aβ25-35海马CA1区注射后大鼠在避暗实验中的24 h的潜伏期明显减短;在水迷宫实验中大鼠的逃避潜伏期明显延长,在目标象限的游泳时间明显减少;这都说明Aβ25-35微注射到海马CA1区可以导致大鼠明显的记忆和认知功能的障碍。而给予roflupram可明显改善模型大鼠的学习记忆与认知功能,说明roflupram可以对抗Aβ25-35引起的认知功能障碍。
分子机制研究发现,Aβ25-35海马CA1区注射后,海马的p-PKA和p-CREB蛋白水平下降;小胶质细胞的特异性标识蛋白Iba-1和星形胶质细胞的特异性标识蛋白GFAP明显升高;磷酸化p-38MAPK和细胞核内的NF-κB p65蛋白水平明显升高;相应的其下游的COX-2、iNOS、TNF-α和IL-1β的蛋白水平也明显升高;这些都表明Aβ25-35微注射后海马出现了严重的炎症反应。而roflupram(1 mg·kg-1)连续给药23 d后能逆转由Aβ25-35引起这些蛋白因子的变化,表明roflupram具有很强的缓解由Aβ25-35引起的神经炎症的能力。
近年来的临床和临床前研究表明,脑内的神经炎症在AD的发生和发展过程中起着关键的作用,神经炎症的主要特征是胶质细胞过度激活及神经毒性因子释放的增多。小胶质细胞是脑内主要的免疫细胞,能通过Toll样受体(TLR)2/4/6和其辅助受体与Aβ相互作用[8]。Aβ可以通过作用于小胶质细胞上的Toll样受体,引起活性氧簇(reactive oxygen species,ROS)的增高,导致脑内的氧化应激状态,并激活下游的NF-κB p65和p38MAPK信号通路,进而引起炎症反应的发生,使疾病恶化并加速进程最终导致痴呆[9]。NF-κB是一类具有多向性转录调节作用的蛋白质因子家族,未激活的NF-κB位于胞质内, 一旦被激活迅速转入细胞核,调节包括TNF-α、IL-1β、iNOS和COX-2在内的靶基因的表达,从而在炎症反应过程中起着重要作用[10]。另外p38MAPK在炎症和应激反应中也具有重要的作用,可调控TNF-α、IL-β、IL-6、IL-8等与凋亡及炎症有关的基因表达[11]。因此,抑制NF-κB p65和p38的信号通路在抑制小胶质细胞的活化和神经炎症中起着关键作用。
CREB是介导细胞增殖分化和炎症免疫等作用的关键性转录因子。有研究表明在LPS诱导的巨噬细胞炎症模型中,rolipram抑制胞内cAMP的水解,cAMP水平的升高可通过cAMP/PKA/CREB的途径诱导MAPK磷酸酶-1(MAPK phosphatase-1,MKP-1)的表达增加,从而减少p38 MAPK激活及由p38MAPK激活引起的炎症因子的表达[12]。此外,有研究还证明,提高内皮细胞内cAMP浓度可抑制p38MAPK的活化,并进一步抑制NF-κB p65/p65亚基的磷酸化,以及结合后的NF-κB p65的转录活性[13],因此NF-κB p65还是受p38MAPK调控的下游信号。本研究通过WB检测发现Aβ25-35海马内注射可以导致p-PKA和p-CREB蛋白水平明显降低,这与之前关于Aβ海马内或者脑室微注射可以导致p-CREB水平降低的研究相一致[14]。而roflupram处理之后可以逆转由Aβ25-35导致的p-PKA和p-CREB水平的降低,由于roflupram还能抑制由Aβ25-35导致的p38MAPK和NF-κB p65的过度激活及下游的炎症相关蛋白和炎症因子的表达,因此可以推测,roflupram缓解Aβ25-35导致的神经炎症可能是通过cAMP/PKA/CREB进而影响p38MAPK和NF-κB p65的信号通路起作用的。
实验中还设置两个作为对照的药物处理:多奈哌齐和rolipram。多奈哌齐是第2代胆碱酯酶(AchE)抑制剂,其治疗作用是可逆性地抑制乙酰胆碱酯酶 (AchE),引起的乙酰胆碱水解而增加受体部位的乙酰胆碱含量,近年来又有文献报道表明多奈哌齐还有明显地抗神经炎症的作用,例如多奈哌齐可以对抗Aβ低聚物海马内注射引起的神经炎症,其作用机制是通过抑制p38MAPK和NF-κB p65的激活,从而抑制小胶质细胞和星形胶质细胞活化引起的炎症反应[15],我们的实验结果也与这些报道相一致。之前还有研究表明给予大鼠或小鼠多奈哌齐处理之后可以升高海马p-CREB的蛋白水平[16-17],而我们的研究也证实了这一点,但是至于多奈哌齐升高p-CREB的蛋白水平是通过何种作用机制的还未有报道,并且这是否与其具有抗炎作用的机制相关?根据我们的研究结果以及前面的分析,多奈哌齐的抗炎作用很有可能是通过,或者至少是部分通过p-CREB介导的。rolipram为经典的第1代PDE4抑制剂,已经有大量的研究证明具有良好的改善认知功能障碍的作用,并且也具有很好的抗炎作用,但由于有导致呕吐的不良反应限制了它在临床上的应用。尽管现有的大量研究表明PDE4抑制剂具有治疗神经炎症相关的中枢神经系统疾病如AD、帕金森综合征等的作用,但是多年的努力却始终不能摆脱PDE4抑制剂伴随的致呕吐副作用。roflupram是基于rolipram进行结构改造,成功合成并筛选出的一个新型PDE4高选择性抑制剂,本实验室前期采用比格犬的研究发现具有极低甚至可能不具有致呕吐的潜能,本研究又发现roflupram能对抗Aβ25-35诱导痴呆大鼠的学习记忆功能障碍,并且该作用与其抗神经炎症密切相关,因此roflupram具有开发成为有临床应用价值治疗阿尔茨海默病药物的潜力。
[1] 韦 云,刘剑刚,李 浩,唐旭东.γ-分泌酶、淀粉样前体蛋白和早老蛋白1在阿尔采末病中相关性的研究进展[J].中国药理学通报, 2014,30(02):167-9.
[1] Wei Y, Liu J G, Li H, Tang X D. Research progress on interactions among γ-secretase,amyloid precursor protein and presenilin-1 in Alzheimer’s disease[J].ChinPharmacolBull, 2014,30(02):167-9.
[2] Finch C E, Cohen D M. Aging, metabolism, and Alzheimer’s disease: review and hypotheses[J].ExpNeurol, 1997, 143(1): 82-102.
[3] 王庆利,刘耕陶.炎性细胞因子与阿尔采末病[J].中国药理学通报, 2002,18(01):1-5.
[3] Wang Q L, Liu G T. Inflammatory cytokines and Alzheimer disease[J].ChinPharmacolBull, 2002, 18(01):1-5.
[4] 文睿婷,张汉霆,冯婉玉,梁建辉.磷酸二酯酶-4的中枢功能研究进展[J].中国药理学通报, 2014,30(4):452-6.
[4] Wen R T, Zhang H T, Feng W Y, Liang J H. Research progress of PDE4 in the central nervous system[J].ChinPharmacolBull,2014,30(4):452-6.
[5] Wang C, Yang X M, Zhuo Y Y,et al. The phosphodiesterase-4 inhibitor rolipram reverses Abeta-induced cognitive impairment and neuroinflammatory and apoptotic responses in rats[J].IntJNeuropsychopharmacol, 2012, 15(6): 749-66.
[6] 丁 慧,陈 虹,姜 勇,等.松果菊苷对阿尔采末病大鼠海马、皮质内神经递质水平的影响[J].中国药理学通报, 2014,30(11):1564-9.
[6] Ding H, Chen H, Jiang Y, et al.Effect of echinacoside on monoamine neurotransmitters in hippocampus and cortex of rats with Alzheimer′s disease[J].ChinPharmacolBull, 2014,30(11):1564-9.
[7] Chen S Y, Wright J W, Barnes C D. The neurochemical and behavioral effects of beta-amyloid peptide(25-35)[J].BrainRes, 1996, 720(1-2): 54-60.
[8] 武冬慧,胡金凤,宋修云,等.小胶质细胞表达的受体与阿尔采末病[J].中国药理学通报, 2010,26(12):1550-3.
[8] Wu D H, Hu J F, Song X Y, et al.The receptors expression in microglia and Alzheimer′s disease[J].ChinPharmacolBull, 2010,26(12):1550-3.
[9] Cameron B, Tse W, Lamb R,et al. Loss of interleukin receptor-associated kinase 4 signaling suppresses amyloid pathology and alters microglial phenotype in a mouse model of Alzheimer′s disease[J].JNeurosci, 2012, 32(43): 15112-23.
[10] Ahn K S, Aggarwal B B. Transcription factor NF-kappaB: a sensor for smoke and stress signals[J].AnnNYAcadSci, 2005, 1056: 218-33.
[11] Munoz L, Ammit A J. Targeting p38 MAPK pathway for the treatment of Alzheimer′s disease[J].Neuropharmacology, 2010, 58(3): 561-8.
[12] Korhonen R, Hommo T, Keranen T,et al. Attenuation of TNF production and experimentally induced inflammation by PDE4 inhibitor rolipram is mediated by MAPK phosphatase-1[J].BrJPharmacol, 2013, 169(7): 1525-36.
[13] Rahman A, Anwar K N, Minhajuddin M,et al. cAMP targeting of p38 MAP kinase inhibits thrombin induced NF-kappaB activation and ICAM-1 expression in endothelial cells[J].AmJPhysiolLungCellMolPhysiol, 2004, 287(5): L1017-24.
[14] Caccamo A, Maldonado M A, Bokov A F,et al. CBP gene transfer increases BDNF levels and ameliorates learning and memory deficits in a mouse model of Alzheimer′s disease[J].ProcNatlAcadSciUSA, 2010, 107(52): 22687-92.
[15] Kim H G, Moon M, Choi J G,et al. Donepezil inhibits the amyloid-beta oligomer-induced microglial activationinvitroandinvivo[J].Neurotoxicology, 2014, 40: 23-32.
[16] Vandesquille M, Baudonnat M, Decorte L,et al. Working memory deficits and related disinhibition of the cAMP/PKA/CREB are alleviated by prefrontal alpha4beta2*-nAChRs stimulation in aged mice[J].NeurobiolAging, 2013, 34(6): 1599-609.
[17] Kotani S, Yamauchi T, Teramoto T, Ogura H. Donepezil, an acetylcholinesterase inhibitor, enhances adult hippocampal neurogenesis[J].ChemBiolInteract, 2008, 175(1-3): 227-30.
The new PDE4 inhibitor Roflupram ameliorated cognitive deficits and neuroinflammation in a rat model of Alzheimer’s disease
WANG Can-mao, CHENG Yu-fang,WU Jin-gang, GAN Dan-na, JIANG Yi-Ping,XU Jiang-Ping
(DeptofPharmacology,SchoolofPharmaceuticalSciences,SouthernMedicalUniversity,Guangzhou510515,China)
Aim To investigate whether the new PDE4 inhibitor Roflupram can ameliorate Aβ25-35induced cognitive deficits through the anti-neuroinflammation effects. Methods The Alzheimer’s disease model was produced by microinjection of amyloid-β(Aβ)25-35fibrils into the bilateral hippocampal CA1 area of male rats. Then the rats were randomly divided into sham-operated control group, Aβ25-35microinjected group, Aβ25-35microinjected followed by donepezil hydrochloride or Rolipram treated group, Aβ25-35microinjected combined Roflupram treated group with different doses. Treatment was given (i.g.) 24 h after microinjection surgery operation for consecutive 23 days. Morris water maze and passive avoidance test were used to test the behavior performance after drug treatments of 14 and 20 days. The protein level of cAMP downstream signaling molecules(p-PKA,P-CREB), proinflammatory cytokines (iNOS,COX-2,TNF-α,IL-1β), microglia and astrocyte activation marker(Iba-1,GFAP) and inflammation related protein (nuclear NF-κB p65,p-p38) in hippocampus were detected by Western blot. The mRNA level of proinflammatory cytokines was measured by semi-quantitative PCR. Results The results of behavioral manifestations indicated that Roflupram could significantly ameliorate the spatial learning and memory ability and the passive avoidance learning and memory ability impairment induced by microinjection of Aβ25-35. Biochemical analysis revealed that the hippocampus protein level of p-CREB and p-PKA of rats was significantly decreased induced by microinjection of Aβ25-35,while the level of NF-κBp65(Nucleus), p-p38, iNOS, COX-2, TNF-α, IL-1β, GFAP and Iba-1 was increased, and these effects were reversed by each kind of drug treatment. Semi-quantitative PCR test showed that each treatment could reduce the mRNA level of proinflammatory cytokines compared to the Aβ25-35microinjection animal. Conclusion The new PDE4 inhibitor Roflupram can ameliorate cognitive impairment induced by Aβ25-35infusion rat, which is related to its antigliosis, inflammatory cytokines expression reducing and neuroinflammation amelioration effect.
roflupram; Alzheimer’s disease; PDE4 inhibitor; neuroinflammation; amyloid beta-protein; cognitive; microglial
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.008.html
2014-12-03,
2015-01-04
国家自然科学基金委员会-广东省人民政府联合基金资助项目(No U1032006);国家自然科学基金资助项目(No 81373384)
王灿茂(1988-),男,硕士生,研究方向:神经药理与新药临床前评价,Tel:020-61648235,E-mail: wangcanmao@sina.cn; 徐江平(1967-),男,博士,教授,博士生导师,研究方向:神经药理与新药临床前评价,Tel:020-61648236, E-mail: jpx@smu.edu.cn
10.3969/j.issn.1001-1978.2015.03.008
A
1001-1978(2015)03-0327-07
R-332;R322.81;R338.64;R745.7;R977.3