米索前列醇对APP/PS1转基因小鼠的神经保护作用
2015-06-09纪超男胡馨月郭远新魏玉玲阳群芳杨俊卿
纪超男,胡馨月,郭远新,齐 云,魏玉玲,阳群芳,杨 洋,李 昱,杨俊卿
(1.重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,重庆 400016;2.西南药业股份有限公司,重庆 400038;3.重庆医科大学病理学教研室,重庆 400016)
米索前列醇对APP/PS1转基因小鼠的神经保护作用
纪超男1,胡馨月1,郭远新1,齐 云2,魏玉玲1,阳群芳1,杨 洋1,李 昱3,杨俊卿1
(1.重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,重庆 400016;2.西南药业股份有限公司,重庆 400038;3.重庆医科大学病理学教研室,重庆 400016)
目的 观察米索前列醇对APP/PS1转基因小鼠海马和皮层损伤的保护作用并探讨其机制。方法 实验动物设4组:转基因模型组和药物处理组APP/PS1转基因小鼠各10只,老年对照组为野生型C57小鼠10只,药物处理组给予米索前列醇,另两组给予羧甲基纤维素钠,均在小鼠24周龄时以200 μg·kg-1的量开始灌胃给予,连续给药20周,每周连续5 d,每天1次;在指标测试阶段,另取10只8周龄野生型C57小鼠作为青年对照组。采用Morris水迷宫测试空间学习记忆能力,HE染色观察海马和皮层神经元形态变化,生化法检测海马和皮层SOD活性、MDA含量变化,免疫组织化学法检测海马和皮层Aβ表达情况。结果 与老年对照组小鼠相比,转基因模型组小鼠寻台潜伏期明显延长,海马和皮层神经元出现明显核固缩,SOD活性明显下降,MDA含量明显增加,Aβ表达明显增多;给予米索前列醇后,APP/PS1转基因小鼠寻台潜伏期明显缩短,海马和皮层神经元核固缩明显减轻,SOD活性明显升高,MDA含量明显降低,Aβ表达明显减少。结论 米索前列醇对APP/PS1转基因小鼠海马和皮层的神经损伤有显著保护作用,其机制可能与米索前列醇减轻APP/PS1转基因小鼠脑组织氧化应激有关。
米索前列醇;APP/PS1;海马;皮层;Aβ;EP;氧化应激;神经保护作用
阿尔茨海默病(Alzheimer disease,AD)是一种与年龄高度相关的慢性中枢神经系统退行性疾病,主要病理特征是大脑β淀粉样蛋白(Aβ)在细胞外积累,并形成老年斑(SP)和脑神经细胞内tau蛋白异常磷酸化聚积形成神经纤维缠结(NTF),其发病机制尚未完全明了,临床亦无有效防治药物[1]。研究表明,中枢神经系统炎症和氧化应激是急慢性脑损伤疾病进程的共同特征之一,长期服用非甾体类抗炎药(NSAIDS)可抑制环氧合酶(COX),减少其下游产物前列腺素(prostaglandins,PGs)的生成,明显降低患者罹患AD的风险[2]。然而,长期服用NSAIDS,不仅使AD患者发生出血性心脑血管疾病及胃肠道溃疡等风险增加,且有增加患者认知缺陷的可能[3]。其原因可能与COX下游PGs及其受体类型繁多,长期服用NSAIDS 过度抑制COX活性,引发COX下游PGs合成酶-PGs-PGs受体信号通路紊乱,使保护性PGs效应被损伤性PGs效应掩盖有关。因此,有学者认为从下游PGs信号通路某些靶点干预,效果可能优于直接干预COX[4]。
米索前列醇(misoprostol)是人工合成的PGE1类似物,目前临床主要用于妇科和产科。最新研究表明,米索前列醇可以通过改善全身性氧化应激与炎症反应,对培养神经元可能产生神经保护作用[5]。我们前期研究也发现米索前列醇对慢性铝负荷所致的大鼠脑损伤有神经保护作用[6]。APP/PS1转基因小鼠是目前临床症状、病理变化与临床上AD最为相似的模型之一[7]。本研究以APP/PS1转基因小鼠为AD动物模型,通过慢性口服给予APP/PS1转基因小鼠米索前列醇,观察其对APP/PS1转基因小鼠的神经保护作用。
1 材料与方法
1.1 材料
1.1.1 动物 将购于南京大学模式动物研究所的APP/PS1 转基因小鼠[B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J][动物许可证号:SCXK(苏)2010-0111],以雄 ∶雌=1 ∶2比例合笼,成功繁殖后,产下后代3周后离乳,用PCR鉴定基因型;相应野生型C57(C57/BL6)小鼠购于重庆医科大学动物中心[动物许可证号:SCXK(渝)2012-0001],所有动物均饲养于重庆医科大学动物中心SPF级环境。所有实验操作均获得重庆医科大学实验动物伦理委员会的许可。
1.1.2 药品与试剂 米索前列醇 (北京紫竹药业,43130916);Biospin组织基因组DNA提取试剂盒(杭州博日科技有限公司,20130501);超氧化物歧化酶(SOD)、丙二醛(MDA) 试剂盒(南京建成生物工程研究所,20140222,20140219);鼠抗单克隆Aβ抗体(abcam,Ab11132); DAB 显色试剂盒(北京中杉金桥,K137726A);其余试剂均为国产分析纯。
1.1.3 主要仪器 凝胶成像系统 (Bio-Rad,美国),Morris 水迷宫(中国医学科学院药物研究所),低温离心机(Sigma,美国),光学显微镜(Nikon,日本),全自动酶标仪(Spectra Max M2 公司,美国) 。
1.2 方法
1.2.1 APP/PS1转基因传代小鼠基因型鉴定 小鼠离乳时,剪取尾端组织约 0.5 cm,参照Biospin组织基因组 DNA 提取试剂盒说明书,提取基因组 DNA 。由上海生物工程有限公司合成引物,APP引物上游序列5′-GACTGACCACTCGACCAGGTTCTG-3′,下游序列 5′-CTTGTAAGTTGGATTCTCATATCCG-3′,PCR扩增片段长度350 bp;PS1 引物上游序列 5′-AATAGAGAACGGCAGGAGCA-3′,下游序列5′-GCCATGAGGGCACTAATCAT-3′,PCR扩增片段长度608bp;内参PRP引物上游序列5′-CCTCTTTGTGACTATGTGGACTGATGTCGG-3′,下游序列5′-GTGGATAACCCCTCCCCCAGCCTAGACC -3′,PCR扩增片段长度750 bp。反应总体系为 25 μL: ddH2O 8 μL, 2×Taq Master Mix 12.5 μL,上游引物1 μL,下游引物1 μL,基因组 DNA 2.5 μL,反应循环参数为94℃ 3 min,随后 94℃ 30 s,56℃ 1 min,72℃ 1 min,35个循环,72℃ 5min,反应结束,4℃保存。扩增产物用10 g·L-1琼脂糖凝胶电泳观察。
1.2.2 分组与给药 实验分4组:根据传代小鼠基因型鉴定结果,筛选APP、PS1双阳性转基因小鼠20只,随机分为两组,即转基因模型组和药物处理组;取10只同周龄野生型C57小鼠作为老年对照组,在小鼠24周龄时开始灌胃。参考我们前期米索前列醇对慢性铝负荷大鼠产生神经保护作用的给药方法[6],使米索前列醇溶于5 g·L-1羧甲基纤维素钠,以200 μg·kg-1给予药物处理组小鼠,连续给药20周,每周连续5 d,每天1次,灌胃体积为0.1 mL·kg-1。转基因模型组和老年对照组给予相应体积的5 g·L-1羧甲基纤维素钠。在灌胃结束前3 d,另取10只8周龄野生型C57小鼠作为青年对照组。各组小鼠均♀♂各半。
1.2.3 行为学测定 停止灌胃d 2,电脑全自动程控Morris水迷宫对小鼠进行空间学习记忆能力测试。实验阶段一:首次训练时将小鼠置于平台上适应60s,之后依次从A、B、C、D 4个入水点将小鼠背对平台入水,令其自由游泳到达平台,小鼠首次上台时间即为寻台潜伏期(exploring time,EL);90s内未找到平台者,操作人员协助将其引至平台并停留10s,EL记为90s,从d 2起,同样方法每日训练4次,持续训练4 d。阶段二:在d 5时撤去平台,将小鼠从最后1次训练时的入水位置放入,电脑记录小鼠第1次跨越原平台的时间即为EL,超过90 s未找到平台者,EL记为90 s。
1.2.4 组织病理学检查 每组取4只小鼠,40 g·L-1水合氯醛(0.1 ml·kg-1,i.p.)麻醉,仰卧位固定于蛙板上。以肝脏作为血液及灌注液出口,每只小鼠用约30 ml预冷肝素化生理盐水及50 ml 40 g·L-1多聚甲醛磷酸盐缓冲液,经左心室快速滴入,进行在体灌流及脑固定。完整分离脑组织,4℃保存于40 g·L-1多聚甲醛2~3 d,梯度乙醇脱水,石蜡包埋,冠状切面连续切片,厚约4~5 μm,HE染色,光镜下观察海马及皮层神经元形态变化。
1.2.5 SOD 活性、MDA含量检测 每组另取6只小鼠,断颈取脑,分离海马与皮层,用生理盐水分别制成10 g·L-1的匀浆液,参照说明书,以黄嘌呤氧化酶法测定 SOD 活性,硫代巴比妥酸法测定MDA 含量变化。
1.2.6 Aβ表达检测[15]采用免疫组织化学法检测,取1.2.4所述石蜡切片,常规脱蜡至水,枸橼酸高温修复抗原,30 g·L-1H2O2孵育,山羊血清封闭,1 ∶100 Aβ一抗4℃孵育过夜,二抗室温孵育30 min,辣根酶标记的链霉卵白素工作液室温孵育后,镜下滴加DAB至显色,自来水充分冲洗,复染、脱水、透明、封片,显微镜下观察海马及皮层Aβ表达情况,每组4只小鼠各取1张切片,每张切片取400×光镜下3个不同视野,用软件Image-pro plus 6.0进行光密度分析。
2 结果
2.1 APP/PS1转基因传代小鼠基因型鉴定观察PCR产物电泳结果,350 bp(APP)和608 bp(PS1)处均出现明显条带者为阳性APP/PS1双转基因小鼠(Fig 1)。
2.2 米索前列醇对APP/PS1转基因小鼠空间学习记忆力的影响与青年对照组小鼠相比,老年对照组小鼠寻台潜伏期延长(P<0.05),而转基因模型组小鼠较老年对照组小鼠寻台潜伏期延长(P<0.05),给予米索前列醇后,可明显缩短APP/PS1转基因小鼠寻台潜伏期(P<0.05,Tab 1)。

Tab 1 Effects of misoprostol on changes of exploring time of APP/PS1 transgenic ±s,n=10)
#P<0.05vsyouth group;*P<0.05vselderly group;△P<0.05vsAPP/PS1 group.
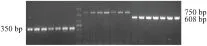
Fig 1 Positive results of APP/PS1 transgenic mice genotype by PCR
2.3 米索前列醇对APP/PS1转基因小鼠海马和皮层病理形态结果的影响青年对照组小鼠海马和皮层神经元结构清楚,排列紧密,核膜完整,核仁清晰,无明显核固缩,与青年对照组小鼠相比,老年对照组小鼠海马和皮层神经元数目减少,胞核出现核固缩,核深染现象,而转基因模型组小鼠海马和皮层神经元大片死亡,数目明显减少,核固缩及核深染现象较老年组更加明显,给予美索前列醇后,转基因小鼠海马和皮层神经元坏死、核固缩及核深染现象减轻(Fig 2,3)。
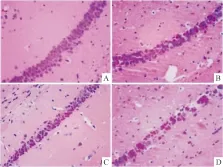
Fig 2 Effect of misoprostol on neuronal damage of APP/PS1 transgenic mice hippocampus(HE×400)
A:Youth group; B:Elderly group; C: APP/PS1 group; D: Misoprostol-trearted group
2.4 海马和皮层组织SOD、MDA 的变化与青年对照组小鼠相比,老年对照组小鼠海马SOD活性明显降低(P<0.05),MDA含量明显升高(P<0.01),皮层SOD活性明显降低(P<0.05),MDA含量明显升高(P<0.05)。与老年对照组小鼠相比,转基因模型组小鼠海马SOD活性明显降低(P<0.05),MDA含量明显升高(P<0.05),皮层SOD活性明显降低(P<0.01),MDA含量明显升高(P<0.05)。给予米索前列醇后,转基因小鼠海马SOD活性明显升高(P<0.05),MDA含量明显降低(P<0.05),皮层SOD活性明显升高(P<0.05),MDA含量明显降低(P<0.05,Tab 2,3)。
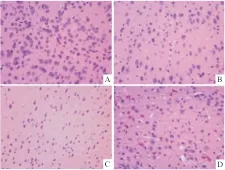
Fig 3 Effect of misoprostol on neuronal damage of APP/PS1 transgenic mice cortex (HE×400)
A:Youth group; B:Elderly group; C: APP/PS1 group; D: Misoprostol-trearted group
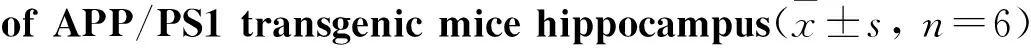
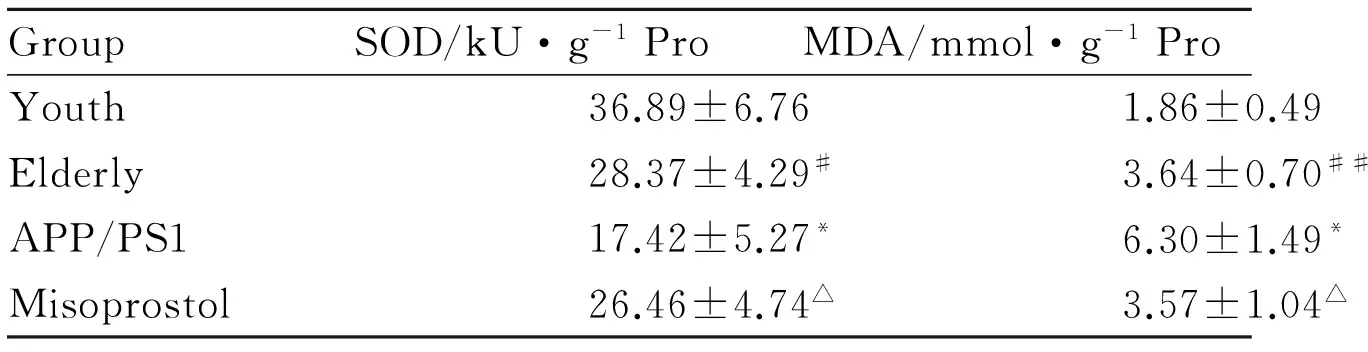
GroupSOD/kU·g-1ProMDA/mmol·g-1ProYouth36.89±6.761.86±0.49Elderly28.37±4.29#3.64±0.70##APP/PS117.42±5.27*6.30±1.49*Misoprostol26.46±4.74△3.57±1.04△
#P<0.05,##P<0.01vsyouth group;*P<0.05vselderly group;△P<0.05vsAPP/PS1 group.
2.5 米索前列醇对APP/PS1小鼠海马和皮层Aβ表达的影响青年对照组小鼠海马和皮层神经细胞几乎检测不到Aβ的表达,老年对照组小鼠海马和皮层神经细胞内有少量Aβ表达,胞外未见明显Aβ聚积;而在转基因模型组小鼠海马和皮层不但胞内表达Aβ,且胞外Aβ大量聚积,形成明显老年斑;给予米索前列醇后,转基因小鼠海马和皮层Aβ表达减少,聚积形成的老年斑得到改善(Fig 4,5)。Image-Pro Plus 6.0分析各组图片平均光密度值,老年对照组小鼠海马和皮层Aβ光密度值较青年对照组明显增加(P<0.01),转基因模型组小鼠海马和皮层Aβ光密度值较老年对照组明显增加(P<0.05),给予米索前列醇后,转基因小鼠海马和皮层Aβ光密度值明显降低(P<0.05,Fig 6)。
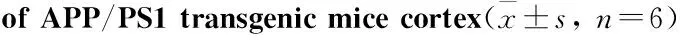

GroupSOD/kU·g-1ProMDA/mmol·g-1ProYouth34.83±5.971.62±0.46Elderly25.18±4.36#3.32±0.94#APP/PS113.40±3.16**5.67±1.21*Misoprostol23.50±6.68△3.46±0.71△
#P<0.05vsyouth group;*P<0.05,**P<0.01vselderly group;△P<0.05vsAPP/PS1 group.
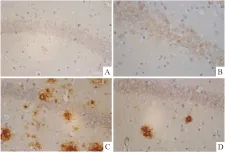
Fig 4 Effect of misoprostol on Aβ expression of APP/PS1 transgenic mice hippocampus (×400)
A:Youth group; B:Elderly group; C: APP/PS1 group; D:Misoprostol-trearted group
3 讨论
AD是老年痴呆的主要类型之一,临床以进行性认知功能障碍、精神行为异常及生活能力减退等为主要表现,随着人口老龄化的日益突出,已成为严重威胁人类健康及生活质量的疾病之一[8]。目前,临床仍无有效的防治手段,因此深入研究其发生机制,开发防治AD的有效药物势在必行。
AD动物模型多种多样,但现有动物模型均不能全面准确地反映其特征。相比其他动物模型,APP/PS1转基因小鼠脑内不仅出现Aβ沉积、形成Aβ斑块的时间早,而且Aβ的量多,并伴有神经细胞损伤和突触丢失以及与年龄有关的神经行为功能障碍等,因而是重要的模型之一[9]。本实验采用APP/PS1转基因小鼠作为AD动物模型,发现其与老年野生型C57小鼠相比,空间学习记忆能力降低,海马和皮层神经元核固缩及核深染现象严重, SOD活性下降, MDA含量增加,Aβ表达增多且聚积形成明显老年斑,这与Wang等[10]研究结果一致。
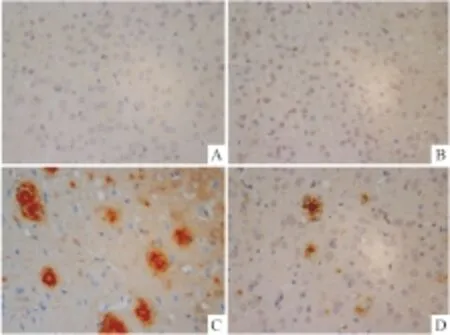
Fig 5 Effect of misoprostol on Aβ expression of APP/PS1 transgenic mice cortex (×400)
A:Youth group; B:Elderly group; C: APP/PS1 group; D:Misoprostol-trearted group
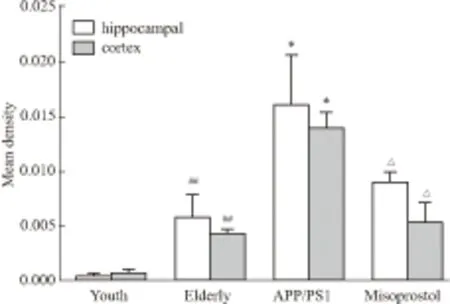
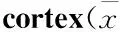
##P<0.01vsyouth group;*P<0.05vselderly group;△P<0.05vsAPP/PS1 group
神经退行性疾病进程中,氧化应激发挥着重要作用,随着脑损伤的加剧,脑组织大量产生氧自由基并过量聚积,通过脂质代谢产生MDA等发挥毒性作用[11]。本实验研究发现,给予米索前列醇后,APP/PS1转基因小鼠海马和皮层SOD活性增加, MDA含量降低,Aβ的表达及老年斑的形成减少,神经元核固缩及核深染现象减少,小鼠寻台潜伏期缩短,这表明米索前列醇能降低APP/PS1转基因小鼠海马和皮层的氧化应激程度和神经损伤程度,改善其空间学习记忆力。与我们研究结果类似, Abdel等[12]发现,在LPS所致的小鼠损伤模型中,米索前列醇可通过降低小鼠脑部MDA含量,升高小鼠脑部谷胱甘肽(GSH)活性,减轻小鼠脑部的氧化应激程度,从而发挥神经保护作用。Li等[13]发现,在大脑中动脉结扎脑损伤模型中,米索前列醇可降低大鼠脑水肿及梗死面积,提高其神经功能学评分。这些结果提示,在脑损伤模型中,给予米索前列醇可能对模型产生神经保护作用,这可能与米索前列醇改善模型脑组织的氧化应激有关。Bilak等[14]发现,在慢性谷氨酸转运体抑制剂诱导的肌萎缩侧索硬化症模型中,与米索前列醇同为EP3激动剂的硫前列酮,可减少皮层运动神经元坏死,降低其炎症及氧化应激程度。
综上所述,米索前列醇对APP/PS1转基因致AD小鼠可发挥神经保护作用,其机制可能与其降低小鼠脑组织的氧化应激有关。另一方面,考虑到米索前列醇主要激动的是EP3受体,其神经保护作用机制与EP3受体介导的信号通路是否相关需要进一步的研究证实。
[1] Ghezzi L, Scarpini E,Galimberti D. Disease-modifying drugs in Alzheimer’s disease[J].DrugDesDevTher, 2013, 7(12), 1471-9.
[2] Milatovic D, Montine T J, Aschner M. Prostanoid signaling: Dual role for prostaglandin E2 in neurotoxicity[J].NeuroToxicol, 2011, 32(3):312-9.
[3] Cote S,Carmichael P H,Verreault R, et al.Nonsteroidal anti-inflammatory drugs use and the risk of cognitive impairment and Alzheimer’s disease[J].AlzheimersDement, 2012, 8(3): 219-26.
[4] Khansari P S, Coyne L.NSAIDs in the treatment and/or prevention of neurological disorders[J].Inflammopharmacology,2012,20(3):159-67.
[5] Tamiji J, Crawford D A. Prostaglandin E(2) and misoprostol induce neurite retraction in Neuro-2a cells[J].BiochemBiophysResCommun,2010,398(3):450-6.
[6] 郭远新.米索前列醇对慢性铝过负荷大鼠的神经保护作用[D].重庆:重庆医科大学,2013:13-49.
[6] Guo Y X.Protective effect of misorpostol on neurodegeneration induced by chronicaluminum overload in rats[D].Chongqing: Chongqing Medical University,2013:13-49.
[7] Tarja Malm, Johanna Magga, Jari Koistinaho. Animal models of Alzheimer’s disease: Utilization of transgenic Alzheimer’s disease models in studies of amyloid beta clearance[J].CurrTranslGeriatrGerontolRep, 2012, 1(1):11-20.
[8] 葛 润.阿尔茨海默病的研究进展[J].中外医学研究,2014,12(9):155-7.
[8] Ge R. The progress in the research of Alzheimer′s disease[J].ChinAndForeignMedRes,2014,12(9):155-7.
[9] Kemppainen S, Hämäläinena E, Miettinen P O, et al. Behavioral and neuropathological consequences of transient global ischemia in APP/PS1 Alzheimer model mice[J].BehavBrainRes,2014,275(12):15-26.
[10] Wang C M,Liu M Y,Wang F, et al. Anti-amnesic effect of pseudoginsenoside-F11in two mouse models of Alzheimer′s disease[J].Pharmacol,BiochemBehav,2013,106(3):57-67.
[11] Milatovic D, Zaja-Milatovic S, Gupta R C. Oxidative damage and neurodegeneration in manganese-induced neurotoxicity[J].ToxicolApplPharmacol, 2009,240(2):219-25.
[12] Abdel-Salam OME, Mohammed N A, Morsy SMY, et al.Misoprostol decreases oxidative stress and liver injury in bacterial lipopolysaccharide-induced endotoxemia in mice[J].CompClinPathol,2014,23(3):589-601.
[13] Li J, Liang X, Wang Q, et al. Misoprostol, an anti-ulcer agent and PGE2receptor agonist, protects against cerebral ischemia[J].NeurosciLett, 2008, 438(2): 210-5.
[14] Bilak M, Wu L, Wang Q, et al. PGE2receptors rescue motor neurons in a model of amyotrophic lateral sclerosis[J].AnnNeurol,2004,56(2):240-8.
[15] 孙洁芸,李丹,王晨等.姜黄素对APPswe/PSEN1dE9 双转基因小鼠学习记忆能力及大脑中Aβ42表达的影响[J].中国药理学通报, 2013 ,29(8): 1084-8.
[15] SUN J Y, Li D, Wang C, et al. Effect of curcumin on ability of learning and memory and expression of Aβ42in brain of APPswe /PS1dE9 double transgenic mice[J].ChinPharmacolBull, 2013,29(8): 1084-8.
Protective effect of misoprostol on neurodegeneration in APP/PS1 transgenic mice
JI Chao-nan1, HU Xin-yue1,GUO Yuan-xin1,QI Yun2,WEI Yu-ling1,YANG Qun-fang1,YANG Yang1,LI Yu3,YANG Jun-qing1
(1.DeptofPharmacology,KeyLaboratoryofBiochemistryandMolecularPharmacology,ChongqingMedicalUniversity,Chongqing400016,China;2.SouthwestPharmaceuticalCo.,Ltd,Chongqing400038,China; 3.DeptofPathology,ChongqingMedicalUniversity,Chongqing400016,China)
Aim To investigate the protective effects of misoprostol on hippocampal and cortical neuronal injury in APP / PS1 transgenic mice and its possible mechanism.Methods Mice were divided into 4 groups including youth group, elderly group, APP/PS1 group and misoprostol-treated group.Ten 24-month-old APP / PS1 transgenic mice were randomized into two groups as APP / PS1 group and misoprostol-trearted group. Ten 24-month-old wild-type C57 mice were chosen as elderly group.Mice in misoprostol-treated group were administered with misoprostol (200μg·kg-1d-1, p.o.) five days a week for 20 weeks. Mice in the other two groups were administered with carboxymethylcellulose sodium(200 μg·kg-1d-1, p.o.) five days a week for 20 weeks. Three days before misoprostol treatment was stopped, ten 8-week-old wild-type C57 mice were chosen as youth group. The spatial learning and memory function was evaluated by Morris water maze.The hippocampal and cortical neuronal damage was detected by HE staining. SOD activities and MDA contents were measured by biochemistry method.The expression of Aβ in mice hippocampus and cortex was observed using the immunohistochemical method.Results Compared with those of elderly group,the exploring time of mice was lengthened remarkably, the hippocampal and cortical neurons appeared obvious nucleus pycnosis and deep dye, the SOD activities were decreased significantly, the MDA contents and the levels of Aβ increased significantly in APP/PS1 group. Compared with those of APP/PS1 group,the exploring time of mice was shortened remarkably, the damage of hippocampal and cortical neurons reduced significantly, the SOD activities increased significantly, the MDA contents and the levels of Aβ decreased significantly in the misoprostol-treated group.Conclusion Our research results suggest that misoprostol has a significant neuroprotective effect on brain injury in APP/PS1 transgenic mice. The neuroprotective mechanism of misoprostol might be related to its antioxidative stress in APP/PS1 transgenic mice.
misoprostol; APP/PS1; hippocampus; cortex; Aβ; EP; oxidative stress; neuroprotective effect
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.009.html
2014-12-08,
2015-01-04
国家自然科学基金资助项目(No 81070972)
纪超男(1988-),女,硕士生,研究方向:神经精神药理学,E-mail:chaonan1988@163.com; 杨俊卿(1968-),男,博士,教授,博士生导师,通讯作者,Tel:023-68485161,E-mail:qqqjy@sohu.com
10.3969/j.issn.1001-1978.2015.03.009
A
1001-1978(2015)03-0334-06
R-332;R322.81;R394.2;R745.7;R977.6;R979.22