干细胞样U87胶质瘤细胞向内皮细胞转分化及VEGFR2人源化单克隆抗体的干预作用
2015-06-09宣自学李琳娜徐诚望杨德宣王珊珊袁守军
宣自学,张 琦,李琳娜,原 野,徐诚望,杨德宣,王珊珊,袁守军
(1.浙江省人民医院药学部,浙江 杭州 310014;2.军事医学科学院放射与辐射医学研究所药理毒理研究室,北京 100850;3.山东步长神州制药有限公司,山东 菏泽 274000)
干细胞样U87胶质瘤细胞向内皮细胞转分化及VEGFR2人源化单克隆抗体的干预作用
宣自学1,2,张 琦2,李琳娜2,原 野3,徐诚望2,杨德宣2,王珊珊2,袁守军2
(1.浙江省人民医院药学部,浙江 杭州 310014;2.军事医学科学院放射与辐射医学研究所药理毒理研究室,北京 100850;3.山东步长神州制药有限公司,山东 菏泽 274000)
目的 建立干细胞样U87胶质瘤细胞向内皮细胞的转分化模型,初步评价抗VEGFR2人源化单克隆抗体对转分化的影响。方法 体外诱导培养获得干细胞样U87胶质瘤细胞;流式细胞仪检测CD133+细胞含量;定量PCR检测CD133、Nestin以及VEGFR2表达;观察干细胞样U87细胞的致瘤能力、肿瘤生长速度和CD31表达情况;观察干细胞样U87细胞在Matrigel上血管状结构形成和CD31、CD34、vWF表达情况;建立干细胞样U87细胞向内皮细胞的转分化模型,评价抗VEGFR2人源单抗对转分化的抑制作用。结果 获得干细胞球样的U87细胞,其肿瘤生长更快,且血管增多,接种在Matrigel上形成血管状结构,CD31、CD34、vWF表达增加; 抗VEGFR2人源单抗使血管状结构和CD31、CD34、vWF表达均减少。结论 成功建立干细胞样U8细胞向内皮细胞转分化模型,VEGFR2人源化单抗对转分化有抑制作用。
干细胞样U87细胞;Matrigel胶;内皮细胞;转分化;VEGFR2;血管状结构
肿瘤血管为肿瘤生长提供足够的氧分和营养,靶向肿瘤血管生成可以达到抑制肿瘤生长的作用[1]。目前靶向VEGF的药物在临床上已经展现出很好的抗肿瘤作用,但该信号通路只能暂时地被抑制,一旦药物撤除,信号通路会重新激活,肿瘤组织迅速建立血供,生长速率有时会更快[2]。随着研究的深入,越来越多的证据显示,肿瘤干细胞(cancer stem cells, CSCs)的异质性和可塑性导致其功能的多样性,可通过多种方式为肿瘤生长提供各种需求[3],在肿瘤血管新生过程中也发挥着重要作用[4]。
研究发现[5],肿瘤干细胞不仅可以通过产生大量的血管生成因子如VEGF、SDF-1/CXCR4和HIF,“引诱”血管延伸向自己靠拢,而且在许多因子的参与下,通过构建肿瘤细胞间通道,形成血管拟态,进而促进肿瘤血管的生成。此外,肿瘤干细胞还能够直接通过转分化成为血管内皮细胞,构成肿瘤新生血管的主要部分(Fig 1A),从而在肿瘤发生、发展过程中发挥重要角色[6]。例如,人们发现肿瘤内发生染色体变异的内皮细胞是由肿瘤干细胞分化而来;在血管较丰富的神经胶质瘤内部,70%的内皮细胞都是由肿瘤干细胞分化而产生的[7]。另有文献报道,位于血管周围微环境中胶质瘤干细胞,经历间质分化生成血管周细胞,支持血管的功能和肿瘤的生长[8]。为了研究肿瘤血管形成的来源及机制,我们体外低黏附、干细胞培养基诱导获得干细胞样U87胶质瘤细胞,并且在Matrigel上建立胶质瘤干细胞向内皮细胞转分化的体外模型[9]。
VEGFR2在CD133阳性的胶质瘤干细胞上高表达,影响着胶质瘤干细胞的活性、自我更新能力、致瘤性[10],而且可能调控着胶质瘤干细胞向内皮细胞的转分化过程。因此我们以VEGFR2人源化单克隆抗体为例,利用建立的胶质瘤干细胞向血管内皮细胞转分化模型,研究药物对胶质瘤干细胞向血管内皮细胞转分化的干预作用。
1 材料与方法
1.1 实验材料Matrigel胶(BD公司),RPMI 1640 培养基(Hyclone),Accutase Solution(Millipore公司),BD cell recovery solution(BD公司),TRIzol(Sigma公司),2×qPCR Mix(北京康为世纪生物有限公司),FBS(Hyclone),DMEM/F12(1 ∶1)培养基(Gibco公司),表皮生长因子EGF、碱性成纤维生长因子bFGF(PeproTeth公司),细胞因子B27 Supplement (Gibco公司),CD133-PE流式抗体(美天旎公司),抗VEGFR2人源化单克隆抗体(山东步长神州制药有限公司),U87细胞(中国协和细胞库),Hera cell-50 CO2气体培养箱,YT-CJ-1ND型超净工作台,超低黏附6 孔培养板、普通6孔细胞培养板(Corning公司),AMG EVOS XL显微镜(AMG公司),GUAVA流式细胞仪(Millipore 公司),实时定量PCR仪(安捷伦Mx3005P)
1.2 实验方法
1.2.1 U87胶质瘤干细胞的获取 普通U87胶质瘤细胞用10%FBS 的RPMI 1640 培养,传至三代后,消化收集细胞,接种在含DMEM/F12(1 ∶1) 无血清培养基的超低黏附6 孔培养板中,培养基中另外添加终浓度为20 μg·L-1bFGF,20 μg·L-1EGF,5 kU·L-1胰岛素,2% B27 等成分,置于37 ℃,5%CO2培养箱中。细胞呈悬浮状生长,并且相互聚集成干细胞球样,开始两周,每4~5天用Accutase Solution消化分散成单个细胞,传代,然后让其成球生长直至足够大小[11]。
1.2.2 U87胶质瘤干细胞的验证 利用AMG EVOS XL显微镜照相,观察U87干细胞成球情况。然后将球样U87胶质瘤细胞用Accutase Solution消化分散成单个细胞,离心收集细胞,一部分细胞用于流式细胞仪检测胶质瘤干细胞标志物CD133的表达;另外一部分细胞用于提取RNA后定量PCR检测干细胞相关基因CD133、Nestin以及VEGFR2的表达情况,并且与普通培养的U87细胞作比较[12]。
1.2.3 U87胶质瘤干细胞成瘤实验 Nu/ Nu鼠,雌性,体质量18~22 g,6~8周龄,北京维通利华实验动物技术有限公司购买。实验动物许可证号:SCXK(京)2012-001。将超低黏附培养获得的干细胞球样U87胶质瘤细胞用Accutase Solution消化分散成单个细胞,普通条件下培养的U87细胞用胰酶消化,离心重悬、计数后,均按照细胞悬液浓度为每只2×106接种到每只Nu/Nu鼠右腋皮下,建立荷瘤鼠模型[13],每组5只裸鼠。观察普通条件下U87细胞和低黏附培养获得的干细胞球样U87细胞肿瘤生长情况,4周后结束实验,将动物后颈部脱臼处死,剥离瘤块用于拍照、称重,然后储存在4%甲醛溶液中,以备HE染色和CD31免疫组化染色。
1.2.4 胶质瘤干细胞向血管内皮细胞转分化模型的建立 将Matrigel基质胶放于4℃进行解冻,并且将6孔细胞培养板和200μl枪头放于冰上预冷,培养板每孔均匀铺入150 μl Matrigel,然后置于37℃培养箱中孵育30 min。将获得的U87胶质瘤干细胞用Accutase Solution消化成单个细胞后,离心计数,以3×107接种至铺有Matrigel的6孔板中,12小时后,照相观察微管状结构形成情况,并且利用BD cell recovery solution回收Matrigel上的细胞,提取RNA,经逆转录后,qPCR检测CD31、CD34、vWF等内皮细胞标志物基因的表达情况[11]。普通条件培养的U87细胞也按照上述方法进行实验,比较两种细胞的内皮细胞标志物基因CD31、CD34、vWF表达量的差别。
1.2.5 抗VEGFR2人源化单抗对U87干细胞向血管内皮细胞转分化的干预作用 按照上面方法接种干细胞样U87细胞(3.5×107)至Matrigel建立转分化模型,然后将实验分为3组,包括空白对照组、抗VEGFR2人源化单抗50 mg·L-1组、抗VEGFR2人源化单抗200 mg·L-1组,每组重复3孔。处理后,37℃,5%CO2培养箱中培养24 h,观察药物对微管状结构的影响,最后用BD cell recovery solution回收Matrigel上的细胞,qPCR检测CD31、CD34、vWF基因的表达变化。
1.2.6 RT-qPCR 按照TRIzol法提取细胞总RNA,经反转录得到cDNA,取2×qPCR Mix 10 μL,上下游引物(10 μmol·L-1)各0.5 μL和DNA模板1 μL,然后加DEPC水至20 μL。混匀后,置于qPCR仪中,95℃变性10 min,然后经95℃变性30 s,60℃退火30 s,共39个循环,扩增。最后统计实验结果,观察各基因的变化情况。实验中涉及的各基因引物:Actin上游引物5′-TTCCTTCCTGGGCATGGAGTCCTG-3′,下游引物5′-GAGGAGCAATGATCTTGATCTTCA-3′;CD133上游引物5′-AGGCACTTACGGCACTCTTC-3′,下游引物5′-TTTCTTCCTGCTGCACCCAA-3′;Nestin上游引物5′-CTGGAGCAGGAGAAACAGGG-3′,下游引物5′-CTGAGGGAAGTCTTGGAGCC-3′;VEGFR2上游引物5′-CCAGGCAACGTAAGTGTTCGAG-3′,下游引物5′-GGGACCCACGTCCTAAACAAAG-3′;CD31上游引物5′-CCAGTGTCCCCAGAAGCAAA-3′,下游引物5′-TGATAACCACTGCAATAAGTCCTTTC-3′;CD34上游引物5′-ACGGCCATTCAGCAAGACAAC-3′,下游引物5′-GCACGTGGTCAGATGCAGAGA-3′;vWF上游引物5′-AGCCCATTTGCTGAGCCTTG-3′,下游引物5′-CCTGGCACCATGCATTTCTG-3′。
1.2.7 数据统计 用Origin 8.0软件进行数据的绘图,用Student′st检验进行组间的统计学分析。
2 结果
2.1 U87干细胞球的形成将普通U87胶质瘤细胞消化收集细胞后,接种于超低黏附6 孔培养板中培养。 结果显示,细胞相互聚集成干细胞球样,且随着培养时间延长,干细胞球越来越大(Fig 1B)。提示低黏附培养能够获得干细胞球样的U87细胞。
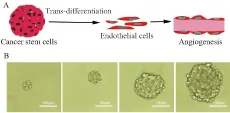
Fig 1 Trans-differnetiation of cancer stem cells and establishment of stem-like U87
A: Cancer stem cells trans-differentiate to endothelial cells; B: Establishment of stem-like U87 spheres
2.2 U87干细胞的干性验证用Accutase Solution将上述获得U87干细胞球样细胞消化分散成单个细胞,CD133流式抗体标记后,流式细胞仪检测发现干细胞样的U87细胞的干细胞标志物CD133表达量为31.82%,与普通培养的U87细胞相比,CD133表达量明显增加(Fig 2)。
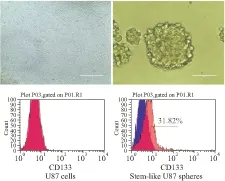
Fig 2 Morphology and CD133 expression of U87 cells, stem-like U87 spheres
分别收集普通培养的U87细胞和低黏附、干细胞培养基诱导的U87干细胞球样细胞,用qPCR检测干细胞相关基因CD133、Nestin,并且检测两种细胞VEGFR2基因的差异,实验结果显示,干细胞样U87细胞CD133、Nestin和VEGFR2的表达均明显上调(P<0.001),差异有统计学意义(Fig 3),以上结果提示我们获得了干细胞样的U87细胞。

Fig 3 The CD133, Nestin, VEGFR2 expression of U87 cells, stem-like U87 spheres using real-time PCR**P<0.01 vs U87 cells
2.3 U87干细胞成瘤能力将获得的干细胞球样U87细胞和普通的U87细胞均以每只2×106细胞的浓度接种到每只Nu/Nu鼠右腋皮下,建立荷瘤鼠模型,结果发现干细胞样U87细胞和普通培养的U87细胞均能在小鼠皮下成瘤,但是干细胞样U87细胞长出的肿瘤生长比普通培养的U87细胞的移植瘤更快(P<0.05)(Fig 4A)。d 31干细胞样U87细胞移植瘤的体积为(1 734.60±605.50) mm3,而普通培养的U87细胞移植瘤的瘤体积只有(875.28±472.67) mm3。将动物脱臼处死后取出瘤块并称重,发现干细胞样U87细胞移植瘤的瘤重也明显增加(P<0.05),其为(1.68±0.74) g,普通培养的U87细胞移植瘤的瘤重则为(0.60±0.38) g(Fig 4B,4C)。
对两组肿瘤进行HE染色和CD31免疫组化分析,结果显示普通培养的U87细胞和干细胞样U87细胞均能成瘤,且都有CD31标记的血管存在。但是干细胞样U87细胞的肿瘤中CD31表达明显要多于普通培养U87细胞肿瘤(Fig 5)。
2.4 干细胞样U87细胞向内皮细胞转分化模型建立干细胞样U87细胞(3×1010cells·L-1)接种至铺有Matrigel的6孔板中,12 h后,用AMG EVOS XL显微镜观察微管状结构形成情况。Fig 6显示干细胞样U87细胞在Matrigel上确实能够形成血管状结构。利用BD cell recovery solution回收Matrigel上的细胞,qPCR检测CD31、CD34、vWF等内皮细胞标志物基因的表达情况,结果显示接种在Matrigel上的干细胞样U87细胞内皮细胞标志基因CD31、CD34、vWF均表达量增加(P<0.001),提示可能干细胞样U87细胞发生转分化,形成了内皮细胞(Fig 7B)。
2.5 抗VEGFR2人源化单抗抑制U87干细胞向血管内皮细胞的转分化建立U87胶质瘤干细胞向内皮细胞转分化模型后,加入抗VEGFR2人源化单抗50、200 mg·L-1,12 h后qPCR检测CD31、CD34、vWF表达量,发现与接种在Matrigel上且不加药的细胞相比,抗VEGFR2人源化单抗50、200 mg·L-1给药组的微管状结构明显减少(Fig 7A),而且CD31、CD34、vWF基因的表达都有所降低(P<0.05,Fig 7B)。这些结果说明抗VEGFR2人源化单抗能够抑制胶质瘤U87干细胞向血管内皮细胞转分化。
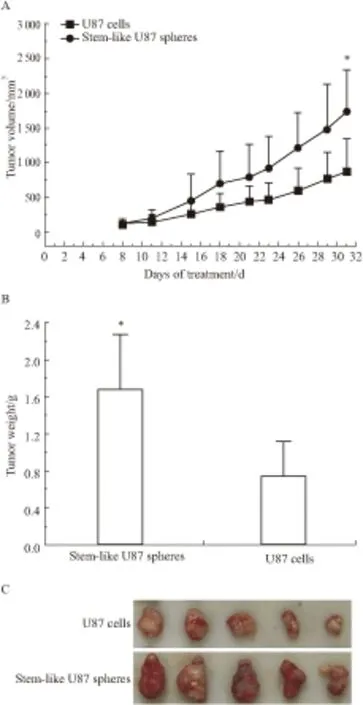
Fig 4 Tumorigenic assay of U87 cells, stem-like U87 spheres
A: The tumor volume of U87 cells, stem-like U87 spheres; B: The tumor weight of U87 cells, stem-like U87 spheres; C: The tumors of U87 cells, stem-like U87 spheres.**P<0.01vsU87 cells

Fig 5 HE staining and CD31 immunostaining of U87 cells,stem-like U87 spheres xenografts
A: HE staining of U87 cells, stem-like U87 spheres xenografts; B and C: CD31 immunostaining of U87 cells, stem-like U87 spheres xenografts

Fig 6 Stem-like U87 cells developed morphological feature of endothelial cells on Matrigel
3 讨论
上世纪70年代Fulkman[14]提出抑制肿瘤血管形成能够“饿死”肿瘤的理论。随后的研究证明,肿瘤的发生、发展及侵袭转移都离不开肿瘤血管的形成,干预肿瘤血管形成的环节或条件均可抑制肿瘤的生长,例如Bevacizumab(VEGF拮抗剂)在美国获批的适应症有结直肠癌、非小细胞肺癌、肾细胞癌、复发性成胶质细胞瘤等。2014年4月,FDA批准抗VEGFR2单抗ramucirumab上市,主要用于化疗失败的胃癌、胃食管连接处腺癌。apatinib(VEGFR2选择性抑制剂)即将被CFDA批准作为晚期胃癌的治疗药物。虽然这些靶向肿瘤血管的药物在临床上已经展现出较好的治疗作用,但仍然会出现肿瘤耐药、复发和转移,以及药物不良反应等情况[2, 15],具体原因可能与复杂的肿瘤血管调控机制有关。近年来,研究者们发现肿瘤干细胞与肿瘤血管新生有密切的联系,尤其是肿瘤干细胞能够通过转分化方式形成血管内皮细胞,直接参与肿瘤血管的形成[16]。因此在研发抗血管生成药物时,应该重视肿瘤干细胞在血管生成中的作用,通过选择性靶向肿瘤干细胞和肿瘤血管的关联性,从而达成治疗目的。
因此,有必要建立一种简单可靠的干细胞向内皮细胞转分化的模型。我们通过体外诱导获得干细胞样的U87细胞,然后接种在Matrigel上建立胶质瘤干细胞向内皮细胞转分化模型。实验结果发现干细胞样U87细胞在Matrigel上确实能形成血管状结构,内皮标志物基因CD31、CD34、vWF表达量也均上调,提示干细胞样U87细胞在该实验条件下可以转分化形成内皮细胞。干细胞样U87细胞成瘤性实验结果表明,干细胞样U87细胞在Nu/Nu鼠皮下能够形成肿瘤块,并且比普通的U87肿瘤生长的迅速;病理和免疫组化结果提示,干细胞样U87细胞形成的肿瘤组织中血管比普通U87的肿瘤中血管要丰富和密集。这一结果也能提示干细胞样U87细胞能够通过转分化形成血管内皮细胞,进而形成血管。
VEGFR2是转导VEGF血管新生信号的关键受体,对血管内皮细胞增殖、肿瘤的生长和转移都起着重要作用。VEGFR2在正常人体组织中呈低水平表达,而在血管内皮细胞和CD133阳性的胶质瘤干细胞中呈高表达[17],并且影响着胶质瘤干细胞向内皮细胞的转分化过程[18-19]。因此,选择性靶向VEGFR2或许可以产生很好的治疗前景。我们以抗VEGFR2人源化单克隆抗体为受试药物,发现抗VEGFR2人源化单抗能够明显抑制干细胞样U87细胞在Matrigel上形成血管状结构,并且下调内皮细胞相关基因CD31、CD34、vWF的表达。
综上所述,我们通过体外诱导获得干细胞样U87胶质瘤干细胞,该细胞能够在Matrigel上形成血管状结构、转化成内皮细胞,且抗VEGFR2单克隆抗体能够抑制胶质瘤干细胞向内皮细胞转分化。

Fig 7 Effect of anti-VEGFR2 human monoclonal antibody on trans-differentiation
A: Anti-VEGFR2 human monoclonal antibody inhibited the formation of capillary-like structures,A1:Control;A2:50 mg·L-1;A3:200 mg·L-1; B: Anti-VEGFR2 human monoclonal antibody decreased expression of CD31, CD34 and vWF.*P<0.05,**P<0.01vsControl
[1] Carmeliet P,Jain R K. Molecular mechanisms and clinical applications of angiogenesis [J].Nature,2011, 473(7347):298-307.
[2] Potente M, Gerhardt H, Carmeliet P. Basic and therapeutic aspects of angiogenesis [J].Cell, 2011, 146(6):873-87.
[3] Medema J P. Cancer stem cells: the challenges ahead[J].NatCellBiol,2013, 15(4): 338-44.
[4] Gupta P B,Chaffer C L,Weinberg R A. Cancer stem cells:mirage or reality [J]NatMed,2009, 15(9):1010-2.
[5] Misra R M,Bajaj M S,Kale V P. Vasculogenic mimicry of HT1080 tumour cellsinvivo: Critical role of HIF-1α-neuropilin-1 axis [J].PLoSOne,2012, 7(11):e50153.
[6] Ping Y F,Bian X W. Consice review: Contribution of cancer stem cells to neovascularization [J].StemCells,2011, 29(6):888-94.
[7] Wang R,Chadalavada K,Wilshire J, et al. Glioblastoma stem-like cells give rise to tumour endothelium [J].Nature,2010, 468(7325):829-33.
[8] Cheng L,Huang Z,Zhou W,et al. Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth [J].Cell,2013, 153(1):139-52.
[9] Bao S, Wu Q, Sathornsumetee S,et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor [J].CancerRes, 2006, 66(16):7843-8.
[10] Folkins C, Shaked Y, Man S, et al. Glioma tumor stem-like cells promote tumor angiogenesis and vasculogenesis via vascular endothelial growth factor and stromal-derived factor 1 [J].CancerRes, 2009, 69(18):7243-51.
[11] 贺路航,向橦,张艳玲,等. CD133+卵巢癌干细胞样细胞向血管内皮细胞分化的实验研究[J]. 第三军医大学学报, 2014, 36(5): 413-6.
[11] He L H, Xiang T, Zhang Y L, et al. CD133+ovarian cancer stem-like cells differentiate to vascular endothelial cells [J].JThirdMilMedUniv, 2014, 36(5): 413-6.
[12] Yao X H,Ping Y F,Chen J H, et al. Glioblastoma stem cells produce vascular endothelial growth factor by activation of a G-protein coupled formylpeptide receptor FPR [J].JPathol,2008, 215(4):369-76.
[13] 曾军英,胡 兴,伍贤进,等. 胰腺癌干细胞的分离培养及生物学特性鉴定[J]. 中国药理学通报, 2014, 30(4): 583-7.
[13] Zeng J Y, Hu X, Wu X J, et al. Isolation of cancer stem cells from pancreatic cancer cell line and identification of their biological characteristics[J].ChinPharmacolBull, 2014, 30(4): 583-7.
[14] Folkman J. Tumor angiogenesis: Therapeutic implications [J].NEnglJMed,1971, 285(21): 1182-6.
[15] 宣自学,袁守军,李晓雯. 靶向肿瘤血管形成的抗肿瘤作用及药物研究进展[J].中国新药杂志, 2014, 23(3):282-8.
[15] Xuan Z X, Yuan S J, Li X W. Research progresses in anti-tumor effects and drugs via inhibiting the tumor angiogenesis [J].ChinJNewDrugs, 23(3):282-8.
[16] Ricci-Vitiani L, Pallini R, Biffoni M, et al. Tumour vascularization via endothelial differentiation of glioblastoma stem-like cells [J].Nature, 2010, 468(7325):824-8.
[17] Claesson-Welsh L, Welsh M. VEGFA and tumour angiogenesis[J].JInternMed, 2013, 273(2):114-27.
[18] Hamerlik P,Lathia J D,Rasmussen R, et al. Autocrine VEGF-VEGFR2-neuropilin-1 signaling promotes glioma stem-like cell viability and tumor growth [J].JExpMed,2012, 209(3):507-20.
[19] Yao X, Ping Y, Liu Y,et al. Vascular endothelial growth factor receptor 2 (VEGFR-2) plays a key role in vasculogenic mimicry formation, neovascularization and tumor initiation by glioma stem-like cells [J].PLoSOne,2013, 8(3):e57188.
Stem cell-like U87 cells trans-differentiating into endothelial cells and inhibition of anti-VEGFR2 human monoclonal antibody
XUAN Zi-xue1,2, ZHANG Qi2, LI Lin-na2, YUAN Ye3, XU Cheng-wang2,YANG De-xuan2, WANG Shan-shan2, YUAN Shou-jun2
(1.DeptofPharmacy,ZhejiangProvincialPeople’sHospital,Hangzhou310014,China; 2.DeptofPharmacologyandToxicology,BeijingInstituteofRadiationMedicine,AcademyofMilitaryMedicalSciences,Beijing100850,China;3.ShandongBuchangShenzhouPharmaceuticalCo.Ltd.,HezeShandong274000,China)
Aim To establish the trans-differentiation model of stem cell-like U87 glioma cells into endothelial cells, and evaluate the effect of anti-VEGFR2 human monoclonal antibody on this process. Methods To obtain stem-like cells from U87 cell line, U87 tumor spheres were inducedinvitro, then they were identified by FACS and qPCR, and the tumorigenicity, tumor growth and CD31 vascular density were also detected. Finally, we established the trans-differentiation model to evaluate the effect of anti-VEGFR2 fully human monoclonal antibody. Results Big tumorspheres were formed successfully, an obvious increase of the CD133+ cells was showed by FACS analysis, and the up-regulation of CD133, Nestin and VEGFR2 was further revealed by qPCR assay. Additionally, tumors from stem-like U87 cells grew faster, and the blood vessels increased obviously. When stem-like U87 cells were grown on Matrigel, many tubular networks were observed, and the expression of CD31, CD34 and vWF was significantly increased. Once treated with anti-VEGFR2 human monoclonal antibody, the formation of capillary-like structures was impaired, accompanied by the decrease of CD31, CD34 and vWF. Conclusions The trans-differentiation models of stem-like U87 cells into endothelial cells on matrigel were successfully established; anti-VEGFR2 human monoclonal antibody could inhibit the trans-differentiation of tumor stem cells.
stem cell-like U87 cells; Matrigel; endothelial cells; trans-differentiation; VEGFR2; capillary-like structures
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.010.html
2014-11-29,
2014-12-30
国家科技重大专项-综合性新药研究开发技术大平台资助项目(No 2012ZX09301003-001)
宣自学(1988-),男,药剂师,硕士生,研究方向:肿瘤药理。Tel:010-66931215, E-mail: xuanzixue0222@163.com; 袁守军(1962-),男,教授,硕士/博士生导师,研究方向:肿瘤药理与药物毒理,通讯作者,Tel:010-66930271,E-mail: yuansj@nic.bmi.ac.cn
10.3969/j.issn.1001-1978.2015.03.010
A
1001-1978(2015)03-0339-07
R322.12;R329.24;R392.11;R392.12;R730.264