高糖对大鼠血管平滑肌细胞表型转化的影响及其机制*
2015-06-09楚海荣刘建华李文凭
张 静, 楚海荣, 郭 英, 刘建华, 李文凭, 李 宏, 成 敏△
(1. 潍坊医学院临床学院, 2. 潍坊医学院医学研究实验中心, 山东潍坊 261053)
高糖对大鼠血管平滑肌细胞表型转化的影响及其机制*
张 静1, 楚海荣2+, 郭 英1, 刘建华2, 李文凭1, 李 宏2, 成 敏2△
(1. 潍坊医学院临床学院, 2. 潍坊医学院医学研究实验中心, 山东潍坊 261053)
目的:探讨高糖对大鼠血管平滑肌细胞( VSMCs)表型转化的影响及机制。方法:大鼠VSMCs由组织贴壁法培养获得,以3~5代细胞为靶细胞,待细胞融合后用含有2%胎牛血清的DMEM孵育12 h,再置于正常组(5.5 mmol/L glucose)、高糖(25 mmol/L glucose)、高糖+P38抑制剂SB203580的DMEM继续培养24 h。用实时荧光定量RT-PCR分析各组VSMCs合成型标志蛋白OPN、收缩型标志蛋白α-SMA及基质金属蛋白酶MMP-2、MMP-9的基因表达情况;Western blot检测各组OPN、α-SMA和磷酸化P38的蛋白表达情况。结果:①高糖促进了VSMCs的表型由收缩型转化为合成型,同时上调基质金属蛋白酶MMP-2和MMP-9的表达;②高糖能促进P38蛋白的磷酸化,增加磷酸化P38的蛋白表达量;③P38/MAPK信号通路抑制剂SB203580明显抑制了高糖促进VSMCs表型转化及MMP-2、MMP-9表达的效应。结论:高糖能通过P38/MAPK信号通路促进VSMCs的表型转化。
大鼠,平滑肌细胞,高糖,表型转化,P38/MAPK信号通路
糖尿病心脑血管并发症是影响人体生命健康的主要原因。研究显示,血管平滑肌细胞(vascular smooth muscle cells,VSMCs)具有收缩型和合成型两种表型,其表型由收缩型向合成型转化是一系列心脑血管并发症(血管狭窄后重构和动脉粥样硬化)发生发展的关键性起始步骤,且合成型的平滑肌细胞能促进细胞的增殖和迁移、调节细胞外基质的分泌[1]。研究已证实,高糖作为糖尿病心血管并发症
的独立危险因素,可以促进平滑肌细胞的增殖和迁移[2,3],但目前有关高糖对平滑肌细胞表型转化的影响及报道甚少。本研究旨在探讨高糖对血管平滑肌细胞表型转化的影响其可能机制,为临床糖尿病心血管并发症的防治提供依据。
1 材料与方法
1.1 材料
DMEM高糖型和正常型培养基(HyClone公司,美国);胰蛋白酶(HyClone公司,美国);胎牛血清(HyClone公司,美国);OPN抗体、α-SMA抗体(北京博奥森生物技术有限公司);磷酸化的P38单克隆抗体(cell signaling公司);HRP-山羊抗兔抗体(北京中杉金桥生物有限公司);小鼠抗β-actin抗体(北京中杉金桥生物有限公司);HRP-山羊抗小鼠抗体(碧云天生物技术研究所);BCA蛋白浓度试剂盒(Thermo scientific公司);5% CO2培养箱(Thermo,美国);TRIzol(Invitrogen公司);荧光定量PCR仪( Bio-RadIQ5),SYBR PrimeScriptaRT-PCR Kit II 及相关引物设计合成( 大连宝生物公司)。
1.2 方法
1.2.1 大鼠胸主动脉VSMCs的分离、培养和鉴定 按照本室以往的方法[4]:将颈椎脱臼处死的大鼠于75%的酒精中浸泡15 min。纵向剪开无菌分离的大鼠胸主动脉管腔并去除内膜。移入超净台内盛有20%DMEM的无菌器皿中剪成2 mm×5 mm小块,用吸管移入含4 ml培养液的25 ml细胞培养瓶中,让细胞分散粘贴在培养瓶壁上,倒放。在5%CO2、37℃的培养箱中静置培养4~6 h后轻轻翻转培养瓶,让培养液缓慢没过组织块,继续静置培养。待细胞生长到80%左右时,用0.25%胰蛋白酶1∶1传代。在倒置显微镜下观察培养的细胞并拍照,用特异性α平滑肌肌动蛋白(alpha smooth-actin,α-SMA)进行免疫荧光染色。
1.2.2 实验分组 将处于对数生长期3~5代的平滑肌细胞按4×105cells/ml的密度接种于6孔板中,待细胞密度达90%时,用含2%胎牛血清的正常DMEM同步化12 h后,分组如下:(1)正常组(5.5 mmol/L glucose);(2)高糖组(25 mmol/L glucose);(3)高糖+P38抑制剂SB203580组。
1.2.3 荧光定量RT-PCR检测OPN、α-SMA和基质金属蛋白酶MMP-2、MMP-9基因的表达 按TRIzol试剂说明书提取总RNA,溶于DEPC水中,-80℃保存备用。SYBRGreen荧光定量RT-PCR检测各组OPN、α-SMA、MMP-2和MMP-9的基因表达量。相关基因引物由大连宝生物设计合成,其序列如表1所示。实验中阴性对照为超纯水(无RNA酶,PCR级),内参为管家基因GAPDH。按2-ΔΔCt计算各组的扩增效率。
Tab. 1 Oligonucleotide primers used for reverse transcription-polymerase chain reaction

GenesSequencesofprimersOPNForwardprime:5'-GCATCCTTGGCTTTG-CAGTC-3'Reverseprime:5'-TGGCTACAGCATCTGAGT-GTTTG-3'α-SMAForwardprime:5'-AGCCAGTCGCCATCAG-GAAC-3'Reverseime:5'-CCGGAGCCATTGTCACACAC-3'MMP-2Forwardprime:5'-TCCCGAGATCTGCAAG-CAAG-3'Reverseprime:5'-AGAATGTGGCCACCAG-CAAG-3'MMP-9Forwardprime:5'-AGCCGGGAACGTATCTG-GA-3'Reverseprime:5'-TGGAAACTCACACGC-CAGAAG-3'GAPDHForwardprime:5'-GGCACAGTCAAGGCT-GAGAATG-3'Reverserime:5'-ATGGTGGTGAAGACGCCAG-TA-3'
1.2.4 Western blot检测磷酸化P38、OPN和α-SMA的蛋白表达 按照蛋白提取试剂说明书提取细胞蛋白,在4℃ 12 000 r/min条件下离心5 min,抽取上清,放置于-80℃冰箱保存备用。将蛋白上清与SDS-PAGE上样缓冲液按比例充分混匀,100℃恒温水浴锅中加热5 min后于-20℃冰箱保存。于12%聚丙烯酰胺凝胶中上样(50 μg/well)进行还原性SDS PAGE电泳约3.5 h,转膜(PVDF膜)用湿转法,200 mA恒流50 min。用5%的BSA封闭1 h,在4℃孵育一抗(P-P38 1∶1 000,OPN 1∶300, α-SMA 1∶400)过夜,用TBST震荡洗涤5×10 min/count,在室温条件下孵育二抗山羊抗兔抗体(1∶5 000)1 h, 用TBST震荡洗涤5×10 min,用ECL发光试剂在暗室中显色,结果用图像分析软件Gel-Pro analyzer对目的条带进行扫描和密度分析。
1.3 统计学分析
2 结果
2.1 VSMCs的分离、培养和鉴定
原代细胞培养4~7 d, 有细胞以组织块为中心呈放射状萌出。细胞向外生长形成细胞晕,进而形成细胞簇。胞体呈长梭形、三角形或不规则形,有多个突起,长短不一,胞核呈卵圆形居中,有多个核仁。原代细胞体积小,折光性强;传代后的细胞体积增大,折光性减弱,呈典型的“峰-谷”状生长。α-SMA免疫荧光染色阳性。
2.2 高糖对VSMCs表型转化的影响
在高糖状态下,VSMCs合成型标志蛋白OPN的基因表达量明显升高,为正常组的(2.84±0.19)倍;而收缩型标志蛋白α-SMA的基因表达量下降,为正常组的(0.62±0.09)倍,表明高糖促进了VSMCs由收缩型向合成型转化(图1)。
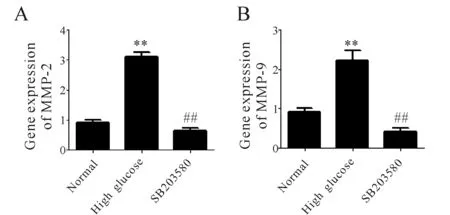
2.3 高糖对平滑肌细胞基质金属蛋白酶-2和基质金属蛋白酶-9基因表达的影响
基质金属蛋白酶MMP-2和MMP-9在高糖组的基因表达量分别为(0.244±3.118)、(0.442±2.221)较正常组 (0.163±0.899)、 (0.171±0.912)明显升高(P<0.01)。SB203580组的基质金属蛋白酶MMP-2和MMP-9的基因表达量分别为(0.148±0.423)、(0.147±0.628)均较高糖组(0.442±2.221)、(0.244±3.118)明显降低(P<0.01,图2)。

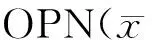
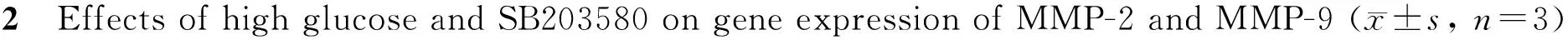
2.4 高糖对VSMCs磷酸化P38蛋白表达的影响
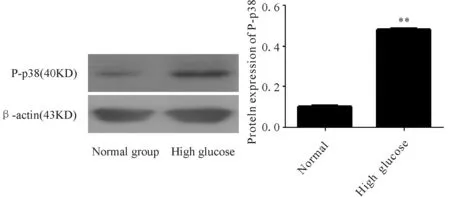
与正常组相比,正常组磷酸化P38的蛋白表达量较少(0.103±0.003),高糖处理明显增加了磷酸化P38的蛋白表达量(0.477±0.013 )(P<0.01,图3)。
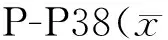
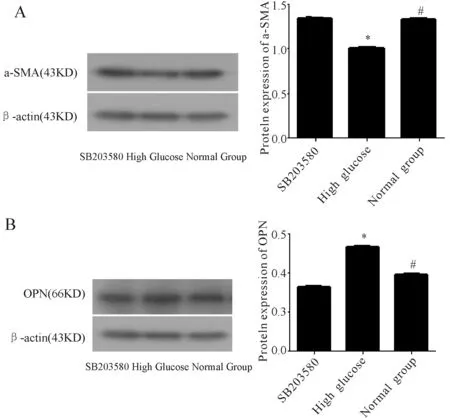
2.5 P38/MAPK信号通路抑制剂SB203580对VSMCs表型转化的影响
基因结果显示:P38/MAPK信号通路抑制剂SB203580抑制了高糖对VSMCs表型转化的影响,蛋白结果进一步证实:合成型标志蛋白OPN的表达量下降而收缩型标志蛋白α-SMA的表达量升高(P<0.05,图4)。

3 讨论
在糖尿病患者中,心血管并发症是危害人体健康的主要疾病。长期的高血糖除了引起内皮损伤、血小板黏附、导致血栓形成外,同时炎性细胞向受损内皮处聚集并释放大量炎性因子,刺激内膜平滑肌细胞增殖,促进动脉粥样硬化的发生[5]。VSMCs是组成血管壁的主要细胞,具有收缩型(分化型)和合成型(去分化型)两种表型。在健康血管中,VSMCs位于血管壁的中膜,处于分化状态。当血管内皮细胞受损或受其他因素刺激时,处于分化状态的VSMCs会返回去分化状态,并获得增殖和迁移等能力。VSMCs的表型转化在心血管疾病如动脉粥样硬化、高血压、哮喘和血管动脉瘤中发挥着至关重要的作用。揭伟等的研究表明,高糖能上调大鼠主动脉平滑肌细胞骨桥蛋白表达[6]。在本实验中,高糖能促进VSMCs表型由收缩型转变为合成型,即收缩型标志分子α-SMA的基因和蛋白表达降低,而合成型标志分子OPN的基因和蛋白表达增加。与此同时,合成型的VSMCs表达基质金属蛋白酶MMP-2和MMP-9的水平也明显增高。此外,基质金属蛋白酶MMP-2和MMP-9的表达能促进VSMCs由血管壁的中膜向内膜下迁移,促进血管形成新生内膜,从而加速了动脉粥样硬化的形成[7]。
研究显示,多条信号通路参与了VSMCs表型转化的调节,其中蛋白质的磷酸化是其改变基因表达的直接方式[8]。P38/MAPK是参与细胞内炎症反应的重要信号通路,可被多种细胞外刺激激活由非磷酸化状态转变为磷酸化状态, 通过促进下游底物的磷酸化实现对细胞生长、增殖、分化和某些因子表达的调控[9,10]。李艳波等的研究表明,高糖可激活P38/MAPK信号通路,促使细胞产生单核细胞趋化因子MCP-1、环氧化酶COX-2、G蛋白偶联趋化因子受体CXCR3等,进而促进动脉粥样硬化的形成[11,12]。在本实验中,高糖促进了VSMCs由收缩型转化为合成型,同时高糖组磷酸化的P38蛋白表达量明显增加。然而,当用SB203580特异性的抑制P38/MAPK信号通路后,VSMCs的表型转化受到抑制,同时其分泌的MMP-2和MMP-9也明显减少,说明P38/MAPK信号通路介导了高糖诱导的平滑肌细胞的表型转化。
总之,高糖可通过P38/MAPK信号通路促进VSMCs发生表型转化,增加MMP-2和MMP-9的分泌,增强其对基底膜的降解能力,促进动脉粥样硬化的形成。本结果完善了糖尿病患者高发心血管疾病的机制,为临床糖尿病心血管并发症的防治提供了理论依据。
[1] 李 琦, 温进坤, 郑 斌. 血管平滑肌细胞表型调节机制的研究进展[J]. 生理科学进展, 2003, 34(1): 27-31.
[2] Lin YC, Chen LH, Varadharajan T,etal. Resveratrol inhibits glucose-induced migration of vascular smooth muscle cells mediated by focal adhesion kinase [J].MolNutrFoodRes, 2014, 58(7): 389-401.
[3] 路 艳, 张春艳, 王聪霞, 等. 高糖对MMP-2与TIMP-2的表达及血管平滑肌细胞增殖的影响[J]. 西安交通大学学报(医学版), 2012, 33(3): 312-315.
[4] 吴海燕, 楚海荣, 李 宏, 等. 内皮祖细胞条件培养基对VSMCs增殖、迁移及粘附功能的影响[J]. 中国应用生理学杂志, 2013, 29(3): 199-202.
[5] 周学凯, 倪旭东, 李 飞, 等. 高糖对成人外周血平滑肌祖细胞功能的影响[J]. 岭南心血管病杂志, 2011, 4(17): 311-315.
[6] 揭 伟, 罗泊涛, 姜汉国, 等. 高糖上调大鼠主动脉平滑肌细胞骨桥蛋白表达[J]. 基础医学与临床, 2010, 30(8): 852-856.
[7] Guo J, Dhaliwall JK, Chan KK,etal. In vivo effect of insulin to decrease matrix metalloproteinase-2 and -9activity after arterial injury [J].JVascRes, 2013, 50(4): 279-288.
[8] Sobue K, Hayashi K, Nishida W.Molecular mechanism of phenotypic modulation of smooth muscle cells [J].HormRes, 1998, 50(Suppl 2): 15-24.
[9] Lee MH, Kwon BJ, Seo HJ,etal. Resveratrol Inhibits Phenotype Modulation by Platelet Derived Growth Factor-bb in Rat Aortic Smooth Muscle Cells [J].OxiMedCellLongev, 2014, 2014: 572430.
[10]Lee JC, Young PR. Role of CSB/ P38/ RK stress response kinasein LPS and cytokine signaling mechanisms [J].JLeukocBiol, 1996, 59(2): 152-157.
[11]李艳波, 邓华聪, 郑 丹, 等. P38 信号通路对人脐静脉内皮细胞单核细胞趋化蛋白-1 表达的影响[J]. 中华糖尿病杂志, 2004, 12(4): 287-289.
[12]李艳波, 李为民, 韩君勇. P38信号通路在人脐静脉内皮细胞表达环氧化酶-2中的作用[J]. 医学研究生学报, 2005, 18(6): 490-492.
The effects and mechanisms of high glucose on the phenotype transformation of rat vascular smooth muscle cells
ZHANG Jing1, CHU Hai-rong2+, GUO Ying1, LIU Jian-hua2, LI Wen-ping1, LI Hong2, CHENG Min2△
(1. Clicinal College, Weifang Medical University, 2. Medicine Research Center, Weifang Medical University, Weifang 261053, China)
Objective: To investigate the effects and mechanisms of high glucose on the phenotype transformation of rat vascular smooth muscle cells (VSMCs). Methods: VSMCs were isolated from rat thoracic aorta and the 3rd~5thVSMCs were incubated with normal glucose (5.5 mmol/L), high glucose (25 mmol/L), or high glucose (25 mmol/L) +P38 inhibitor(25 mmol/L+SB203580) for another 24 hours.Then the gene expression of osteopontin(OPN), alpha smooth-actin(α-SMA),matrix metalloproteinase-2 (MMP-2) and matrix metalloproteinase-9(MMP-9) were assayed by real time RT-PCR, the protein expression of P38 were assayed by Western blot. Results: ①High glucose promoted the phenotype transformation of VSMCs and up-regulated the expression of MMP-2 and MMP-9. ②High glucose promoted the phosphorylation of P38. ③SB203580, the inhibitor of P38/MAPK signal pathway, inhibited the effects of high glucose on phenotype transformation and expression of MMP-2 and MMP-9. Conclusion: High glucose may promote phenotype transformation of VSMCs via the signal pathway of P38/MAPK.
rat; vascular smooth muscle cells; high glucose; phenotype transformation; P38/MAPK
国家自然科学基金资助项目(30900290,31270993);国家教育部“新世纪优秀人才计划”资助项目(NCET10-0922);山东省自然科学基金(ZR2013CQ032);山东省高等学校科技计划项目(J11LF17);山东省中医药科技发展计划项目(2013-239)
2015-01-26 【修回日期】2015-06-09
R331.3
A
1000-6834(2015)05-458-04
10.13459/j.cnki.cjap.2015.05.019
△【通讯作者】Tel: 0536-8462463; E-mail: chengmin1976@wfmc.edu.cn;+: 共同第一作者
