不同压力氧气对大鼠潜水减压病的预防作用*
2015-06-09王芳芳方以群包晓辰
王芳芳, 方以群, 攸 璞, 包晓辰, 马 骏, 张 师
(海军医学研究所, 上海 200433)
不同压力氧气对大鼠潜水减压病的预防作用*
王芳芳, 方以群△, 攸 璞, 包晓辰, 马 骏, 张 师
(海军医学研究所, 上海 200433)
目的:研究不同压力氧气对大鼠减压病的预防作用。方法:40只雄性SD大鼠,随机分为减压病组、1 ATA预吸氧组、2 ATA预吸氧组、3 ATA预吸氧组。减压病组置于脱险舱内,以“压缩空气3 min内匀速加压至0.7 MPa,停留60 min后,3 min内匀速减压”方案处理后出舱。预吸氧组分别于进舱前吸不同压力的氧20 min后再按上述方案加减压出舱。出舱后30 min内观测大鼠死亡率、行为学改变;取大鼠肺组织,测其干湿重比、支气管肺泡灌洗液蛋白量以及肿瘤坏死因子(TNF-α)表达含量变化。结果:和减压病组比较,预吸氧对减压病的死亡率及发病率无明显影响。但1 ATA预吸氧组大鼠支气管肺泡灌洗液蛋白量和炎症因子TNF-α值下降明显,肺干湿重比升高明显(P<0.05)。结论:预吸氧对减压病的死亡率及发病率无明显改善,但是常压吸氧可减轻存活大鼠肺泡灌洗液中蛋白渗透、降低肺组织中炎症因子的表达。
预吸氧;减压病;炎症因子;大鼠
当机体所处的环境压力发生突然的、急剧的变化时(例如潜艇脱险、水下或航空作业)容易引起减压病。减压病严重威胁潜水员的健康,主要表现的症状有皮疹、关节及四肢的疼痛、中枢神经系统紊乱、呼吸困难、偏瘫等。目前常规的减压程序无法完全避免减压病的发生,如何采取有效措施预防减压病的发生成为援潜救生研究的重点。
有研究发现,正常情况下体内组织中存在着气核,在减压过程中,这些气核可逐渐增大并形成气泡,导致减压病的发生[1]。理论上认为,在高压或者常压下呼吸纯氧,增加体内的氧含量,可减少气核的产生。增加的氧气可以快速扩散到气核中,置换其中的氮气,氮气快速弥散出气核,被集体排出体外。同时气核中的氧气可以被线粒体代谢,导致气核的快速降解[2,3]。以往国外文献中有采用预吸氧预防减压病发生的相关研究,因此我们采用不同压力下预吸纯氧干预减压病大鼠模型的方法,研究其对潜水减压病的影响,为进一步寻找预防减压病发生的有效措施提供依据。
1 材料与方法
1.1 实验动物及分组
40只健康雄性SD大鼠,体重280~320 g,海军医学研究所动物中心饲养。观察和检疫一周正常后进行实验。动物随机分为4组(n=10):分别是减压病(DCS)组、1 ATA预吸氧组、2 ATA预吸氧组、3 ATA预吸氧组。
1.2 主要仪器及试剂
动物高压氧舱(定制,上海701研究所杨园医用氧舱厂),动物脱险舱(定制,烟台宏远氧业有限公司),医用氧气(上海市江南气体公司),钠石灰(上海五四化工厂),BCA蛋白试剂盒(购自pierce公司),检测肿瘤坏死因子(tumor necrosis factor,TNF-α)的ELISA试剂盒(eBioscience,美国),自制11通道转笼。
1.3 减压病动物模型的建立及处理
采用前期实验确定的减压病动物模型,采用“压缩空气3 min内匀速加压至0.7 MPa,停留60 min后,3 min内匀速减压”后出舱方案。减压病组大鼠直接置于动物脱险舱内加减压出舱;预吸氧组分别于进舱前吸不同压力的氧20 min后再按上述方案加减压出舱。四组大鼠减压出舱后均放入转笼中观察其发生减压病的症状,评价指标包括:行走困难、不正常的呼吸、前/后肢瘫痪及死亡,统计死亡率。观察30 min后取各组大鼠的肺组织,进行相关指标检测。
1.4 肺组织干湿重比
每组取5只大鼠,分别取右下肺组织,先称取各个肺组织的湿重。然后置于80℃烤箱中烘烤48 h后称取干重,计算干/湿重的比例。
1.5 支气管肺泡灌洗液蛋白含量测定
每组取5只大鼠,采用戊巴比妥钠麻醉后(100 mg/kg,腹腔注射),逐层剪开皮肤,分离主支气管,剪T型切口。5 ml注射器抽取5 ml预冷的PBS,插入主支气管,结扎固定后,反复抽吸五次,回收率达到60%以上。收获的支气管肺泡灌洗液 1 000 g。4℃离心10 min后,收集上清储存在-70℃冰箱。灌洗液蛋白测定按照Pierce BCA蛋白试剂盒说明书操作。
1.6 肺组织TNF-α的含量测定
每组取5只大鼠,采用戊巴比妥钠麻醉后(100 mg/kg,腹腔注射),迅速取出左侧肺组织,用预冷的生理盐水冲洗,滤纸吸干后称重,按比例(1 ml/100 mg肺组织)加入预冷的匀浆液,冰浴中匀浆3 min,4℃下15 000 r/min离心10 min,取上清液置于-70℃冰箱中保存待测。采用ELISA双抗夹心法严格按照试剂盒说明操作,检测上清液中TNF-α的含量;并采用考马斯亮蓝蛋白测定法严格按照试剂盒说明操作,检测上清液中蛋白含量;最后换算出每毫克蛋白中细胞因子TNF-α含量(pg/mg)。
1.7 统计学方法
2 结 果
2.1 不同压力氧气预吸对减压病大鼠模型的影响
通过不同压力预吸氧组与减压病组的死亡率的统计结果发现虽然死亡率有所下降,但是差异无统计学意义,表明1 ATA、2 ATA、3 ATA氧气预吸对常规潜水减压病的死亡率无明显影响(表1)。
Tab. 1 Effect of different pressure oxygen pre-breathe on mortality rate of diving decompression sickness rats

GroupAmountofratsAmountofdeathMortalityrateDCS10770%1ATA10770%2ATA10660%3ATA10660%
DCS: Decompression sickness group; ATA: Absolute atmosphere
2.2 肺组织干湿重比
减压病(decompression sickness, DCS)组干湿重比0.194±0.023,1 ATA组为0.215±0.014,2 ATA组为0.188±0.025,3 ATA组为0.199±0.024,与减压病组比较,1 ATA组大鼠肺干湿重比明显升高(P<0.05),而2 ATA组和3 ATA组差异不明显(图2)。
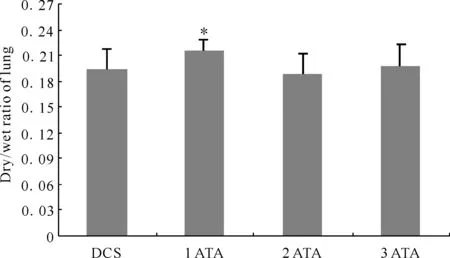
Fig. 2 Dry/wet ratio of lung DCS: Decompression sickness group; ATA: Absolute atmosphere*P<0.05vsDCS group
2.3 支气管肺泡灌洗液蛋白量
减压病组肺泡灌洗液蛋白量(671.33±73.36)pg/ml,1 ATA组为(262.33±59.86) pg/ml,2 ATA组(728.88±34.76) pg/ml,3 ATA组(654.50±41.25) pg/ml,相对于减压病组,1 ATA组大鼠支气管肺泡灌洗液蛋白量下降明显(P<0.05,图3)。
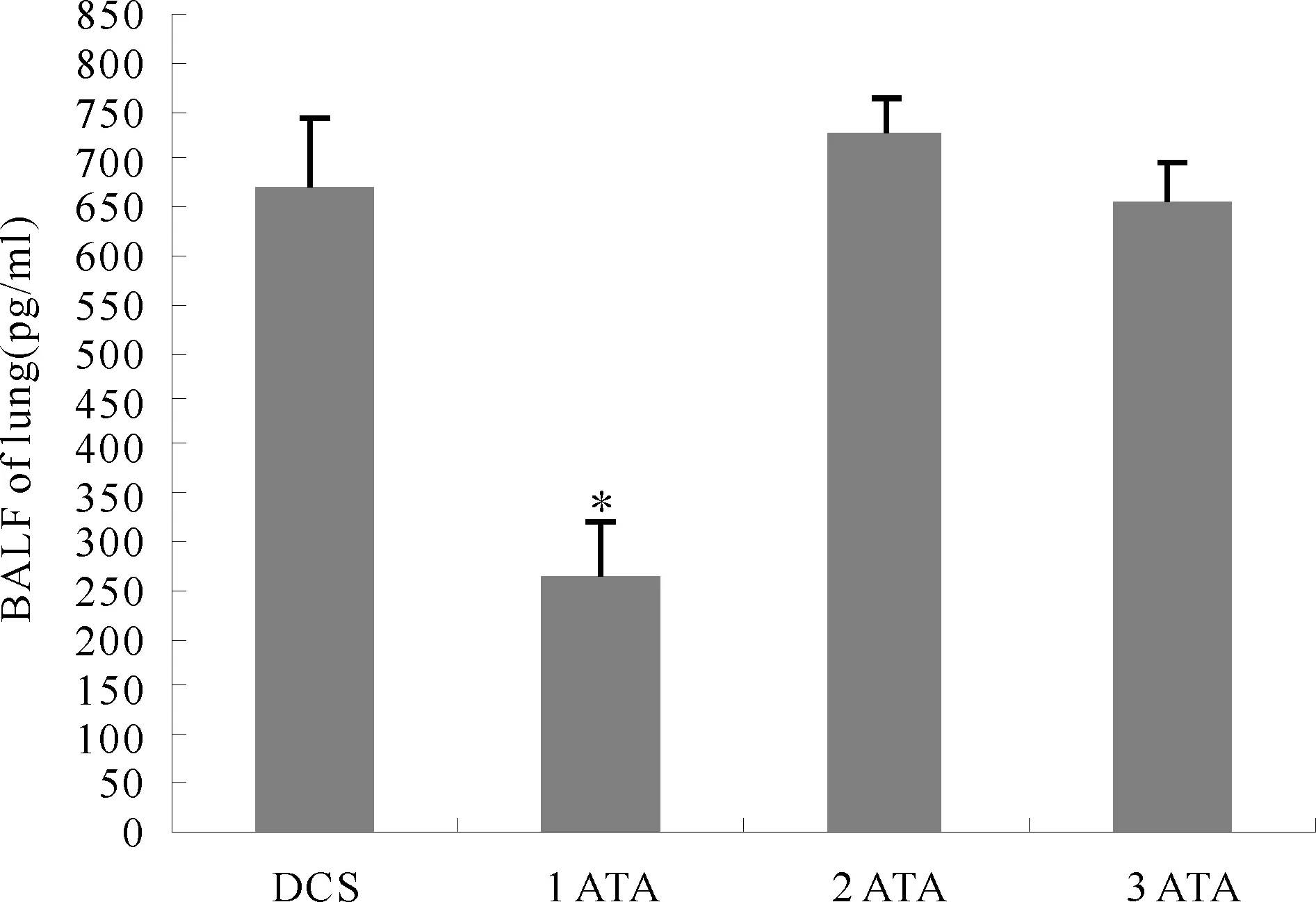
Fig. 3 Protein levels in the bronchoalveolar lavage fluid of lung DCS:Decompression sickness group; ATA: Absolute atmosphere; BALF: Bronchoalveolar lavage fluid*P<0.05vsDCS group
2.4 肺组织TNF-α的含量
减压病组肺组织TNF-α的含量为(87.99±59.40)pg/mg,1 ATA组为(38.07±6.45)pg/mg,2 ATA组为(78.49±87.27)pg/mg,3 ATA组为(65.49±43.27)pg/mg。相对于减压病组,1 ATA组TNF-α值下降明显(P<0.05,图4)。
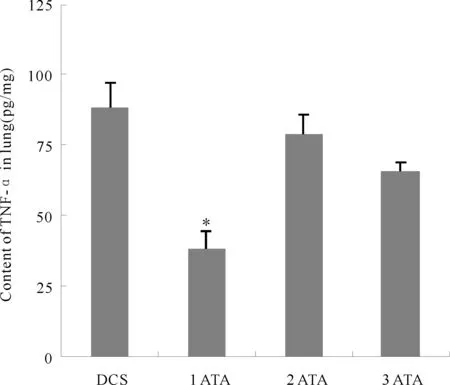
Fig. 4 Content of tumor necrosis factor TNF-α in the lung tissue DCS:Decompression sickness group; ATA: Absolute atmosphere; TNF-α: Tumor necrosis factor-α*P<0.05vsDCS group
3 讨 论
高压氧是治疗减压病的重要手段,也是预防高原和航空减压病的主要措施。在高气压暴露前吸氧,可以通过排氮效应降低暴露后发生氮气过饱和的可能。在快速减压前吸氧,可以降低发生减压病的可能性和严重性。但是这种吸氧预防减压病的方法需要在吸氧后即刻进行,否则随着间隔时间的延长,体内含氮量又会逐渐恢复至吸氧前水平,从而达不到排氮目的[4]。目前有多篇文献证实吸氧压力、吸氧时间和再加压的间隔时间都是影响减压病发生率的重要因素。如Arieli等[5]发现吸入0.30 MPa的纯氧20 min后,在常压下间隔2 h后再加压,发生减压病的比例进一步升高,为70%~90%,这可能和体内潜在的气核激活有关。而常压下呼吸纯氧20 min后再间隔2 h暴露于加压环境下,减压病的发生率是下降的,为43%,但间隔6、24 h后预吸氧的保护作用不明显,可能的机制是体内的气核恢复。Bosco等[6]发现,在潜水前常压下吸氧20 min可显著降低潜水员体内气泡数量的产生,同时减轻血小板活化。
近年发现,数小时前的高压氧暴露可对抗很多器官的缺血再灌注损伤,而此时高压氧的直接理化作用(如氧容量的增加)已不存在[7]。目前认为不安全减压产生的气泡是导致减压病发生的主要原因[8]。在气泡的致病过程中,血小板、白细胞、内皮细胞之间在炎性因子等的介导下发生了一系列的交互作用,使得减压病发生的严重程度远远大于气泡的机械致病作用[9]。
气泡造成的血管内皮组织缺血缺氧及随后的再灌注损伤,可激活血管内皮细胞,上调粘附分子表达[10],促进炎症介质释放。TNF-α主要是由活化的巨噬细胞产生的炎性介质,在各种炎性病理变化中起重要作用。由于血管内皮细胞损伤,因而使单核巨噬细胞分泌TNF-α增多,导致炎症反应增强,血气屏障破坏,血管内皮细胞通透性增加,造成组织充血水肿、渗出增加。而肺组织是减压病的靶器官,是静脉气泡的早期过滤器,因为压力比体循环中低,因此更容易在减压过程中形成气泡。所以在本实验中通过测定大鼠肺组织中TNF-α含量和肺泡灌洗液蛋白量发现,相对于减压病组,预吸氧1 ATA组TNF-α值和肺泡灌洗液蛋白量下降明显,提示我们常压吸氧可以通过降低存活大鼠肺泡灌洗液的蛋白渗透性及降低肺组织炎性表达,从而减轻肺组织损伤,减缓存活大鼠发病症状,促进其恢复。而高压下预吸纯氧容易并发肺型氧中毒的发生,可能对肺组织产生影响。
综上所述,尽管目前仍受到吸氧设备的限制,不能实现吸氧和加压间即刻转换,可能会对大鼠减压病的发生产生影响,或导致吸氧无效。但是实验结果证明常压吸氧比高压吸氧更能够降低存活大鼠肺泡灌洗液的蛋白渗透性及肺组织炎性表达,从而减轻肺组织损伤。对于存活大鼠的减压病症状恢复是非常有益的,在紧急情况下可以作为一种辅助手段用于减压病的预防。
[1] Tikuisis P, Gerth WA. Physiology and Medicine of Diving(5th ed.)[M].Edinburgh:Saunders, 2003: 419-454.
[2] Arieli Y, Afieli R, Marx A. Hyperbaric oxygen may reduce gas bubbles in decompressed prawns by eliminating gas nuclei[J].JApplPhysiol, 2002, 92(6): 2596-2599.
[3] 包晓辰, 方以群, 攸 璞, 等. 减压病预防措施研究进展[J]. 中华航海医学与高气压医学杂志, 2013, 20(1): 63-65.
[4] Foster PP, Butler BD. Decompression to altitude: assuniptions, experimental evidence,and future directions[J].JApplPhysiol, 2009, 106(2): 678-690.
[5] Arieli R, Boaron E, Arieli Y,etal. Oxygen pretreatment as protection against decompression sickness in rats:pressure and time necessary for hypothesized denucleation and renucleation[J].EurJApplPhysiol, 2011, 111(6): 997-1005.
[6] Bosco G, Yang ZJ, Di Tano G,etal. Effect of in-water oxygen prebreathing at different depths on decom-pression-induced bubble formation and platelet ctivation[J].JApplPhysiol, 2010, 108(5): 1077-1083.
[7] Hodges AN, Delaney S, Lecomte JM,etal. Effect of hyperbaric oxygen on oxygen uptake and measurements in the blood and tissues in a normobarie environment[J].BrJSportsMed, 2003, 37(6): 516-520.
[8] Vann RD, Burler FK, Mitchell SJ,etal. Decompression illness [J].Lancet, 2011, 377(9760): 153-164.
[9] Levett DZ, Millar II. Bubble trouble: a review of diving physiology and disease[J].PostgradMedJ, 2008, 84(997): 571-578.
[10]包晓辰, 方以群, 马 骏, 等. 急性减压病大鼠肺组织粘附分子的变化[J]. 中国应用生理学杂志, 2012, 28(4): 369-372.
Effect of different pressure oxygen pre-breathe in diving decompression sickness of rats
WANG Fang-fang, FANG Yi-qun△, YOU Pu, BAO Xiao-chen, MA Jun, ZHANG Shi
(Naval Medical Research Institute, Shanghai 200433, China)
Objective: To investigate the effect of different pressure oxygen pre-breathing in preventing decompression sickness of rats. Methods: Forty male SD rats were randomly divided into 4 groups: decompression sickness (DCS) group and three oxygen pre-breathing groups with 1 ATA, 2 ATA and 3 ATA pressure respectively. The rats of DCS group were placed in the hyperbaric chamber and the chamber was compressed evenly within 3 minutes to depths of 7 absolute atmosphere(ATA) and held at the designated depth for 60 min, then decompressed (3 min) at constant speed to the surface pressure. After that, the rats were taken out for further detection. While the rats of oxygen pretreatment groups pre-breathed different pressure oxygen for 20 min before entering into chamber. The mortality and behavioral of rats were observed with 30 min post decompression. The dry/wet ratio of the lung, protein levels in the bronchoalveolar lavage fluid (BALF), and the inflammatory cytokine tumor necrosis factor (TNF-α) expression were also tested. Results: Compared with that of the DCS group, the mortality and morbidity of oxygen pre-breathe groups didn’t change obviously. But the total BALF protein level and the inflammatory cytokine TNF-α expression of 1 ATA oxygen pre-breathe group were obviously decreased, while the dry/wet ratio of lung as obviously increased instead(P<0.05). Conclusion: Although preoxygenation can’t obviously change the mortality and mobidity of rats, normal pressure oxygen pre-breathing can mitigate the protein infiltration in BALF and the expression of inflammatory cytokine in lung tissue.
oxygen pre-breathe; decompression sickness; inflammatory cytokine; rat
海军后勤部科研基金项目(12A106);总后十二五重点科研课题(BWS11J053,BHJ12J003)
2014-12-09 【修回日期】2015-02-10
R73-3
A
1000-6834(2015)05-401-04
10.13459/j.cnki.cjap.2015.05.005
△【通讯作者】Tel: 021-81883141; E-mail: yqfang126@gmail.com
