pH敏感的AB4型嵌段共聚物的合成、表征与自组装行为
2015-06-07罗延龄胡喜洁党佩佩
曹 丹, 罗延龄, 胡喜洁, 徐 峰, 党佩佩
(陕西师范大学 化学化工学院,陕西 西安 710119)
pH敏感的AB4型嵌段共聚物的合成、表征与自组装行为
曹 丹, 罗延龄*, 胡喜洁, 徐 峰, 党佩佩
(陕西师范大学 化学化工学院,陕西 西安 710119)
设计合成了一种AB4型pH敏感双亲嵌段共聚物。该共聚物由pH敏感的聚甲基丙烯酸及聚乳酸链段组成,其制备过程是先由端羟基聚乳酸与二氯乙酰氯通过酯化反应制得端四氯代聚乳酸,然后通过甲基丙烯酸叔丁酯的原子转移自由基聚合反应制得AB4型甲基丙烯酸叔丁酯-乳酸共聚物,再酸性水解。该共聚物可自组装为临界胶束浓度为19.7~32.5 mg/L、流体力学直径小于200 nm的球形核-壳胶束。该胶束表现出pH敏感性,其对紫杉醇在pH=5.6~7.4的缓冲溶液比在pH=1.4的缓冲溶液中有更快的释放速率,可作为疏水药物靶向释放的载体用于肠癌的靶向治疗。
生物材料;胶束;化学合成;药物释放
抗癌药物化疗与手术、放疗是治疗肿瘤的三大手段,而较多抗癌药物本身的水溶性、稳定性以及直接暴露于人体造成的毒副作用限制了其功效的发挥。因此,研究合成一种药物载体能够将其完好地运输到病变组织具有重大意义。高分子纳米药物靶向载体可以在全身施药后在肿瘤组织处富集实现缓慢可控释放[1-2]。由于两亲嵌段共聚物在水溶液中独特的自组装胶束核-壳结构、粒子尺寸和表面性质,目前被认为是一种理想的药物输送载体[3-4]。这种独特的性能使它们能够溶解不稳定和不溶性药物,避免由网状内皮系统 (RES) 所产生的非选择性吸收,从而通过高渗透率和滞留效应 (EPR) 实现被动靶向[5]。
研究工作者一直在尽最大的努力研究可降解的共聚物胶束纳米粒子作为药物释放的载体以维持目标组织中的药物量,从而提高口服药物的生物利用度。聚乳酸 (PLA) 作为最常使用的嵌段共聚物疏水组分的结构基元,具有较高的生物相容性和生物降解性。由聚(甲基)丙烯酸(P(M)AA)和PLA组成的双亲嵌段共聚物表现出良好的化学稳定性、高的水溶性、低毒性以及和血液组分低的相互作用[6-7]。专利CN 201010192970.8公开了一种可降解的酸敏感两亲性嵌段共聚物及其制备方法和应用,共聚物的亲疏水段分别由聚乙二醇和酸敏基团-二异丙基叔胺基组成[8]。共聚物胶束对阿霉素 (DOX) 的平均负载率小于15.97%。苏州大学陈维等[9]制备了基于聚乙二醇 (PEG) 和对酸不稳定的聚碳酸酯,聚(2,4,6-三甲氧基苯甲缩醛季戊四醇碳酸酯) 的双嵌段共聚物pH敏感可降解聚合物囊泡和胶束。聚合物囊泡对紫杉醇(PTX)的药物承载效率只有30.1%~37.7%,而聚合物胶束对PTX的药物承载效率达到61.4%~65.2%。在pH=4.0和5.0温和的酸性pH值条件下,PTX的释放速率快于它们在生理pH环境下的释放速率。韩国仁荷大学Lee S C等[10]合成了聚(2-乙基-2-恶唑啉-ε-己内酯) 嵌段共聚物作为紫杉醇药物释放的载体。PTX在胶束中的承载量只有0.5%~7.6%,取决于疏水嵌段含量。美国普渡大学Kim S等[11]制备了基于丙烯酸和4-(2-乙烯基苄氧基)-N,N-(二乙基烟酰胺) 为共聚单体的共聚物胶束,其临界胶束浓度为31~86 mg/L。PTX的承载量和包覆效率受到pH值影响。pH值大于5时,承载量和包覆效率下降较多。当丙烯酸摩尔含量大于20%时,PTX从胶束中的释放在模拟的肠液中 (pH=6.5) 经12 h释放完全;而在模拟的胃液 (pH=1.6) 中,释放的PTX出现严重的降解。
在此背景下,本文旨在合成一种AB4型pH敏感的聚(甲基丙烯酸-乳酸-甲基丙烯酸)多嵌段共聚物 (PMAA2-b-PLA-b-PMAA2),研究共聚物分子量及体系组成、pH环境对共聚物胶束的物理化学性能、药物承载及释放的影响,以改善其胶束化行为,并得到具有高的药物包覆效率及可控靶向行为的胶束药物制剂,实现共聚物胶束药物作为潜在的疏水药物释放载体的生物医学应用。
1 实验部分
1.1 材料和试剂
甲基丙烯酸叔丁酯 (tBMA),纯度99%,由美国阿拉丁公司提供。端羟基聚乳酸(HO-PLA-OH,数均分子量Mn=3 000和6 000) 由济南戴罡生物材料有限公司提供。二氯乙酰氯,纯度98.0%,由梯希爱 (上海) 化成工业发展有限公司提供。1,1,4,7,10,10-六甲基三亚乙基四胺 (HMTETA,97%) 由美国Sigma-Aldrich公司提供。四氢呋喃 (THF,99.0%) 和三乙胺 (TEA,99.0%) 均为化学试剂国药控股有限公司产品。溴化亚铜 (CuBr,98%) 为美国阿拉丁公司产品。
1.2 合成方法
AB4型多嵌段共聚物PMMA2-b-PLA-b-PMMA2的合成主要通过以下3步反应实现。
1.2.1 大分子引发剂氯代聚乳酸Cl2-PLA-Cl2的制备 通过端羟基聚乳酸和二氯乙酰氯的酯化反应合成Cl2-PLA-Cl2,其中HO-PLA-OH∶2,2-二氯乙酰氯∶三乙胺摩尔比为1∶2.6∶2.6。在干燥的三口烧瓶中,将2.0 g HO-PLA-OH溶解在15 mL干燥的四氢呋喃中并充分搅拌。然后,在氮气保护下将预先溶解在5 mL干燥THF中的0.20 mL CHCl2COCl在1 h内逐滴加入到上述溶液中。反应进行半小时后将溶液冷却到0 ℃。接着,在氮气保护下,将预先溶解在1 mL干燥THF中的0.29 mL三乙胺在30 min内逐滴加入到上述溶液中以中和释放出的HCl。室温反应24 h后,将得到的反应混合物静置2 h时,然后过滤、旋蒸、冷乙醚沉淀、分离、室温真空干燥,得到大分子引发剂。
1.2.2 PtBMA2-b-PLA-b-PtBMA2的合成 采用原子转移自由基聚合反应 (ATRP) 合成AB4型PtBMA2-b-PLA-b-PtBMA2多嵌段共聚物,反应在Schlenk管中进行;[Cl2-PLA-Cl2]∶[CuBr]∶[HMTETA]∶[tBMA]摩尔比为1∶7∶8∶x(x=200、400和600),溶剂为DMSO/异丙醇混合物。聚合前,进行3次连续标准的“冷冻-抽真空-熔融”操作排除聚合体系中的氧,90 ℃反应24 h,淬火,并用THF稀释反应混合物,经中性氧化铝层析柱除去铜络合物;旋蒸除去大多数THF,最后在10倍过量冷乙醚中沉淀,过滤、室温真空干燥至恒重,得到最终产品。1.2.3 PMMA2-b-PLA-b-PMMA2的水解 通过PtBMA2-b-PLA-b-PtBMA2酸性水解制备。取PtBMA2-b-PLA-b-PtBMA20.5 g溶解于12 mL 1,4-二氧六环中,形成均相溶液后加入2 mL浓HCl置于90 ℃下反应24 h。反应液经旋转蒸发除溶剂,正己烷中沉淀,真空干燥至恒重即可。
1.3 共聚物胶束团聚体的制备
采用透析法制备胶束团聚体。具体地,将40 mg PMAA2-b-PLA-b-PMAA2嵌段共聚物溶解在4 mL DMF中。然后在强力搅拌下将去离子水逐滴加入到上述聚合物溶液中直到出现乳白色,表明形成了聚合物胶束。聚合物溶液搅拌过夜并对1 000 mL去离子水室温透析48 h (透析袋截留分子量:2 000)以除去DMF。开始3 h每小时更换1次,然后每8 h更换1次。制得的胶束溶液以待备用。
1.4 测试与表征
1.4.1 化学结构表征 采用德国布鲁克公司300 MHz的1H核磁共振光谱仪 (1H NMR) 和红外光谱 (FT-IR) 分析共聚物的化学结构。1H NMR溶剂为DMSO-d6和CDCl3。FT-IR样品采用KBr压片法制备。采用美国Waters公司凝胶渗透色谱仪(GPC)测定聚合物分子量及多分散指数 (PDI)。色谱级DMF为流动相,流速1 mL/min,测定温度35 ℃。
1.4.2 胶束团聚体物理化学性能测定 以芘作为探针分子,采用荧光光谱法研究胶束团聚体的形成,并估算临界胶束浓度(CMC)。为了制备样品溶液,将已知量的芘溶于丙酮中,并加入到一系列10 mL的容量瓶,蒸发丙酮,最终溶液中的芘浓度为6.0×10-7mol/L。然后,将1×10-1~5×10-5mg/L浓度的胶束团聚体溶液分别加入到每一容量瓶中;室温搅拌过夜,使芘和胶束团聚体达到平衡。用Perkin Elmer LS55型荧光分光光度计记录荧光光谱。激发和发射波长分别为339 nm和394 nm。
采用日本电子公司生产的JEOL JEM-1210型透射电子显微镜 (TEM) 观察共聚物胶束的形貌,电压200 kV。测量前,将一滴含2%磷钨酸的胶束溶液滴加在铜网上,室温下干燥。
采用美国BI-90Plus型动态光散射仪 (DLS) 测定室温下胶束尺寸和粒度分布,波长660 nm,偏转角90°,输出功率15 mW。采用美国贝克曼库尔特公司Delsa Nano S型激光粒度zeta电位分析仪分析胶束表面电荷。测试温度25 ℃,待测样品用去离子水稀释以便调整信号强度在仪器检测范围内。
1.4.3 药物胶束制剂的制备及体外药物释放实验 为了制备包覆紫杉醇的共聚物胶束,将40 mg PMAA2-b-PLA-b-PMAA2和4 mg PTX溶解在10 mL DMF/丙酮混合溶剂中,然后放置在透析袋 (MWCO=2 000) 对500 mL PBS溶液透析以去除有机溶剂。未包埋的药物通过离心分离除去。承载有药物的共聚物胶束冻干成固体粉末保存。
采用日本日立公司型号为U-3900/3900H的紫外可见光谱仪,通过测定它们在固定吸收波长228 nm(PTX)、DMF/丙酮混合溶剂中的紫外吸光度,可以计算药物装载量(LC)和包封效率(EE),如公式(1)和(2)所示。
LC(%)=(胶束中药物的质量/承载药物的胶束的质量)×100;
(1)
EE(%)=(胶束中药物的质量/加入的药物质量)×100。
(2)
校准曲线通过使用DMF/丙酮混合溶剂中不同浓度的游离药物进行绘制。
体外药物释放实验在37 ℃不同pH值 (pH=7.4、6.4和5.6的PBS溶液) 的生理介质中进行。将20 mg冻干的共聚物胶束药物制剂用透析袋密封 (MWCO:2 000),然后浸入400 mL PBS溶液,并在37 ℃ (正常体温) 和40 ℃ (肿瘤组织的温度) 下搅拌水浴以释放药物。在预定的时间间隔,取4 mL PBS溶液进行定量分析,与此同时向到释放体系加4 mL新鲜PBS以作补充。累计的PTX释放量(%)通过228 nm处的紫外吸光度测定,并按下式计算:
累积药物释放率(%)=Mt/M0×100。
(3)
这里,Mt为时间t的药物释放量,M0代表共聚物胶束中承载的药物量。
2 结果与讨论
2.1 AB4型PMMA2-b-PLA-b-PM MA2嵌段 共聚物的合成与表征
图1—2为合成的AB4型嵌段共聚物的FT-IR及NMR图。由图1A可见,PtBMA2-b-PLA-b-PtBMA2特征的位移信号出现在1.03,1.43和1.80~1.90,分别为PtBMA嵌段中—CH2C(CH3)COO(CH3)3—,—C(CH3)3和—CH2C(CH3)OOC(CH3)3—的氢质子化学位移。PLA嵌段中,—OOCCH(CH3)O—和—OOCCH(CH3)O—的质子化学位移出现在5.16和1.50处。因此,PtBMA2-b-PLA-b-PtBMA2被成功合成。由图1B可见,水解后的样品在1.41处特征的叔丁基质子信号明显减弱,甚至消失;而在12.33处出现—COOH的质子化学位移信号,说明PtBMA2-b-PLA-b-PtBMA2水解为PMAA2-b-PLA-b-PMAA2。由图2(a) 的FT-IR进一步发现,在1 726 cm-1和1 367~1 395 cm-1出现PtBMA2-b-PLA-b-PtBMA2共聚物的酯羰基伸缩和叔丁基弯曲振动;—C—O—C—伸缩及烷基伸缩出现在1 136 cm-1和2 987 cm-1处。而在图2(b) 中,—C(CH3)3特征吸收减弱甚至消失,出现一个新的—OH峰 (3 577 cm-1)。这说明PtBMA2-b-PLA-b-PtBMA2共聚物已水解为PMAA2-b-PLA-b-PMAA2。表1为GPC测定的共聚物的分子量及其分子量分布 (PDI)。Mn随着[tBMA]/[Cl2-PLA-Cl2] 摩尔比提高而提高。估计Cl2-PLA-Cl24个活性点结合了10、22和31个tBMA或MAA重复单元。聚合物表现出窄的分子量分布,其多分散指数低,范围为1.08~1.23。这说明聚合过程得到了很好的控制,纯化效果好。以上分析证明合成了AB4型PMAA2-b-PLA-b-PMAA2嵌段共聚物。
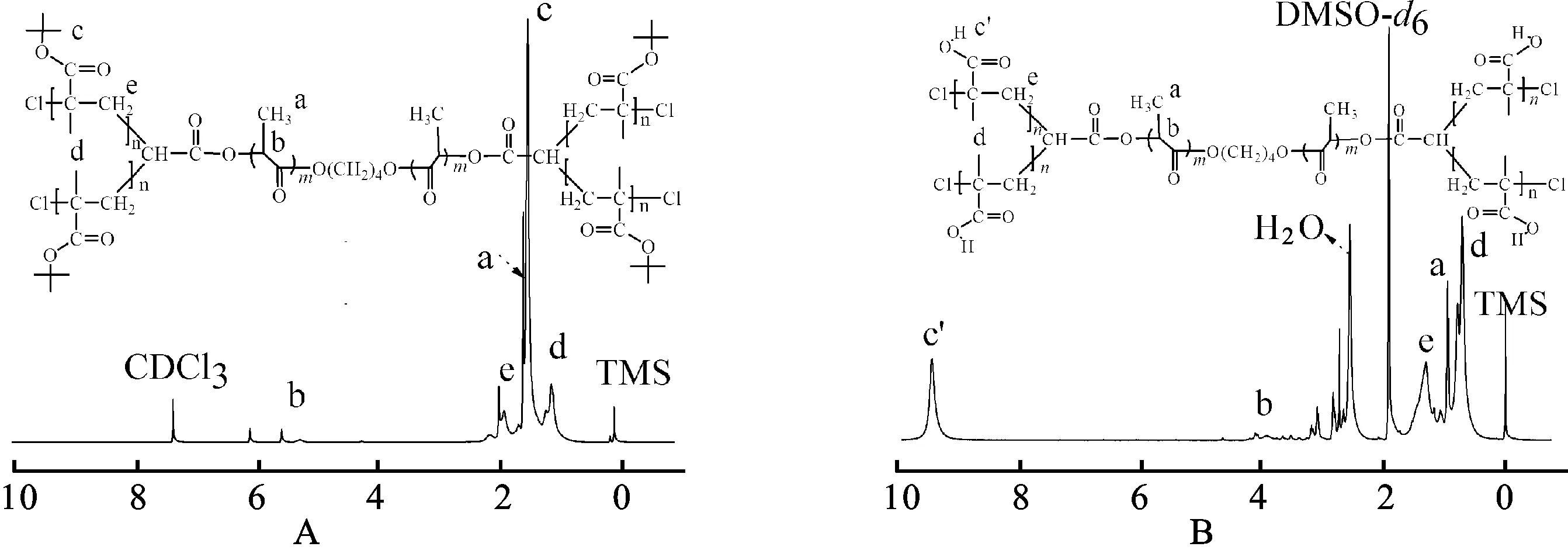
图1 PtBMA2-b-PLA-b-PtBMA2A和PMAA2-b-PLA-b-PMAA2B嵌段共聚物的1H NMR图
Fig.11H NMR spectra of PtBMA2-b-PLA-b-PtBMA2(A) and PMAA2-b-PLA-b-PMAA2(B) block copolymers
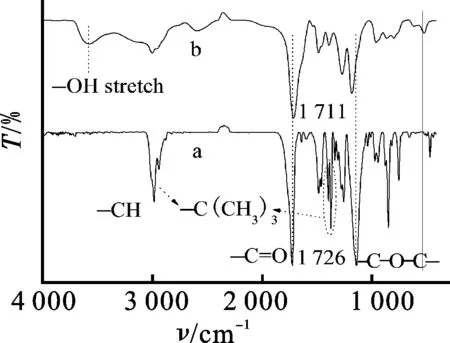
图2 PtBMA2-b-PLA-b-PtBMA2(a)和PMAA2-b- PLA-b-PMAA2(b)嵌段共聚物的FT-IR图Fig.2 FT-IR spectra of PtBMA2-b-PLA-b-PtBMA2(a) and PMAA2-b-PLA-b-PMAA2(b) block copolymers
2.2 自组装胶束的物理化学性能及pH响应性研究
由亲水的PMAA和疏水的PLA嵌段组成的PMAA2-b-PLA-b-PMAA2嵌段共聚物在DMF中是可溶的,而在水溶液中则可以自发地组装为以PLA为核、PMAA为壳的核-壳胶束团聚体。以芘作为探针分子,采用荧光光谱法研究了胶束团聚体的形成,并估算了临界胶束浓度(CMC)[12-13],如表1所示。很明显,CMC值低于32.5 mg/L,短的PMAA亲水链段或低的分子量导致CMC值下降。表1还给出了这些合成的嵌段共聚物在水溶液中形成的胶束团聚体的其他物理化学性能数据。由表1可见,在pH值为7.4的PBS缓冲溶液中,由于PMAA嵌段的离子化使得亲水性增强,在水溶液中PMAA链得以更好地伸展,胶束粒子尺寸随着PMAA分子链长度或分子量的增加而增大;形成胶束的临界浓度也提高。负的ε电位值说明,在PBS溶液中共聚物胶束表面带负电荷。考虑到共聚物胶束团聚体低的CMC值,因此本工作制备的多嵌段共聚物胶束具有良好的稀释稳定性;而小于188 nm的流体力学直径使胶束非常适合用作药物控制释放的载体材料。

表1 合成的共聚物胶束的物理化学性能与药物配方Tab.1 Physicochemical properties and pharmaceutical formulation based on the synthesized copolymer micelles
a.pH=7.4。
图3a为空白的PMAA2-b-PLA-b-PMAA2嵌段共聚物胶束团聚体的TEM照片。从图3a可以看出,这种胶束团聚体是球形的,平均粒径估算为约108 nm。考虑到PMAA嵌段在不同pH值水溶液中质子化-去质子化行为,图4研究了AB4型PMAA2-b-PLA-b-PMAA2共聚物胶束团聚体透光率对pH值的依赖性。从图4可以看出,胶束团聚体随着pH值发生明显的相转变。以[引发剂]∶[单体]=1∶400的聚合体系为例,在pH值小于4.73以下,由于质子化的PMAA分子间及分子内氢键相互作用,非离子化的PMAA呈现卷曲构象,易形成大的团聚体,产生低的透光率。随着pH值提高,缔合的PMAA外壳开始由疏水性向亲水性变化。当pH值提高到5.77时 (相当于PMAA嵌段的pKa5.6),氢键作用几乎消失。大多数PMAA离子化,因而透光率提高。pH=6.89时,PMAA完全离子化,大的胶束团聚体解离为小的胶束,因而透光率超过90%。由此推断,相转变点在pH值约5.77处。同样可以估计,[引发剂]∶[单体]=1∶200和[引发剂]∶[单体]=1∶600的聚合体系的相转变点分别为pH值约5.92和5.40。随着PMAA嵌段长度或分子量提高,相转变值明显地下降。如前所述,由于更长的PMAA链具有高的ε电位,因而通常可避免胶束纳米粒子的团聚。由此可见,PMAA2-b-PLA-b-PMAA2共聚物胶束团聚体如预期的表现出pH响应性。

图3 空白(a)及承载有PTX(b) PMAA2-b-PLA-b-PMAA2共聚物胶束团 聚体的TEM照片 (共聚物浓度:250 mg/L)Fig.3 TEM images of (a) blank and (b) PTX-loaded PMAA2-b-PLA-b-PMAA2 copolymer micelle aggregates (copolymer concentration: 250 mg/L)
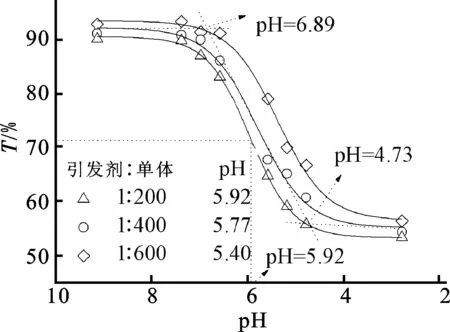
图4 PMAA2-b-PLA-b-PMAA2共聚物胶束团聚体透光率 对pH值的依赖性 (共聚物浓度:250 mg/L)Fig.4 Transmittance dependence of PMAA2-b-PLA-b-PMAA2copolymer micelle aggregates on pH (copolymer concentration: 250 mg/L)
2.3 药物承载和体外释放研究
鉴于制备的嵌段共聚物特殊的核-壳胶束构造,疏水性药物可以包覆进胶束核中。由图3给出的承载药物的共聚物胶束团聚体 (浓度:250 mg/L) 的形貌可以看出,载药后的共聚物胶束团聚体的形貌也是球形的,说明胶束形貌不受小分子药物承载的影响。然而平均粒径由空白胶束的约108 nm增加到承载PTX胶束的131 nm。因此,药物包覆进了胶束的核中。包覆能力 (LC) 及包覆效率 (EE) 如表1所示。随着MAA/PLA组成比或PMAA链长度提高,LC和EE值提高。本工作通过设计合理的药物配方可获得最佳的包覆效率,其LC和EE值高于由Rezaei和Lee[10,14]所报道的相同药物配方的胶束药物载体体系。因此,本工作嵌段共聚物胶束适合用作PTX药物释放的载体;希望的药物制剂可通过改变嵌段组成来实现。
图5是PTX在pH=5.6、6.4和7.4,温度37 ℃时,从[引发剂]∶[单体]=1∶400的共聚物胶束中,及在pH=5.6、温度40 ℃时,从3种共聚物胶束中释放的累积体外释放量随时间的变化曲线。由图5可见,PTX的体外药物释放是pH值依赖的,没有初期爆发式释放。当pH=1.4时,由于PMAA嵌段间的氢键相互作用,共聚物胶束紧密地结合在一起,药物释放主要通过扩散进行。因此释放得慢,96 h只有26%的药物释放;且胶束可以降低药物在胃中的泄漏。在大于5.6 (大约为PMAA的pKa值) 的高pH值条件下,羧基开始离子化。此时,氢键相互作用逐渐减弱甚至破坏,共聚物胶束开始解离或降解,释放包覆在胶束中的药物。药物释放速率和释放量随着pH值增大而提高。经96 h,PTX在pH=5.6和7.4时,从PMAA2-b-PLA-b-PMAA2胶束中的释放量分别为60%和77%。中性或碱性介质中带负电的—COO-间的静电排斥是产生pH诱导的药物释放行为的原因。这种作用会使包覆的药物优先释放或吸附在肠道中,与此同时避免了药物在胃中的泄露。特别是,不同pH环境中的生物降解特性可能直接和pH诱导的药物释放相关。结合LC和EE分析,本工作嵌段共聚物胶束适合于PTX的承载和释放。
为了解各种胶束基PTX配方的治疗效率,对PTX在肿瘤细胞环境下 (pH 5.6、温度40℃) 的累积的释放行为进行了研究。很清楚地发现,PTX的释放是组成或亲水的PMAA链依赖的,总释放量或速率随PMAA嵌段长度的提高而提高。24 h时,PTX从3种共聚物胶束中累计释放量分别为29%、33%和40%;96 h分别为61%、67%和72%。高的释放速率是由于更长的PMAA链具有更明显的pH响应性,导致胶束结构在中性或碱性介质中更多地解离或降解,PTX快速地释放。在这些胶束基药物配方中,PTX的释放具有持续释放的显著特点。因此,有足够的PTX余留用于持续释放以确保长期治疗效果。药物释放行为可以通过调整体系组成加以改变。
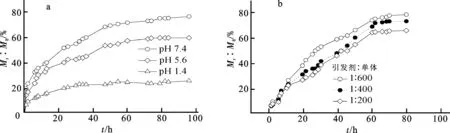
图5 疏水药物PTX累积的体外释放量随时间的变化曲线
Fig.5 The cumulative release of hydrophobic drug PTX as a function of time
a.[引发剂]∶[单体]=1∶400,释放环境:pH=1.4、5.6和7.4,温度37 ℃;b.释放环境:pH=5.6,温度40 ℃。
3 结论
成功合成了AB4型pH敏感的PMAA2-b-PLA-b-PMAA2嵌段共聚物。共聚物在溶液中可自组装为球形核壳胶束。共聚物分子量或体系组成、pH环境对共聚物胶束的物理化学性能有影响,其CMC范围为19.7~32.5 mg/L、流体力学直径范围139~197 nm、pH相转变位于5.40~5.92。制备的共聚物胶束可以有效地捕获PTX,其包覆效率可通过改变共聚物嵌段组成予以改善。药物释放行为明显受到pH值影响,其在模拟的小肠环境中释放速率更快。因此,pH敏感的PMAA2-b-PLA-b-PMAA2嵌段共聚物胶束可作为潜在的疏水药物释放的载体用于肠癌治疗。
[1] Li F, Danquah M, Mahato R I. Synthesis and characterization of amphiphilic lipopolymers for micellar drug delivery[J]. Biomacromolecules, 2010, 11(10): 2610-2620.
[2] Jiang J Q, Qi B, Lepage M, et al. Polymer micelles stabilization on demand through reversible photo-cross-linking[J]. Macromolecules, 2007,40(4):790-792.
[3] Gou M L, Zheng L, Peng X Y, et al. Poly(e-caprolactone)-poly (ethylene glycol)-poly(e-caprolactone) (PCL PEG PCL) nanoparticles for honokiol delivery in vitro[J]. International Journal of Pharmaceutics, 2009, 375(1/2):170-176.
[4] Kataoka K,Harada A,Nagasaki Y. Block copolymer micelles for drug delivery: design, characterization and biological significance [J]. Advanced Drug Delivery Reviews, 2012,64(s1):37-48.
[5] Opanasopit P, Yokoyama M, Watanabe W, et al. Influence of serum and albumins from different species on stability of camptothecin-loaded micelles [J]. Journal of Controlled Release, 2005,104(2):313-321.
[6] Lee H J,Bae Y. Brushed block copolymer micelles with pH-sensitive pendant groups for controlled drug Delivery [J]. Pharmaceutical Research, 2013,30(10):2077-2086.
[7] Gupta S, Tyagi R, Parmar V S, et al. Polyether based amphiphiles for delivery of active components[J]. Polymer, 2012,53(15):3053-3078.
[8] 帅心涛, 李皓, 李芬. 一种可降解的酸敏感两亲性嵌段共聚物及其制备方法和应用 [P].中国专利:201010192970.8, 2010-06-07.
[9] Chen W, Meng F, Cheng R, et al. pH-Sensitive degradable polymersomes for triggered release of anticancer drugs: A comparative study with micelles [J]. Journal of Controlled Release, 2010,142(1):40-46.
[10] Lee S C, Kim C, Kwon I C, et al.Polymeric micelles of poly(2-ethyl-2-oxazoline)-block-poly(ε-caprolactone) copolymer as a carrier for paclitaxel[J]. Journal of Controlled Release, 2003,89(3):437-446.
[11] Kim S, Kim J Y, Huh K M, et al.Hydrotropic polymer micelles containing acrylic acid moieties for oral delivery of paclitaxel[J]. Journal of Controlled Release, 2008,132(3):222-229.
[12] Zhao C, Winnik M, Reiss G, et al. Fluorescence probe techniques used to study micelle formation in water-soluble block copolymers[J]. Langmuir, 1990, 6(2): 514-516.
[13] Luo Y L, Yang X L, Xu F, et al. pH-Triggered PMAA-b-HTPB-b-PMAA copolymer micelles: Physicochemical characterization and camptothecin release[J]. Colloid and Polymer Science, 2014, 292(5): 1061-1072.
[14] Rezaei S J T, Nabid M R, Niknejad H, et al. Multifunctional and thermoresponsive unimolecular micelles for tumor-targeted delivery and site-specically release of anticancer drugs[J].Polymer,2012,53(16):3485-3497.
〔责任编辑 王 勇〕
Preparation and characterization of pH-sensitive AB4-type block copolymers with self-assembly
CAO Dan, LUO Yanling*, HU Xijie, XU Feng,DANG Peipei
(School of Chemistry and Chemical Engineering, Shaanxi Normal University,Xi′an 710119, Shaanxi, China)
AB4-type pH-sensitive amphiphilic block copolymers,consisted of pH-sensitive polymethacrylic acid and polylactic acid segments were synthesized in three steps.Firstly, Chloro-polyactic acid (Cl2-PLA-Cl2) was prepared by esterification of HO-PLA-OH and CHCl2COCl. Then, poly(t-butyl methacrylate)-block-polylactic acid-block-poly(t-butyl methacrylate) (PtBMA2-b-PLA-b-PtBMA2) was synthesized via atom transfer radical polymerization. After hydrolysis, polymethacrylic acid-block-polylactic acid-block-polymethacrylic acid (PMAA2-b-PLA-b-PMAA2) was obtained. The copolymers could be spontaneously assembled into spherical core-shell micelles with critical micelle concentration (CMC) of about 19.7~32.5 mg/L and the hydrodynamic diameters below 200 nm. The copolymer micelles exhibited pH sensitivity,and paclitaxel had faster release rate in PBS solution at pH 5.6~7.4 than in PBS at pH 1.4.The copolymers may be used as water-insoluble drug targeting release carriers for intestine cancers.
biomaterials; micelles; chemical synthesis; drug release
1672-4291(2015)04-0059-06
10.15983/j.cnki.jsnu.2015.04.342
2014-10-16
国家自然科学基金(21273142,21172138);陕西省自然科学基金(2012JM6009);陕西师范大学勤助科研项目(QZYB14010)
曹丹,女,硕士研究生,研究方向为生物医用高分子材料合成与应用。E-mail:627235667@qq.com
*通信作者:罗延龄,男,副教授,博士。E-mail: ly10401a@163.com
O626.13
A
