八珍汤联合FOLFOX6方案治疗转移性结直肠癌临床研究*
2015-06-06高炜徐媺
高 炜 徐 媺
青岛市肿瘤医院中西医结合科,山东青岛 266042
近年来,我国结直肠癌发病率逐年上升[1]。由于各种客观原因,多数患者就诊时,已失去手术机会,化疗成为治疗的主要手段。随着临床引入伊立替康和奥沙利铂等新药,以及分子靶向药物如贝伐单抗、西妥昔单抗等,使患者反应率、无进展生存期(progression free survival,PFS)、总生存期(overall survival,OS)分别提高至50%~60%、9~11个月、20~24个月[2]。但总体疗效仍然不理想,且靶向药物花费较高,为观察中西医结合治疗晚期结直肠癌疗效,笔者应用加味八珍汤联合FOLFOX6方案治疗晚期结直肠癌,并与单纯应用FOLFOX6方案进行分析比较,结果报告如下。
1 资料与方法
1.1 一般资料
选择2010年10月―2013年10月本科收治的晚期结直肠癌患者90例,随机分为对照组和治疗组,每组各45例。治疗组,其中男25例,女20例;年龄44~73岁,平均年龄59岁;结肠癌28例,直肠癌17例;KPS评分(74.28±6.85)分。对照组,其中男27例,女18例;年龄46~71岁,平均年龄57岁;结肠癌27例,直肠癌18例;KPS评分(73.15±5.95)分。2组患者在性别,年龄,病情严重程度等方面比较,差异无统计学意义(P>0.05),具有可比性。
1.2 入选及排除标准
入选标准:①经病理确诊为晚期结直肠癌,并排除神经系统转移;②预计生存期≥3个月;③血红蛋白≥90g/L,白细胞计数≥4.0×109/L,血小板计数≥8.0×109/L,中性粒细胞计数≥1.5×109/L,肝肾功能正常,治疗前无化疗禁忌证;④具有可测量的病灶;⑤KPS评分>60分;⑥治疗前签署知情同意书;⑦入组时未服用中药,既往接受化疗者距末次化疗时间≥1个月。排除标准:①治疗前1个月使用过其他抗肿瘤治疗及中药;②有严重心血管疾病或肝肾功能不全或严重肺功能不全。
1.3 治疗方法
对照组单纯应用FOLFOX6方案治疗,治疗组应用八珍汤加减联合FOLFOX6方案治疗。
FOLFOX6方案:奥沙利铂(江苏恒瑞医药股份有限公司生产)100mg/m2,静脉滴注2h,第1天;亚叶酸钙(江苏恒瑞医药股份有限公司生产)400mg/m2,静脉滴注2h,第1天;5-氟尿嘧啶(5-FU,齐鲁制药有限公司)400mg/m2,静脉推注,第1天;2 400mg/m2,持续泵注,46h。14d为1个周期。
八珍汤:当归10g,川芎5g,白芍药8g,熟地黄15g,人参3g,白术10g,茯苓8g,炙甘草5g,根据病情适当加减。于化疗开始时服用至化疗周期结束,每日1剂,浓煎240ml,早晚分服。
1.4 疗效评价标准
根据实体瘤通用标准(RECIST1.0)[3]对近期疗效进行评价。完全缓解(CR):肿瘤完全消失4周以上,同时无新的病灶出现;部分缓解(PR):肿瘤缩小≥50%,维持4周以上,同时无新的病灶出现;稳定(SD):肿瘤增大≤25%或者缩小<50%,同时无新的病灶出现;进展(PD):肿瘤增大>25%,或者出现新的病灶。总有效率(RR)为CR率与PR率之和,疾病控制率(DCR)为RR率与SD率之和。
按照KPS评分对患者生活质量进行评价,治疗后患者的KPS评分比治疗前增加10分以上则为生活质量提高,KPS评分增加或减少0~10分为生活质量稳定,KPS评分降低10分以上则为生活质量降低。
化疗期间产生的不良反应按照WHO抗癌药物常规不良反应分级标准,分为0~Ⅳ级,依次进行评价。
1.5 随访
全组患者均在化疗完成后第1年内每3个月全面复查1次;治疗后第2年每6个月复查1次;随访满2年者再次行全面检查1次。通过门诊及电话相结合的方式进行随访,随访内容包括以下几个方面:①临床症状及体征的变化,如便血、腹痛、排便习惯的改变及腹部肿块、局部淋巴结触诊等;②监测肿瘤标志物CEA、CA199等的变化;③腹盆部超声及胸片检查,必要时可行CT及MRI检查;④如有骨痛,尤其是进行性加剧或伴有压痛者,则行骨扫描排除骨转移。每次随访均调查患者临床症状及不良反应的变化,鼓励患者及时报告自身的任何不适信息,详细记录新出现的临床症状,辅助检查则根据医师决定及复查时间决定。至少每月电话随访1次,直至患者病死或随访期满2年,记录结果。
1.6 统计学处理
采用SPSS 19.0统计软件包进行数据分析,计量资料用±s表示,率(%)的比较采用χ2检验,组间比较用t检验,采用Kaplan-Meier法分析患者接受治疗后的生存时间、无疾病进展时间、绘制生存曲线,用Log-Rank检验进行单因素比较,以P<0.05为差异有统计学意义。
2 结果
2.1 2组临床疗效
2组均无CR病例。对照组PR 13例,SD 14例,PD 18例,总有效率28.89%,疾病控制率60.0%;治疗组PR 18例,SD 18例,PD 9例,总有效率40.00%,疾病控制率80.0%,治疗组疾病控制率高于对照组,差异有统计学意义(P<0.05),总有效率高于对照组,但差异无统计学意义(P>0.05)。见表1。
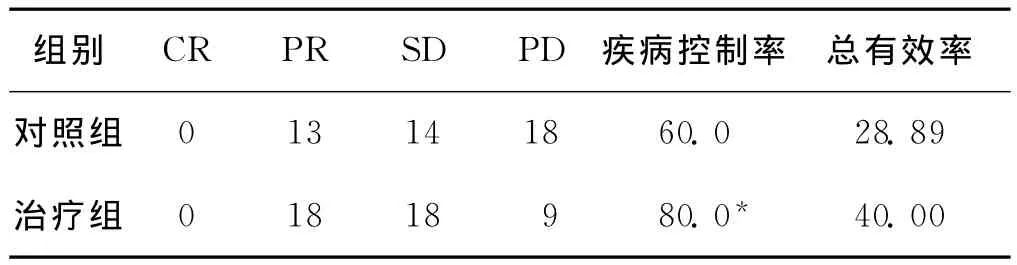
表1 2组临床疗效比较(n=45,例,%)
2.2 2组KPS评分
对照组治疗后KPS评分较治疗前略有改善,但差异无统计学意义(P>0.05);治疗组KPS评分较治疗前明显升高(P<0.05),并显著高于对照组(P<0.05)。见表2。
2.3 2组患者不良反应
治疗组发生恶心呕吐、周围神经毒性、红细胞减少、血小板减少病例数少于对照组(P<0.05),腹泻、发热、皮疹病例数与对照组比较,差异无统计学差异(P>0.05)。见表3。
表2 2组KPS评分比较(n=45,±s)

表2 2组KPS评分比较(n=45,±s)
与治疗前比较△P<0.05;与对照组比较*P<0.05
组别治疗前治疗后对照组70.64±4.25 72.36±5.56治疗组73.42±6.05 81.25±5.21△*

表3 2组不良反应比较(n=45,例)
2.4 生存分析
对90例患者进行随访至病死或满2年,6例失访,随访率93.3%。对照组中位无进展生存期9.1个月(95%CI为8.7~9.4个月),中位生存时间19.0个月(95%CI为19.1~20.8个月);治疗组中位无进展生存期9.2个月(95%CI为9.0~9.4个月),中位生存时间21.4个月(95%CI为20.8~21.8个月),治疗组中位生存时间显著长于对照组(P<0.05),但2组中位无进展生存期差异无统计学意义(P>0.05)。见图1。
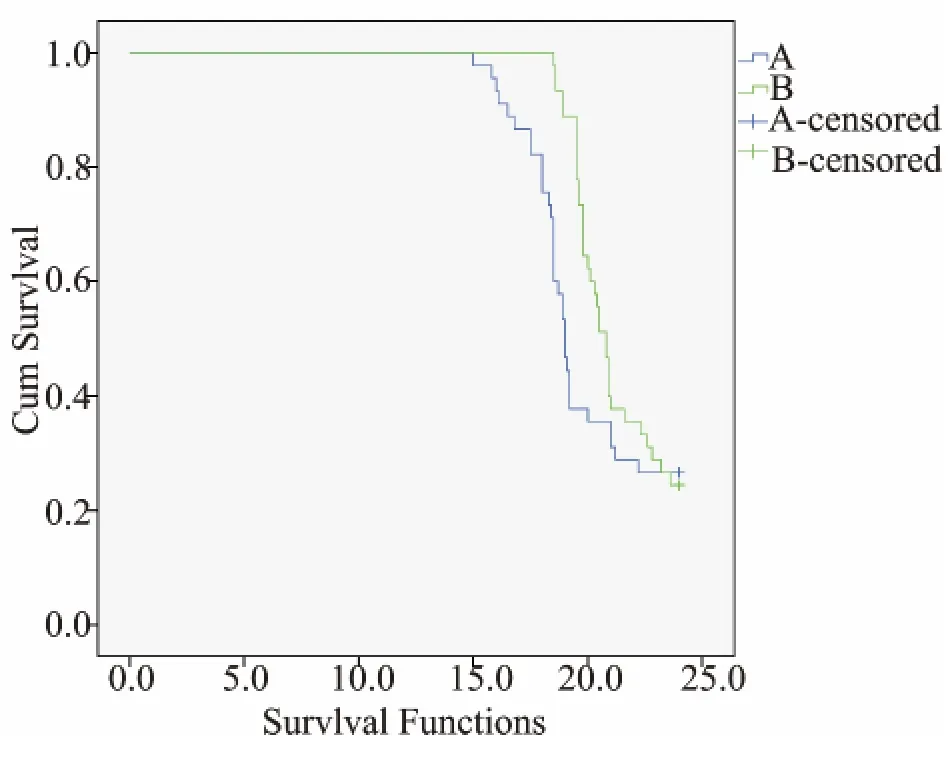
图1 2组生存分析图
3 讨论
结直肠癌发病率逐年上升,对于晚期结直肠癌,化疗是主要的治疗手段,临床上主要以5-FU/CF为主[4],5-FU是一种公认的周期特异性细胞毒性药物,在体内转化为5F-dUMP,抑制胸苷酸合成酶(TMPS),阻碍DNA合成。而奥沙利铂是第3代铂类药物,发挥药物作用时,与DNA链上的鸟嘌呤G共价结合,不仅抑制DNA合成;同时也抑制DNA修复,从而激活相关信号转导通路并引起细胞凋亡,作用的靶点为DNA[5]。研究[6]结果表明,奥沙利铂对转移瘤模型以及多种癌细胞株,特别是对结直肠癌细胞株有明显的抑制作用,与5-FU合用有明显的协同抑制肿瘤作用,并且对5-FU耐药的细胞株也有抑制作用。本身无抗癌活性的亚叶酸钙是5-FU代谢调节物,能够为组织提供大量外源性的CH2FH4,增强对TS的抑制,阻碍DNA合成,因此增强5-FU的生物活性[7],FOLFOX6方案已经成为晚期结直肠癌的一线治疗方案,但是疗效依然不能够令人满意。
中西医结合治疗恶性肿瘤是近几年研究的热点,中医认为结直肠癌的主要病机特点是正气虚,《内经》说:“正气存内,邪不可干”,“邪之所凑,其气必虚”。结直肠癌主要表现为脾虚,脾虚以气虚为主,久病及阳,引起血虚。八珍汤为四君子汤与四物汤的合方,具有益气健脾、气血双补的特点。方中人参、茯苓、白术具有益气健脾、扶助正气的作用,而当归、白芍强化健运脾胃功效,又有养血和营的作用。现代医学药理学研究[8]证实,人参中所含有的人参多糖具有增强巨噬细胞的吞噬能力,以及通过诱导机体免疫细胞的表达从而提高机体抗肿瘤的能力。此外,人参皂苷-Rg3和人参皂苷-Rh2具有抑制肿瘤细胞黏附、增殖、浸润以及抗肿瘤新生血管生成的作用,能够有效抑制肿瘤的生长和转移[9]。白术中的白术挥发油也可促进肿瘤凋亡,茯苓中的茯苓多糖及茯苓三萜等有效成分能够提高淋巴细胞转化率和NK细胞的杀伤活性,在改善机体的免疫功能的同时还能有效抑制肿瘤细胞活性[10]。
本研究结果表明,八珍汤联合FOLFOX6方案治疗晚期结直肠癌,在疾病控制率、KPS评分、中位生存时间等方面均显著优于单纯化疗组,且恶心呕吐、骨髓抑制、周围神经毒性等不良反应显著降低,体现了中西医结合治疗肿瘤的优势。
综上所述,八珍汤联合FOLFOX6方案相较于单纯应用FOLFOX6方案治疗晚期结直肠癌在一定程度上可以更有效地抑制肿瘤,改善患者生活质量,提高疾病控制率,减轻化疗所引起的不良反应,并在延长总生存期方面确有疗效,值得临床推广。
[1] 徐瑞华,邱妙珍.晚期结直肠癌化疗的研究进展[J].癌症,2008,27(6):661-666.
[2] HOCHSTER HS.Stop and go:yes or no?[J].J Clin Oncol,2009,27(34):5677-5679.
[3] 陈志伟,廖美琳.RECIST标准在肿瘤治疗疗效评价中的应用[J].中国肿瘤,2004,13(10):616-618.
[4] 费燕华.热疗联合FOLFOX6方案治疗晚期结直肠癌疗效观察[J].癌症进展,2012,10(6):614-615.
[5] 周际昌.实用肿瘤内科学[M].北京:人民卫生出版社,2005:604.
[6] CHEN J,HUANG XF,QIAO L,et al.Insulin caused drugresistance to oxaliplatin in colon cancer cell line HT29[J].J Gastrointest Oncol,2011,2(1):27-33.
[7] 白勇利,王剑英.mFOLFOX6方案和capeOX方案治疗晚期结直肠癌的对照研究[J].内蒙古医学杂志,2009,41(8):19-20.
[8] 任莉莉,魏影非,杜惠兰.人参抗肿瘤作用研究进展[J].中成药,2005,27(8):947-950.
[9] 李欣,万红贵,卢定强,等.人参皂甙的抗肿瘤研究进展[J].生物加工过程,2003,1(2):13-17.
[10]刘丹丹,戴娜,范婧莹.茯苓抗肿瘤药理作用研究[J].中国医药生物技术,2009,4(4):291-294.
