中介蝮蛇毒L-氨基酸氧化酶基因的生物信息学分析
2015-06-05郭积芳王芳霞杨章民
张 翠,郭积芳,孙 悦,王芳霞,杨章民
(陕西师范大学生命科学学院,陕西西安710119)
中介蝮蛇毒L-氨基酸氧化酶基因的生物信息学分析
张 翠,郭积芳,孙 悦,王芳霞,杨章民*
(陕西师范大学生命科学学院,陕西西安710119)
采用生物信息学方法,对中介蝮蛇毒L-氨基酸氧化酶(GI-LAO)基因进行了分析。结果表明:GI-LAO基因所包含的开放阅读框为1 515bp,编码504个氨基酸残基;GI-LAO一级结构与白眉蝮GH-LAO的相似性最高,达99%;N-端的18个氨基酸残基为信号肽,成熟肽含486个氨基酸残基,相对分子质量为55.1kDa,理论等电点为6.55;该蛋白含有两个结构域:FAD结合域(56-123位氨基酸残基)和催化结构域(61~499位氨基酸残基);与白眉蝮GH-LAO序列比对发现,有4个氨基酸位点存在差异(分别是20、56、99和467位氨基酸残基),用SIFT软件分析表明,这四个位点对其功能无影响;该基因编码的氨基酸序列有2个活性位点(H242和R343),2个N-糖基化位点(N190和N379),5个位点(R108、H241、Y390、G482和W483)与底物结合有关,4个保守半胱氨酸残基形成两对二硫键(C28—C191和C349—C430);三维结构建模结果表明,GI-LAO形成同源二聚体,每个单体由22个α-螺旋,22个β-折叠股和一些无规则卷曲、转角等形成三个结构域:FAD结合域,底物结合域以及α-螺旋域;在GI-LAO蛋白的进化分析中,中介蝮GI-LAO与白眉蝮GHLAO的亲缘关系最近。
中介蝮;L-氨基酸氧化酶;基因;生物信息学
L-氨基酸氧化酶(L-amino Acid Oxidase,LAO,EC1.4.3.2)是一种以黄素为辅酶的酶,能立体异构性氧化L-氨基酸脱氨,生成对应的α-酮酸、氨和H2O2,并伴随氧气的消耗[1]。LAOs广泛存在于蝰科(蝰亚科和蝮亚科)、响尾蛇科、眼镜蛇科、甚至海蛇的毒液中[2],因其存在而导致新鲜蛇毒呈现黄绿色。蛇毒L-氨基酸氧化酶(Snake venom L-amino acid oxidase,SV-LAOs)是蛇毒中最受关注的家族之一,由于易于纯化而成为研究L-氨基酸氧化酶的酶学、结构生物学和药物学的有趣客体[3]。关于LAOs的报道已经很多,近年来有关研究指出从蛇毒中分离的LAOs具有调控血小板聚集、刺激水肿形成、诱导出血或溶血、抗病毒/HIV活性、抗菌消炎、诱导细胞凋亡和抗寄生虫活性等功能[4]。而且SV-LAOs对血小板聚集的影响呈现相反的作用:Naumann等[5]从巴伊亚盾头蝮(Bothrops leucurus)中分离出的LAO能抑制由ADP诱导的血小板的聚集;而Izidoro等[6]从巴伊亚矛头蝮(Bothrops pirajai)中分离出的LAO却具有诱导血小板聚集的作用。有研究表明SV-LAOs的这些生物活性大部分与其催化产生的H2O2有直接或间接的关系,但也并不完全单独由H2O2引起。这些生物活性使SV-LAOs具有潜在巨大的药用开发价值和临床应用前景,因而受到科研工作者的青睐。
早在1944年,Zeller和Maritiz[1]在毒蝰(Vipera aspis)的毒液中检测到了LAO;1950年,Singer和Kearney[7]首次从美洲食鱼蝮(Agkistrodon pisciuorus Piscivorus)蛇毒中纯化了LAO;随后Wellner和Meister[8]从东部菱斑响尾蛇(Crotalus adamanteus)毒液中纯化并获得了LAO的晶体结构。对于SV-LAOs的研究,20世纪70年代前主要集中在酶学和生理生化特性方面,80年代和90年代主要集中在分离纯化和鉴定方面,90年代以后主要是对其生物活性、结构、克隆表达等方面的研究[9]。
中介蝮为蝰科(Viperidae)蝮亚科(Crotalinae)亚洲蝮属(Gloydius)毒蛇,在国内广泛分布于从蒙新区西部沙漠亚区、天山亚区到西部黄土高原亚区的辽阔区域(国外分布于西伯利亚南部及蒙古共和国),是该地区毒蛇的优势种,也是我国6种蝮蛇中毒性最强的一种[10]。迄今,尚未见关于中介蝮SVLAO的报道。本文采用生物信息学的方法,对来自中介蝮毒腺cDNA文库[11]的一个高丰度表达的SV-LAO基因进行了生物信息学分析,为其生物学活性及应用研究奠定基础。
1 材料与方法
用于分析的中介蝮LAO的cDNA序列来自中介蝮毒腺cDNA文库,生物信息学分析的有关序列均下载自NCBI(National Center for Biotechnology Information)核酸及蛋白质数据库。所选的序列包括:白眉蝮(Gloydius halys,Q6STF1.1)、黄绿原矛头蝮(Protobothrops flavoviridis,BAN82013.1)、竹叶青(Trimeresurus stejnegeri,Q6WP39.1)、诺维特矛头蝮(Bothrops pauloensis,B5AR80.1)、南美巨蝮(Lachesis muta,AFP89360.1)、北美侏响尾蛇(Sistrurus catenatus edwardsi,B0VXW0.1)、非洲锯鳞蝰(Echis ocellatus,B5U6Y8.1)和银环蛇(Bungarus multicinctus,A8QL51.1)。
根据生物信息学软件进行在线分析(http://www.ncbi.nlm.nih.gov/;http://cn.expasy. org/;http://www.cbs.dtu.dk/;http://psort. nibb.ac.jp/)。用DNAstar进行开放阅读框(Open Reading Frame,ORF)的查找和翻译;用BlastX在线完成cDNA序列的相似性分析;用在线工具SignalP 4.1Server、ProtParam完成信号肽和氨基酸序列的理化性质分析,用NCBI CDD、ClustalX2、SIFT、PROSITE、SWISS-MODEL进行结构域、氨基酸序列比对、氨基酸的忍受度和功能、N-糖基化位点、三级结构的预测;用MEGA5.1绘制进化树。
2 结果与讨论
2.1 中介蝮SV-LAO基因序列
利用DNAstar软件分析该基因的cDNA序列,结果表明该cDNA序列全长1 734bp,包含一个1 515bp的ORF,编码504个氨基酸残基(图1),将该基因命名为GI-LAO,GeneBank登录号为KJ705002。
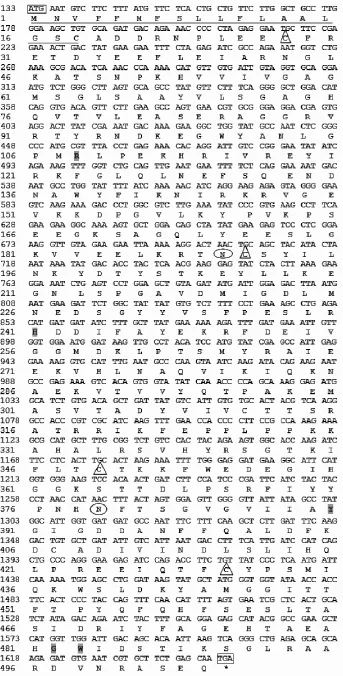
图1 中介蝮蛇毒GI-LAO的cDNA序列及编码的氨基酸序列Fig.1 The cDNA sequence and deduced amino acids of GI-LAO fromGloydius intermedius
将中介蝮GI-LAO的cDNA序列做BlastX分析,显示GI-LAO与白眉蝮、黄绿原矛头蝮、竹叶青、诺维特矛头蝮、南美巨蝮、北美侏响尾蛇、非洲锯鳞蝰、银环蛇的SV-LAOs编码的氨基酸序列一致性分别为99%、91%、92%、91%、91%、88%、83%、78%。从中可以看出,GI-LAO编码的氨基酸序列与白眉蝮GH-LAO序列相似性最高(99%),与其他几种SV-LAOs序列相似性也很高,显示不同种属蛇毒SV-LAOs基因编码的蛋白在一级结构上高度保守。
2.2 信号肽及理化性质预测
采用SignalP 4.1Server预测中介蝮GI-LAO氨基酸序列的信号肽。结果表明:中介蝮GI-LAO编码的氨基酸序列具有信号肽,可能的酶切位点在18位和19位氨基酸残基之间。因此,GI-LAO编码的氨基酸序列的信号肽为18个氨基酸残基,从第1位氨基酸残基开始到第18位氨基酸残基;成熟肽为486个氨基酸残基,从第19位氨基酸残基开始到第504位氨基酸残基。
根据http://cn.expasy.org/网站提供的蛋白质分析软件ProtParam,对GI-LAO编码的成熟肽进行理化性质的预测,结果表明该成熟肽的分子质量为55.1kDa,理论等电点为6.55,属于稳定型蛋白。
2.3 功能结构域和氨基酸位点的预测与分析
采用NCBI CDD分析GI-LAO编码的氨基酸序列的功能结构域。结果表明:GI-LAO包含两个结构域,分别是56~123位氨基酸残基对应的FAD结合域(属于NAD-binding-8结构域)和61~499位氨基酸残基对应的催化结构域(图2),该蛋白属于短链脱氢酶/还原酶(Short-chain dehydrogenases/reductases,SDR)超家族。

图2 中介蝮蛇毒GI-LAO编码的氨基酸序列的功能结构域分析Fig.2 Structure domain analysis of GI-LAO fromGloydius intermedius
由于GI-LAO与白眉蝮GH-LAO氨基酸序列相似性高达99%,因此用ClustalX2软件对GILAO与白眉蝮GH-LAO编码的氨基酸序列进行了比对,差异的氨基酸位点如表1。比较发现中介蝮GI-LAO与白眉蝮GH-LAO有4个氨基酸位点存在差异:其中第20位氨基酸残基在白眉蝮是N,在中介蝮是侧链带负电荷的D;99位氨基酸残基在白眉蝮是侧链带负电荷的D,而在中介蝮是侧链不带电荷的最小氨基酸G,另外2个位点(56位和467位)的氨基酸都属于性质相同的含分支侧链氨基酸,不会对该酶的理化性质产生影响。用SIFT软件预测GI-LAO和GH-LAO中这4个氨基酸差异位点的忍受度和功能,结果表明:这4个位点的差异均不会对GI-LAO的功能产生影响。这也提示我们在后续进行GI-LAO的生物活性检测时,可以参考白眉蝮GH-LAO的检测方法。研究表明,活性位点H223和R322对LAOs介导的催化反应是非常重要的[12]。对于本文研究的GI-LAO,这两个位点分别是H242和R343(因为含有信号肽),在进行序列比对时,也发现这两个位点是保守的。N-连接糖链对于LAOs与细胞表面的相互作用是非常重要的,它能够使相互作用区域的H2O2集中,导致细胞毒性[12]。采用PROSITE预测GI-LAO氨基酸序列的N-糖基化位点,结果表明该氨基酸序列具有两个潜在的N-糖基化位点(Asn-X-Thr/Ser,X为除脯氨酸外的任意氨基酸),分别是N190和N379;预测其底物结合位点分别为:R108、H241、Y390、G482、W483;保守半胱氨酸残基有4个,能形成两对二硫键(C28-C191和C349-C430)。
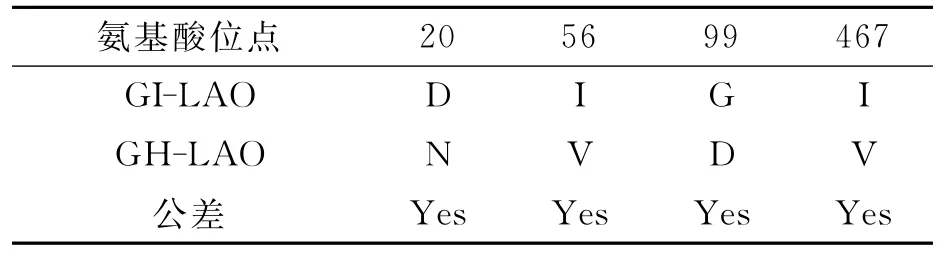
表1 中介蝮与白眉蝮SV-LAOs氨基酸序列的差异位点比较Tab.1 Comparison of the different amino acid residues between GI-LAO and GH-LAO
2.4 三级结构的预测及分析
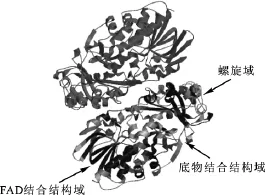
图3 中介蝮蛇毒GI-LAO三级结构图Fig.3 3-D deduced structure of GI-LAO fromGloydius intermedius
采用SWISS-MODEL在线同源建模方法,对中介蝮蛇毒GI-LAO编码的氨基酸序列进行建模。以1reoA为模板,所建模型是从第21位氨基酸残基到第504位氨基酸残基。结果(图3)表明该蛋白是由非共价键形成的同源二聚体,每个单体由22个大小不等的α-螺旋,22条β-折叠股和一些无规则卷曲、转角等形成。该蛋白每个单体含有一个FAD辅因子,形成三个结构域:FAD结合域,底物结合域以及α-螺旋域。在底物结合域和α-螺旋域之间形成一个漏斗形底物进入通道,底物进入通道后与活性位点相结合[13]。从所建的模型中也能看出这三种结构域。
2.5 GI-LAO蛋白进化分析
用MEGA 5.1软件中的MP法对GI-LAO蛋白进行进化分析,进化树各分支的置信度由Bootstrap 1000次检验,并且以银环蛇LAO氨基酸序列为外群。结果见图4,可以看出进化树主要分为两大支:银环蛇、北美侏响尾蛇、南美巨蝮和诺维特矛头蝮的SV-LAOs聚为一支;中介蝮GI-LAO与白眉蝮、竹叶青、黄绿原矛头蝮、非洲锯鳞蝰的SVLAOs聚为一支。在蝰科中,GI-LAO与蝮亚科的白眉蝮GH-LAO亲缘关系最近,序列相似性达到99%,揭示出这两种SV-LAOs的功能也非常相似。
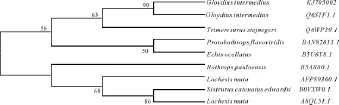
图4 用MP法计算的GI-LAO与其他氨基酸序列的进化树Fig.4 Phylogenetic tree by MP method on GI-LAO and other amino acid sequences of snakes
3 结论
蛇毒是自然界最丰富的蛋白源之一,LAO约占蛇毒总蛋白的1%~9%,尤其是在蝰科、响尾蛇科和眼镜蛇科中含量最为丰富[13]。SV-LAOs通常是FAD(黄素腺嘌呤二核苷酸)或FMN(黄素单核苷酸)结合的糖蛋白同源二聚体分子,通过催化氧化L-氨基酸产生 H2O2,与蛇毒活性和毒性密切相关[4]。通常SV-LAOs保存在4℃中性的缓冲液中,大多数SV-LAOs呈现热不稳定性,其活性与pH和缓冲液离子强度有关。目前已知的LAOs在细胞内一般由两个非共价结合的亚基组成,有些由两个分子质量相同的同源亚基组成,而有些则由两个异源亚基组成。该酶等电点pI变化也很广,从4.0~8.5(酸性、中性和碱性)均有分布,并且以酸性为主。作为一种多功能酶,近年来人们又尝试将SVLAOs作为治疗心血管疾病、细菌性疾病、肿瘤、寄生虫、病毒感染的新型药物。随着对该酶研究的深入,相信在不久的将来,它们作为药物将会在临床上发挥巨大的作用。
本文对中介蝮GI-LAO基因所做的生物信息学分析,有望为后续的生物活性及应用研究打下基础,至于其糖基化类型及程度,对氨基酸底物的选择性,催化活力大小及抗病毒能力,则有待进一步的实验证实。
[1]Izidoro L F,Sobrinho J C,Mendes M M,et al.Snake venom L-amino acid oxidases:Trends in pharmacology and biochemistry[J].Biological Medicinal Research International,2014,20(14):196754.
[2]王辉,黎肇炎,廖共山.蛇毒L-氨基酸氧化酶酶学性质及对血小板功能的影响[J].蛇志,2006(1):36-39.
[3]Tan N H,Ponnudurai G.A comparative study of the biological properties of some sea snake venoms[J]. Comparative Biochemistry and Physiology B,Comparative Biochemistry,1991,99(2):351-354.
[4]郭春梅,刘淑清,孙明忠.蛇毒L-氨基酸氧化酶的生物学作用[J].天然产物研究与开发,2012(s1):205-212.
[5]Naumann G B,Silva L F,Silva L,et al.Cytotoxicity and inhibition of platelet aggregation caused by an L-amino acid oxidase from bothrops leucurus venom[J]. Biochimica et Biophysica Acta(BBA)-General Subjects,2011,1810(7):683-694.
[6]Izidoro L F,Ribeiro M C,Souza G R,et al.Biochemical and functional characterization of an L-amino acid oxidase isolated from bothrops pirajai snake venom[J]. Bioorganic &Medicinal Chemistry,2006,14(20):7034-7043.
[7]Singer T P,Kearney E B.The L-amino acid oxidases of snake venom.II.Isolation and characterization of homogeneous L-amino acid oxidase[J].Archives Biochemistry and Biophysics,1950,29(1):190-209.
[8]Wellner D,Meister A.Crystalline L-amino acid oxidase of Crotalus adamanteus[J].The Journal of Biological Chemistry,1960,235:2013-2018.
[9]余志良,周宁,乔华.L-氨基酸氧化酶的研究进展[J].中国生物工程杂志,2012(3):125-135.
[10]杨章民.陕西延安中介蝮的初步研究[J].陕西师范大学学报:自然科学版,2007,35(1):87-89.
[11]杨章民,王喆之,侯彬,等.中介蝮毒腺cDNA文库的构建及初步分析[C]∥第八届中国生物毒素学术研讨会论文集.南宁,2007:12-15.
[12]Bregge-Silva C,Nonato M C,de Albuquerque S,et al. Isolation and biochemical,functional and structural characterization of a novel L-amino acid oxidase from Lachesis muta snake venom[J].Toxicon,2012,60(7):1263-1276.
[13]Guo C,Liu S,Yao Y,et al.Past decade study of snake venom L-amino acid oxidase[J].Toxicon,2012,60(3):302-311.
〔责任编辑 王 勇〕
Bioinformatics analysis of SV-LAO gene fromGloydius intermedius
ZHANG Cui,GUO Jifang,SUN Yue,WANG Fangxia,YANG Zhangmin*
(School of Life Sciences,Shaanxi Normal University,Xi′an 710119,Shaanxi,China)
A snake venom L-amino acid oxidase(SV-LAO)gene fromGloydius intermedius cDNA library was bioinformatically analyzed.The results showed that the open reading frame of cDNA is 1 515bp,encoding 504amino acids.The primary structures of LAOs between Gloydius halys and Gloydius intermedius showed the highest identity(99%).The N-terminal 18amino acids is the signal peptide,so the mature peptide contains 486amino acids,with the theoretical molecular weight and isoelectric point being 55.1kDa and 6.55,respectively.GI-LAO contains two domains,ie.FAD binding domain and catalytic domain.A comparison of the primary structures between GI-LAO with GH-LAO(LAO of Gloydius halys)revealed that there are four amino acids differences(20,56,99and 467).Online analysis with SIFT software indicated that these differences have no influence on the function of GI-LAO.The key residues in the active site are H242 and R343.The potential N-glycosylation sites are N190and N379.Five residues(R108,H241,Y390,G482,W483)form the substrate binding sites.The four conserved Cys residuces are presumably to form two disulfide bonds(C28—C191and C349—C430).Tertiary structure remodel-ling revealed that GI-LAO is composed of 22ɑ-helixes,22β-strands,turns and loops,which may then refold into three domains(the FAD-binding domain,the substrate-binding domain and theαhelical domain).The GI-LAO protein phylogenetic tree indicates a closest relationship between Gloydius halys and Gloydius intermedius.These bioinformatical analysis would lay the foundation for further investigation of GI-LAO as anti-viral agent.
Gloydius intermedius;L-amino acid oxidase;gene;bioinformatics
Q811.4;Q71
:A
1672-4291(2015)05-0071-05
10.15983/j.cnki.jsnu.2015.05.355
2015-02-16
国家自然科学基金(30870303);中央高校基本科研业务费专项资金(GK200902029);国家大学生创新训练计划
(CX14067)
张翠,女,硕士研究生,主要研究方向为应用微生物学。E-mail:zhangcui@snnu.edu.cn
*通信作者:杨章民,男,副教授,博士。E-mail:yzhangmin@snnu.edu.cn
