饮食中的miRNAs及其对摄食者机体代谢调控的研究进展
2015-06-05高贵田徐雅芬张晓萍
高贵田,徐雅芬,张晓萍,朱 丹
(陕西师范大学食品工程与营养科学学院,陕西西安710119)
饮食中的miRNAs及其对摄食者机体代谢调控的研究进展
高贵田,徐雅芬,张晓萍,朱 丹
(陕西师范大学食品工程与营养科学学院,陕西西安710119)
miRNAs(microRNAs)是一类内源性非编码单链RNAs,广泛存在于真核生物和病毒中,通过与目标mRNAs分子的3′端非编码区域的碱基进行互补配对,引起靶miRNAs降解或抑制其翻译,来实现对基因进行转录后的表达调控。本文对植物性miRNAs对动物代谢调控的影响、乳品中miRNAs对胎儿机体代谢调控的影响进行了梳理,使人们了解饮食miRNAs作为一种信号分子在细胞间传导、调控并影响摄入者的生理机能以及病理表现的作用机制,进而为研究食品营养与食品贮藏、加工提供新的思路。
miRNAs;植物;跨物种;代谢调控;饮食
miRNAs(microRNAs)即微小核糖核酸,是一种内源性非编码单链RNA,长度为20~24个核苷酸,在真核生物和病毒中广泛存在。miRNAs与目标mRNA分子的3′端非编码区域的碱基进行互补配对,通过引起靶miRNAs的降解或抑制其翻译,实现对基因表达的调控[1]。
大量研究表明:miRNAs参与有机体内多种信号传导、胚胎干细胞发育、胚胎后期发育、细胞的增生、分化、凋亡,胰岛素的分泌、血管的生成、肿瘤的发生及形成、免疫应答等。文献[2]研究发现,在水稻、玉米等植物中广泛存在的miR168a可以进入动物体内并能够抑制人或小鼠肝的低密度脂蛋白受体适配蛋白1的表达,降低低密度脂蛋白含量。该研究开辟了miRNAs研究的新纪元,再次使miRNAs研究成为学术界关注的焦点,为研究食品中miRNAs对人体代谢、人类疾病的影响及认识食品营养与功能提供了新的思路。本文综述食品中miRNAs的研究进展,以期为深入研究食品中miRNAs功能提供参考。
1 外源miRNAs能在动物体中稳定存在的前提
1.1 外源miRNAs存在于细胞外小泡体
细胞外小泡体(Extracellular Vesicles,EVs)是机体内细胞分泌的一种由磷脂双分子层包裹的圆形的特殊微粒小泡体,可以进入细胞外环境。细胞释放小泡体这一现象几乎存在于所有生物个体中,是一个普遍且进化保守的过程[3-4]。细胞把miRNAs包裹进入小泡体中,然后由EVs运输到相应的受体细胞,并可调节受体细胞的基因表达,从而影响生物体的生理功能。研究发现被包裹进EVs的miRNAs具有极强的稳定性,以一种非常稳定的状态存在,可以保护miRNAs在高温、冷冻、酸性、冻融和外源RNA酶处理等不同的极端理化条件下免受内源性RNA酶的降解作用[1]。
1.2 miRNAs与蛋白质结合的复合体
研究发现,细胞外miRNAs的存在形式并非只有细胞外小泡体这一种形式,其形式是混杂多样的。在细胞外,还有另一种miRNAs的存在形式,即通过与4个AGO2蛋白质联系,形成稳定的复合体而存在于血液、血浆和细胞培养液中[5-7]。运用差速离心、纳米过滤、免疫沉淀、分子排阻色谱等方法研究证明,绝大多数细胞在正常状态下所输出的miRNAs并不在小泡体膜泡中。外源miRNAs在动物体中稳定存在的具体机理和过程还尚未研究清楚,有待进行更深入的研究。
2 植物性食物中miRNAs的跨物种调控作用
2.1 植物性食品中miRNAs的种类与含量
植物miRNAs与动物miRNAs最重要的差别在于,植物miRNAs可在甲基转移酶HEN1的作用下,使双链miRNAs 3′端最后一个核苷酸的核糖2′或3′碳原子上发生甲基化修饰。现有的研究发现甲基化基团能增强miRNAs的稳定性,阻止转移酶、聚合酶的活性[8],保护其不受核酸外切酶的降解,同时阻止其被尿苷化,从一定程度上抵抗外源酶,增强其稳定性[9]。并非所有植物miRNAs都可以通过跨物种的方式进入动物体内发挥功能,不同植物物种中相同的miRNAs含量也有较大差异,文献[2]运用高通量测序和RT-PCR法检测了水稻、大豆、玉米种子内源miRNAs的种类及含量,结果如表1所示。
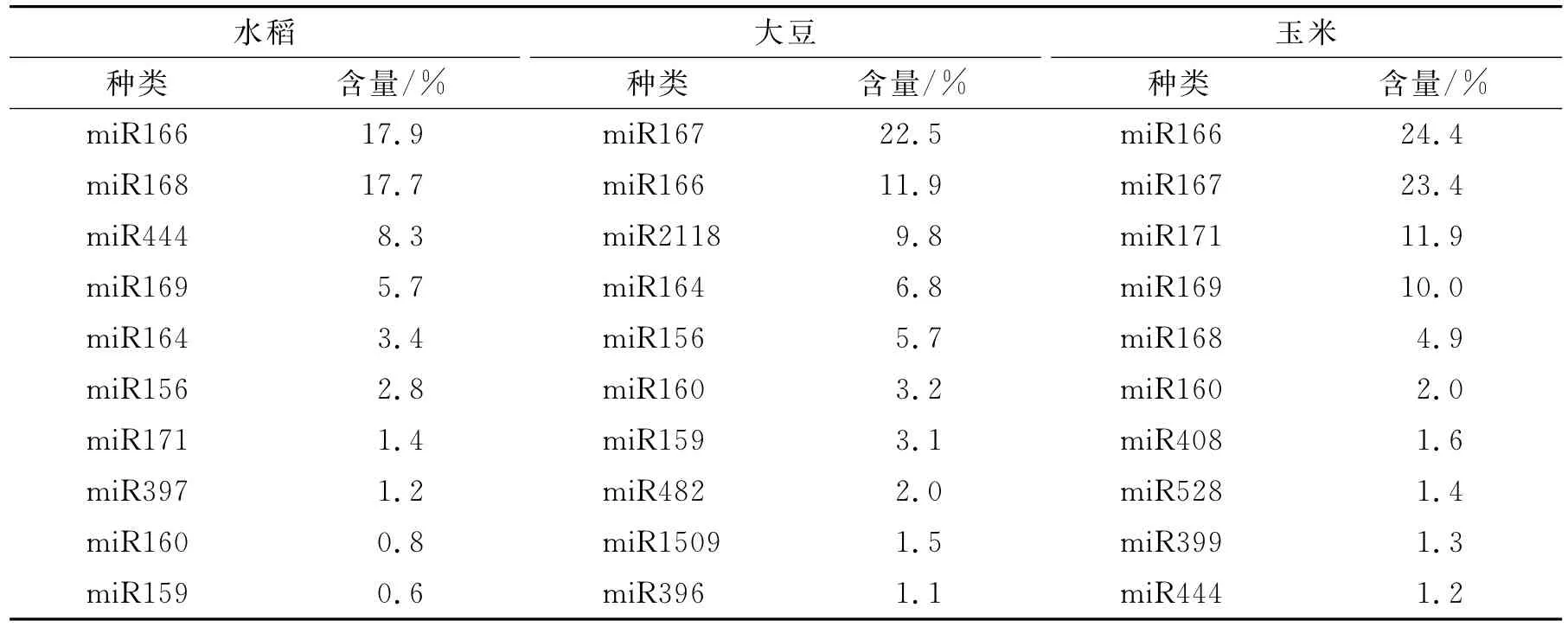
表1 三种植物性食物中主要miRNAs的种类及含量Tab.1 Abundant miRNAs in rice,soybean and corn seeds
由表1可以看出,不同的植物物种所含有的miRNAs种类和含量不尽相同,有一些miRNAs在植物中是普遍存在的,如:miR166、miR160、miR168、miR159等,其含量也与植物自身代谢有关,如在植物病毒烟草花叶病毒胁迫下,miR168在本氏烟(Nicotiana Benthamiana)中的含量就会显著下降[10]。文献[11]收集了大量关于植物miRNAs的相关数据,笔者选取部分和食品有关的植物性miRNAs数据,如表2所示。
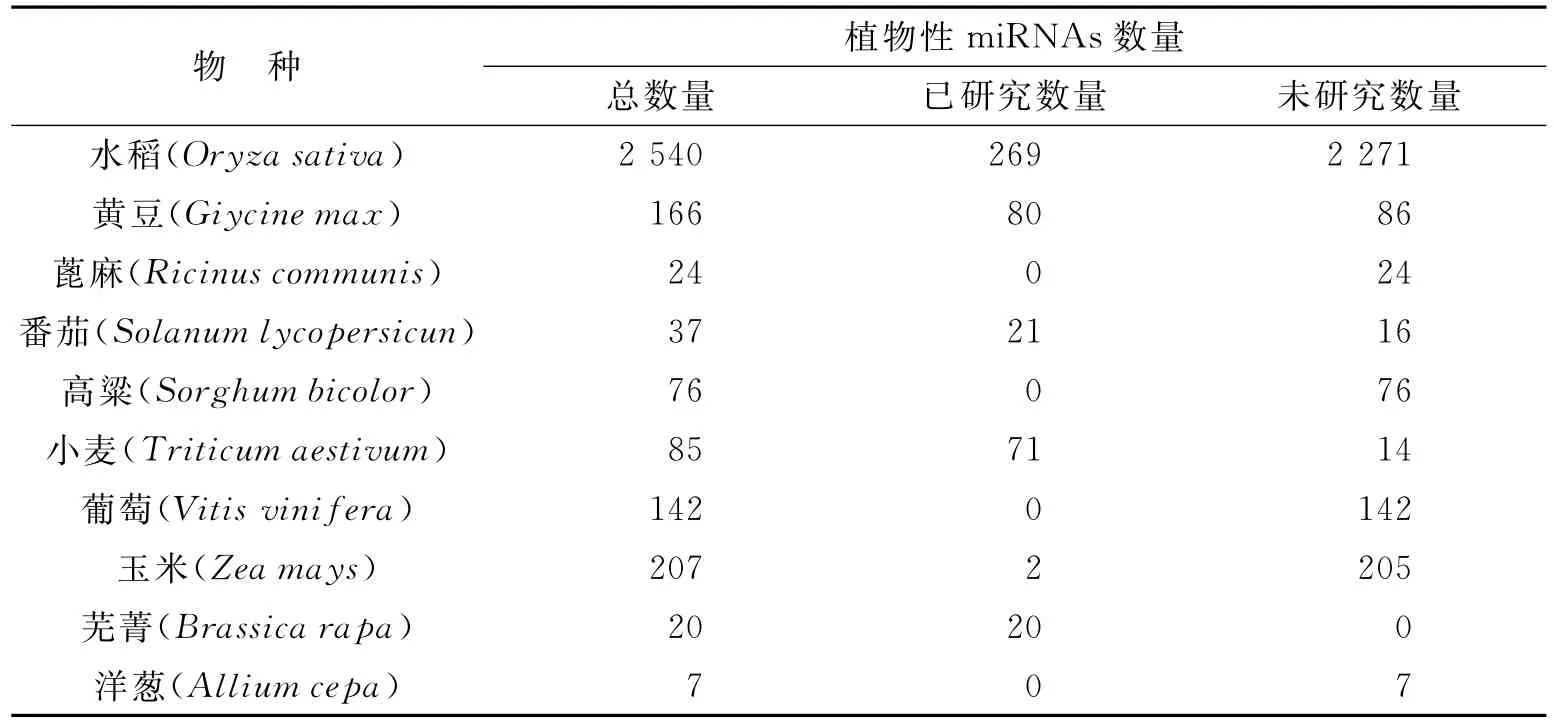
表2 植物性食物中已发现的miRNAs的数据统计Tab.2 Statistics of miRNAs which have been discovered in plant foods
植物miRNAs的种类与含量对跨物种研究具有重要作用,需要进行大量的普查工作。文献[2]也是在2 000多种植物miRNAs中选出了30~50种浓度较高的miRNAs进行研究,其中具有生物功能的miRNAs只有几种,因此对植物miRNAs的针对性研究具有重要意义。本文只选取了一部分,更多有关植物性miRNAs的资源可参阅miRNAs数据库http://www.miRbase.org。
2.2 不同加工方式对植物miRNA的影响
我国居民一般习惯将食物熟食,而不同的加工方式对植物中miRNAs的含量具有不同的破坏作用,直接影响到植物miRNAs的跨物种调控作用。文献[7]以新鲜玉米为材料,利用qRT-PCR法研究了100℃沸水煮新鲜玉米20min、180℃烘干4h、65℃恒温烘干24h和膨化后的玉米片4种加工方式,对玉米中18个miRNAs绝对表达差异的影响,结果显示,在测序筛选出来的18个玉米miRNAs中,miR167e的含量最高,表达量高达2 374.53 fmol/g,miR162a最低,仅有0.78fmol/g。新鲜玉米经过加工处理以后,检测18个玉米miRNAs,发现表达量均有下降的趋势,按照物理加工对miRNAs的破坏程度进行排序,可知膨化玉米片 > 烘干玉米>煮熟玉米,与玉米miRNAs的荧光定量得到的结果相一致。
2.3 不同动物的组织器官中存在植物miRNAs
文献[2]利用公开的sRNA数据库,分析了人、小鼠、猴、鸡、家猪、蚕等动物体的心脏、肝脏、脾脏、肺部、肾脏等不同器官中植物miRNAs的存在情况,结果表明:植物miRNAs也能够在人、小鼠、猴、鸡、家猪、蚕等动物体的心脏、肝脏、脾脏、肺部、肾脏等不同器官中稳定的存在。尤其miR168和miR156的丰度较高。
2.4 植物性miRNAs在动物体中的表达与传递
文献[2]研究发现,在水稻、玉米等植物中广泛存在的miR168a可以进入动物体内并对动物基因进行调控。通过高通量测序法发现,在中国人血液中含有一定量的外源miRNAs,经PCR技术检测,这些外源性的miRNAs的3′端尾部具有甲基化特征,这就说明了这些外源的miRNAs是植物miRNAs,其中以miR156a、miR168a等含量最高。该研究提出一种全新miRNAs调控模式,即动物体在摄入植物时,这些原本存在于植物中的外源性miRNAs依然可以在细胞外小泡体的包裹下,在动物体中稳定存在,并且对原生物体进行生理调控,即跨物种调控机制。
随后通过qRT-PCR检测到除了人类以外的食草动物,如牛、马、兔等动物的血清中也存在外源性植物miRNAs,其中miR156a和miR168a广泛存在于各个动物体中[12]。在小鼠各组织器官中,包括心、肺、肾、脑、小肠等,也都可以检测到植物性miRNAs。研究还发现,外源性miR168a能够抑制人或小鼠肝的低密度脂蛋白受体适配蛋白1的表达,可降低动脉粥样硬化的发病率[13]。
有研究者以猪为模型,采用miRNAs荧光定量方法检测到猪的血清和组织中存在植物miRNAs,并且外源植物miR164a、miR168a和miR167e在猪的组织和血清中含量较高[1]。Stem-loop RT-PCR结果显示,猪的血清中植物miRNAs浓度为0.01~0.15fmol/g,大约是内源miR-16浓度的十分之一;猪的器官组织中植物miRNAs浓度为0.001~0.5fmol/g,大约是内源miR-16浓度的千分之一。此外,在猪的血清小囊体中也能检测到植物miRNAs,但不能检测到前体。由此推测,小囊体可能是保护外源植物miRNAs进入动物体的一种方式[8]。深入研究还发现,母猪体内植物miRNAs还可以通过母乳传递给胎儿,在胎儿各组织中也能检测到植物miRNAs,平均丰度为动物内源miRNAs的0.4%。在胎儿的脾、大脑和眼肌中丰度最高,肾、肝、肺次之,心最低,脐带血和羊水中平均值差异不大。其中以miR164a和miR168a的丰度最高。同时还检测到母猪血清、胎儿血清和羊水这3个样品的小囊体中均存在植物miRNAs。其中miR164a含量最高,分别为原样品中丰度的49.8%、52.7%和68.3%,其次是miR168a,在胎儿血清和羊水中分别为原样品的45.5%和86.8%。以上结果说明外源性植物miRNAs能够由母体传递给胎儿[14]。
2.5 植物多酚通过miRNAs对生物体内脂质代谢的影响
植物多酚是最常见的一大类植物抗氧化活性物质,可通过miRNAs来调控动物体内脂肪酸和胆固醇的代谢。文献[15]以小鼠为动物模型发现,高脂肪的膳食会刺激动物体内miR-103和miR-107表达的升高,摄入玫瑰茄多酚提取物可以有效使miR-103和miR-107水平降低,同时玫瑰茄多酚提取物还可以显著抑制miR-122的表达,从而调控与脂肪酸代谢相关的基因,起到降脂作用。文献[16]设计了雄性Wistar大鼠摄入猪油(2.5mL/kg体重)或含有葡萄籽原花青素提取物的猪油(250mg/kg体重)的急性实验,研究发现葡萄籽原花青素能够显著降低雄性Wistar大鼠血液中甘油三酯、肝脏中总胆固醇和总甘油三酯的含量,剂量大鼠组肝脏中miR-33的表达较对照组降低,其靶基因ABCA1表达水平升高,高密度脂蛋白含量显著增加,这提示,葡萄籽原花青素可实现对胆固醇代谢的调节作用,其机理是通过下调miR-33基因的表达,提高靶基因ABCA1的表达水平。文献[17]以高脂肪膳食喂饲的小鼠为实验对象,通过miRNAs基因芯片技术研究了槲皮素、花青素、原花色素、儿茶素和咖啡酸等9种植物多酚对小鼠体内miRNAs表达的影响。发现不同酚类物质对小鼠体内miRNAs种类和表达水平的影响差异较大。
植物多酚可以通过影响动物体内某些miRNAs的表达或下调来达到调节机体脂质代谢的作用。但目前的研究主要涉及多酚的摄入对于miRNAs含量变化的影响,对于不同种类多酚之间的共同作用还未涉及;缺少多酚对调节脂代谢相关的miRNAs网络系统的研究。
3 人乳中miRNAs在胎儿中的表达与传递
目前,动物性食品的研究中以乳汁中的miRNAs研究最为广泛。哺乳动物的乳汁中会含有miRNAs,miRNAs通过哺乳传给新生个体,对新生个体的生长发育有调控作用,尤其对新生个体的免疫具有重要意义。
研究人乳发现,在哺乳期的前6个月,乳汁中的miRNAs大多与婴儿免疫相关且含量较高,随着时间的推移,其在乳汁中的含量逐渐下降[18]。科学家猜测乳汁中小囊体包裹的miRNAs可通过哺乳过程进入新生个体。文献[19]采用miRNAs芯片筛选人母乳中的miRNAs,结果检测到母乳中含有281个miRNAs,发现11个miRNAs(miR-181a、miR-181b、miR-155、miR-17、miR-92a、miR-150、miR-125b、miR-146a、miR-146b、miR-223、let-7i)与婴儿免疫发育有关。在骨髓B淋巴细胞中表达的miR-181,可促进B细胞的分化,但一旦其在造血干细胞中表达紊乱,则会导致B细胞破碎、B细胞分化的过程被破坏,导致白血病的发作[20]。miR-155是一种致癌miRNAs,其下调表达可促进瘤细胞的迁移[21]。miR-146a和miR-146b的表达会受到多种微生物环境和促炎细胞因子的诱导,这种诱导的表达依赖于NF-kappaB蛋白,miR-146启动子区域可结合该蛋白从而调控miRNAs的表达[22]。miR-223分别与两个转录因子NFI-A(抑制miR-223的表达)和C/EBPalpha(促进miR-223的表达)相互作用,参与人类粒性白细胞的分化调控。NFI-A与miR-223启动子结合可实现miR-223表达水平的下调;而C/EBPalpha与miR-223启动子结合可促使miR-223表达水平的上调。miR-223还能通过负反馈方式抑制NFI-A的翻译,促进C/EBPalpha与miR-223结合,促进粒性细胞分化[23]。
文献[23]釆用高通量测序法筛选人母乳中miRNAs,结果检测到母乳中miRNAs共602个,59个miRNAs与新生个体的免疫器官发育和免疫功能的调节有关,其中miR-148a-3p、miR-30b-5p、LET-7f-l-5p、miR-146b-5p、miR-29a-3p、let-7a-2-5p、miR-141-3p、miR-182-5p、miR-200a-3p、miR-378-3p含量最丰富,占检测到的602个miRNAs总量的62.3%。其中4个含量丰富的miRNAs,分别为miR-30b-5p、miR-146b-5p、miR-29a-3p和miR-182-5p,与新生个体免疫器官发育和免疫功能的调节关系最为密切。更重要的是,研究发现这些小囊体中miRNAs在不同的极端环境下(如低温、高温、反复冻融、Rnase A和T1)仍具有稳定性。
4 药食同源物植物中miRNAs在动物体中的表达
miRNAs与中医药很多研究领域相契合。由于miRNAs可以在体液和细胞间转移,当局部出现病情,病理组织周围的体液或血液中的miRNAs可以进入全身的体液和血液循坏中,这与中医的整体观相吻合,故miRNAs在中医中药领域的研究与应用较多。
丹参、生地黄、三七作为药食同源两用植物是中国卫生部批准的保健食品,文献[24]通过Northern印迹杂交(Northern blot)验证丹参中有2种miRNAs在服用后会存在于人体中,生地黄中有6种miRNAs可进入人体血液,分别为miR5140、miR5137、miR5138、miR5139、miR5141、miR5142。三七总皂苷(PNS)为三七的主要成分,具有多种生物活性。文献[25]以大鼠为实验对象,建立急性心肌梗死模型,分两组,一组注射PNS,另一组作对照,2d后,取大鼠心肌组织进行miRNAs的表达检测,实验在PNS组中筛选出17个与急性心肌梗死相关的miRNAs,发现PNS治疗后有2个miRNAs表达上调,分别为miR-466和miR-126。
5 展望
近年来涌现了大量miRNAs的研究论文,尤以研究内源性miRNAs表达与人类肿瘤关系的报道居多,虽然也有对食物中miRNAs对人体作用的研究,但是关于miRNAs跨物种调控、不同加工方式对食物中miRNAs的影响以及miRNAs在哺乳动物体内不被降解并且稳定存在的研究并不多见。现有的关于跨物种的文献中还是以南京大学张辰宇教授的研究最为全面和权威,也有研究员对此提出质疑,文献[26]在试验中给猕猴喂食豆制品,并在喂食前后的不同时段对猕猴血液中的植物miRNAs进行检测,虽然发现了一些低水平的植物miRNAs扩增,但是并不稳定,与饮食量也没有线性关系。由于该文实验动物较少,且研究的食物种类和miRNAs种类有限,能否作为反对miRNAs跨物种调控的证据还有待研究。我国四川大学近年以猪为实验对象,研究显示,外源植物miR164a、miR168a和miR167e在猪的组织和血清中含量较高,并且这些外源性miRNAs可通过母乳传递给胎儿。但这些外源性miRNAs对胎儿体内的代谢是否具有调控作用并未提及。同时,猪乳中仅仅是检测到了和胎儿免疫器官有关的miRNAs,这些miRNAs对胎儿的直接作用并未有深入研究,还都局限于猜测。其次,关于miRNAs在哺乳动物体内不被RNA酶降解的机制尚不清楚,还需深入研究。
随着食物中miRNAs研究的深入,可专门建立一个食物的miRNAs文库,随着文库的不断完善,可将不同食物中某个特异性的miRNA设为对该食品质检的指标,通过建立各种食物的miRNA指纹图谱,达到检测食品安全性的目的,同时由miRNA丰度预估该成分在其他复合食品中的含量,从而为打击食品造假提供重要依据。现有关于食物中的miRNAs研究并不完善,由于各地域之间食物种类不同,种属之间具有差异性,miRNA指纹图谱的建立还需要大量的基础工作,随之而来的miRNA大量快速的检测方法也需要革新和改进,现有的miRNAs的主要检测手段为高通量测序、基因芯片和q-PCR,但由于高通量测序和基因芯片技术的花费成本较高,q-PCR技术无法区分miRNAs的前体和成熟体,因而使用受到限制,急需建立一种检测迅速、灵敏、价格低廉的检测方式。
最后,miRNAs的研究还有可能揭示不同饮食习惯对人体的影响,以及由此表现出的不同生理特征以及病理表现等,为合理膳食提供依据。此外,由于植物miRNAs可通过哺乳动物的消化吸收以完整miRNAs进入体内并调控靶基因表达,调控代谢,因此转基因食品的安全性受到了更广泛的争议。笔者认为,就现有研究来说还无法对转基因食品是否安全这一问题进行定论,植物性miRNA在哺乳动物体内发挥代谢调控肯定自古有之,这种代谢调控与人类现有的某些疾病的关系还需更加广泛和深入的研究。并不是所有植物性的miRNAs都可以在哺乳动物体内稳定存在,能参与有机体调控的植物性miRNAs更少,转基因食品中的miRNAs是否会在人体内存在并发挥调控作用,以及该调控是否一定会有致畸致残致癌的危险,转入的外源基因对原有miRNAs的合成是否会破坏作用,转基因食品和原有食品相比miRNAs种类及含量是否有变化,都还需要大量基础性的研究。
[1]张顺华.猪不同泌乳期乳汁Exosome中microRNA转录组的鉴定和表达谱分析[D].成都:四川农业大学动物遗传育种研究所,2013.
[2]Zhang L,Hou D.Exogenous plant miR168aspecifically targets mammalian LDLRAP1:Evidence of cross-king dom regulation by microRNA[J].Cell Research,2012,22(1):107-126.
[3]Conde-Vancells J,Rodriguez-Suarez E,Embade N,et al.Characterization and comprehensive proteome profiling of exosomes secreted by hepatocytes[J].Journal of Proteome Research,2008,7(12):5157-5166.
[4]van der Pol Edwin,Boing Anita N,Harrison Paul,et al.Classification,functions,and clinical relevance of extracellular vesicles[J].Pharmacological Reviews,2012,64(3):676-705.
[5]Price,Daniel R G,Gatehouse,et al.RNAi-mediated crop protection against insects[J].Trends in Biotechnology,2008,26(7):393-400.
[6]Strickland D K,Gonias S L,Argraves W S.Diverse roles for the LDL receptor family[J].Trends in Endocrinology and Metabolism,2002,13(2):66-74.
[7]母治平.猪体内食物源性植物miRNAs的鉴定[D].成都:四川农业大学动物遗传育种研究所,2013.
[8]Chen Caifu,Ridzon Dana A,Broomer Adam J,et al. Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nucleic Acids Research,2005,33(20):el79-el79.
[9]Li Junjie,Yang Zhiyong,Li Yubin,et al.Methylation protects miRNAs and siRNAs from a 3′-end uridylation activity in Arabidopsis[J].Current Biology,2005,15(16):1501-1507.
[10]Gu Yiren,Li Mingzhou,Wang Tao,et al.Lactationrelated microRNA expression profiles of porcine breast milk exosomes[J].PLoS One,2012,7(8):e43691.
[11]Zhang Zhenhai,Yu Jingyin,Li Daofeng,et al.PMRD:Plant microRNA database[J].Nucleic Acids Research,2010,38(s1):806-813.
[12]Price,Daniel R G,Gatehouse,et al.RNAi-mediated crop protection against insects[J].Trends in Biotechnology,2008,26(7):393-400.
[13]Strickland,Dudley K,Gonias,et al.Diverse roles for the LDL receptor family[J].Trends in Endocrinology&Metabolism,2002,13(2):66-74.
[14]李清芝.植物miRNAs在猪母体和胎儿间传递的研究[D].成都:四川农业大学动物遗传育种研究所,2013.
[15]Joven,Jorge,Espinel,et al.Plant-derived polyphenols regulate expression of miRNA paralogs miR-103/107 and miR-122and prevent diet-induced fatty liver disease in hyperlipidemic mice[J].Biochi Biophys Acta,2012,1820(7):894-899.
[16]Baselga Escudero,Laura,Blade,et al.Grape seed proanthocyanidins repress the hepatic lipid regulators miR-33and miR-122in rats[J].Molecutar Nutrition & Food Research,2012,56(11):1636-46.
[17]Milenkovic D,Deval C,Gouranton E,et al.Modulation of miRNA expression by dietary polyphenols in apoE deficient mice:A new mechanism of the action of polyphenols[J].PLoS One,2012,7(1):e29837.
[18]Arroyo J D,Chevillet J R,Kroh E M,et al.Argonaute2complexes carry apopulation of circulating microRNAs independent of vesicles in human plasma[J]. Proceedings of the National Academy of Sciences,2011,108(12):5003-5008.
[19]Ambros V.The functions of animal microRNAs[J]. Nature,2004,431(7006):350-355.
[20]Zern T L,Wood R J,Greene C,et al.Grape polyphenols exert a cardioprotective effect in pre-and postmenopausal women by lowering plasma lipids and reducing oxidative Stress[J].The Journal of Nutrition,2005,135(8):1911-1917.
[21]Chan L S,Yue P Y,Mak N K,et al.Role of MicroRNA-214in ginsenoside-Rg1-induced angiogenesis[J]. European Journal of Pharmaceutical Sciences,2009,38(4):370-377.
[22]Fazi,Francesco,Rosa,et al.A minicircuitry comprised of microRNA-223and transcription factors NFI-A and C/EBP alpha regulates human granulopoiesis[J].Cell,2005,123(5):819-831.
[23]Zhou Q,Li M,Wang X,et al.Immune-related microRNAs are abundant in breast milk exosomes[J].International Journal of Biological Sciences,2012,8(1):118-123.
[24]王宇亮,王颖芳,杨泽民,等.丹参、生地黄中miRNA在人体血液中分离、鉴定及表达分析[J].中国实验方剂学杂志,2012,18(19):121-124.
[25]刘咏梅,虞桂,张云,等.三七总皂苷对急性心梗大鼠心肌miRNA表达谱的影响及功能分析[C]//2011年中华中医药学会心病分会学术年会暨北京中医药学会心血管病专业委员会年会论文集,2011.
[26]Witwer,Kenneth W,McAlexander,et al.Real-time quantitative PCR and droplet digital PCR for plant miRNAs in mammalian blood provide little evidence for general uptake of dietary miRNAs:Limited evidence for general uptake of dietary plant xenomiRs[J].RNA Biolog,2013,10(7):1080-1086.
〔责任编辑 宋轶文〕
The research progress of miRNAs regulate feeder physiological function in diet
GAO Guitian,XU Yafen,ZHANG Xiaoping,ZHU Dan
(School of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi′an 710119,Shaanxi,China)
MicroRNAs are a class of non-coding endogenous single-stranded RNAs,which widely exist in eukaryotes and viruses.They function in post-transcriptional regulation and expression of genes by base-pairing with complementary sequences of the 3′non-coding region of target mRNAs molecules,which result in either target mRNAs degradation or translational inhibition.It is summarized that the research advances of miRNAs which include the plant miRNAs effect on animal body metabolism regulation and miRNAs in dairy products influence metabolic regulation on the fetus.The thesis aims to make people understand the mechanism of microRNAs as a kind of signal molecules which conduct between cells,regulate and influence the intake′s physiology and pathology,and then provide new thought for research and treatment of metabolic disorder diseases such as diabetes at the genetic level for researchers.
miRNAs;plant;cross-kingdom;metabolism regulation;diet
TS20
:A
1672-4291(2015)05-0103-06
10.15983/j.cnki.jsnu.2015.05.156
2015-05-18
陕西省科技统筹创新工程计划项目(2012KTJD03-05)
高贵田,男,副教授,主要研究方向为食品生物技术。E-mail:gaoguitian2006@snnu.edu.cn
