2 3 7例血培养阳性结果分析
2015-06-05陈梅莲邓任堂李柳燕李金洳付文金
陈梅莲,邓任堂,李柳燕,李金洳,付文金
(广东医学院附属厚街医院检验科,广东 东莞523945)
近年来,随着创伤性诊疗技术的广泛开展以及广谱抗生素、激素的广泛应用,血流感染的发病率有逐年增高趋势[1]。为此,我们对东莞市厚街医院2013年1月-2014年12月血培养阳性病原菌的种类分布及耐药特征进行了回顾性分析。
1 材料与方法
1.1 菌株来源 2013年1月-2014年12月来自我院各科室住院患者自一个皮肤穿刺点抽取的血液标本,送检的标本2460份,剔除重复阳性例数,共分离培养获得病原菌237株。
1.2 仪器与试剂 用美国VersaTREK全自动血培养仪及配套血培养瓶,美国西门子公司MicroScan A/S-4自动细菌鉴定及药敏分析系统。哥伦比亚血琼脂培养基、麦康凯琼脂培养基、巧克力琼脂培养基和沙保弱真菌培养基等购自广州迪景科技有限公司。
1.3 质控菌株 大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 25923和铜绿假单胞菌ATCC 27853,均购自广东省临床检验中心。
1.4 标本采集 在患者寒战发作、抗菌剂治疗前,或下一次抗菌剂使用前,无菌采集静脉血注入血培养瓶中。成人采血5~10ml,儿童采血1~5ml,混匀。
1.5 细菌培养及分离 将血培养瓶置于VersaTREK全自动血培养仪中。血培养仪连续监测7天未提示阳性,转种仍无细菌生长视为阴性。仪器报警阳性,及时转种血琼脂和麦康凯培养基,必要时转种巧克力琼脂及沙保弱培养基,置37℃、5%CO2温箱培养18~24h。
1.6 菌株鉴定及药敏试验 菌株采用MicroScan A/S-4自动微生物分析系统进行鉴定及药敏试验,根据临床实验室标准化协会(CLSI)2012年标准判读药敏结果[2]。所有检测过程严格按照操作规程进行[3]。
1.7 统计学处理 数据采用WHONET 5.6软件进行分析。
2 结果
2.1 菌种构成 2460份血培养标本中共分离出致病菌237株,检出率9.6%。其中革兰阴性杆菌114株,占48.1%;革兰阳性球菌111株,占46.9%;革兰阳性杆菌6株,占2.5%;真菌6株,占2.5%。居前5位的病原菌依次为凝固酶阴性葡萄球菌(CNS)76株(32.1%),大肠埃希菌 69株(29.1%),肺炎克雷伯菌19株(8.0%),金黄色葡萄球菌11株(4.6%)和肠球菌9株(3.8%)。见表1。
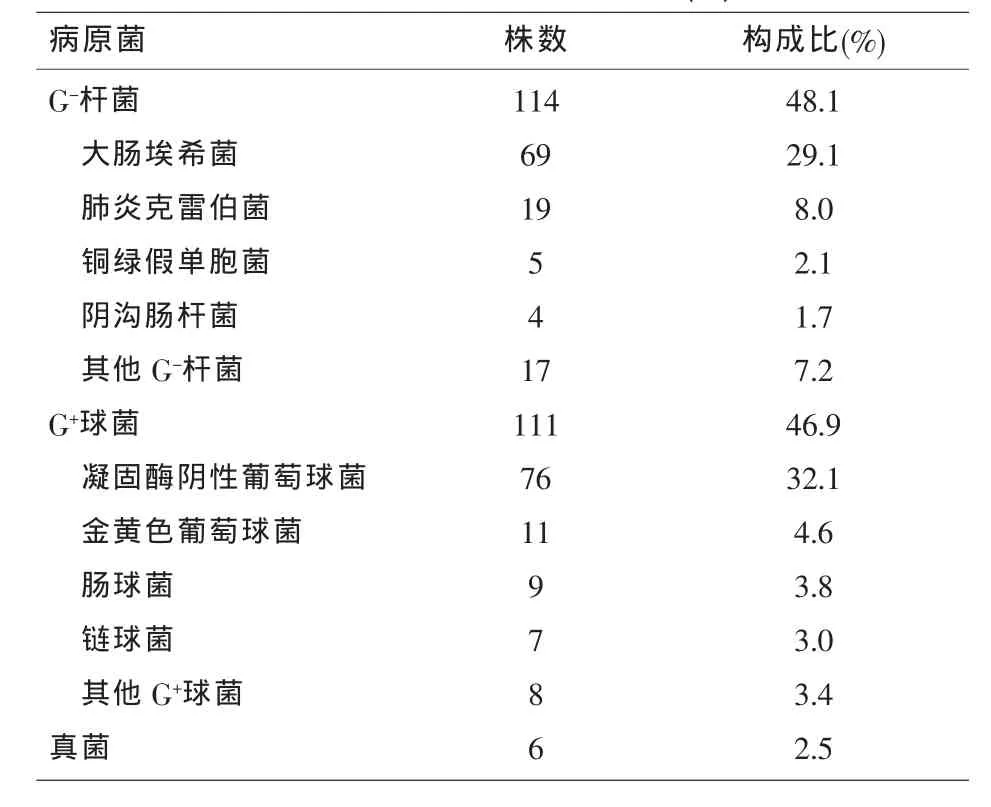
表1 医院感染病原菌构成比(%)
2.2 临床科室分布 237例阳性病原菌在临床各科室的分布,居前三位分别是ICU、普外科及呼吸内科。见表2。
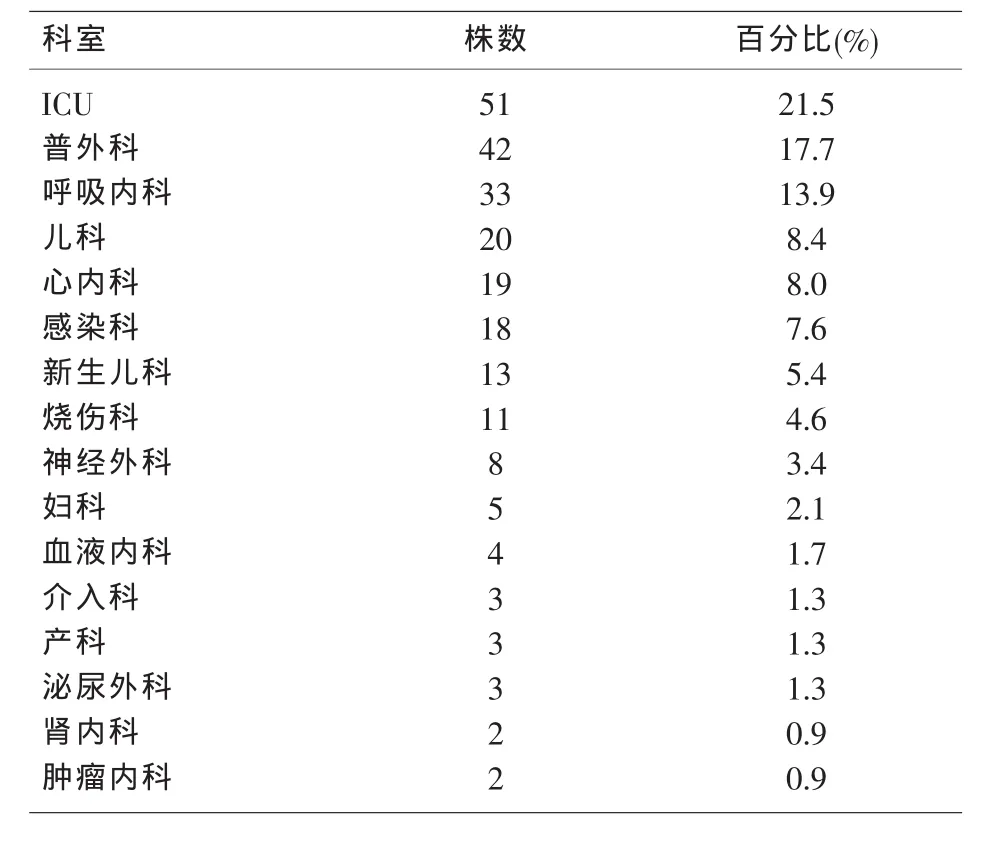
表2 血培养阳性菌的科室分布
2.3 主要革兰阴性杆菌的耐药特征 大肠埃希菌和肺炎克雷伯菌是革兰阴性杆菌中分离率较高的细菌,其产超广谱β-内酰胺酶(ESBLs)的检出率分别为31.9%和52.6%,对青霉素类药物产生高耐药率(均>60%)。大肠埃希菌对氨基糖苷类、喹诺酮类、磺胺类及四环素类药物的耐药率均高于肺炎克雷伯菌,但两者均对含酶抑制剂的抗菌药物、丁胺卡那霉素及头孢西丁耐药率较低,未发现对碳氢酶烯类耐药的肠杆菌科细菌。铜绿假单胞菌对各种抗生素表现较高的敏感性。见表3。
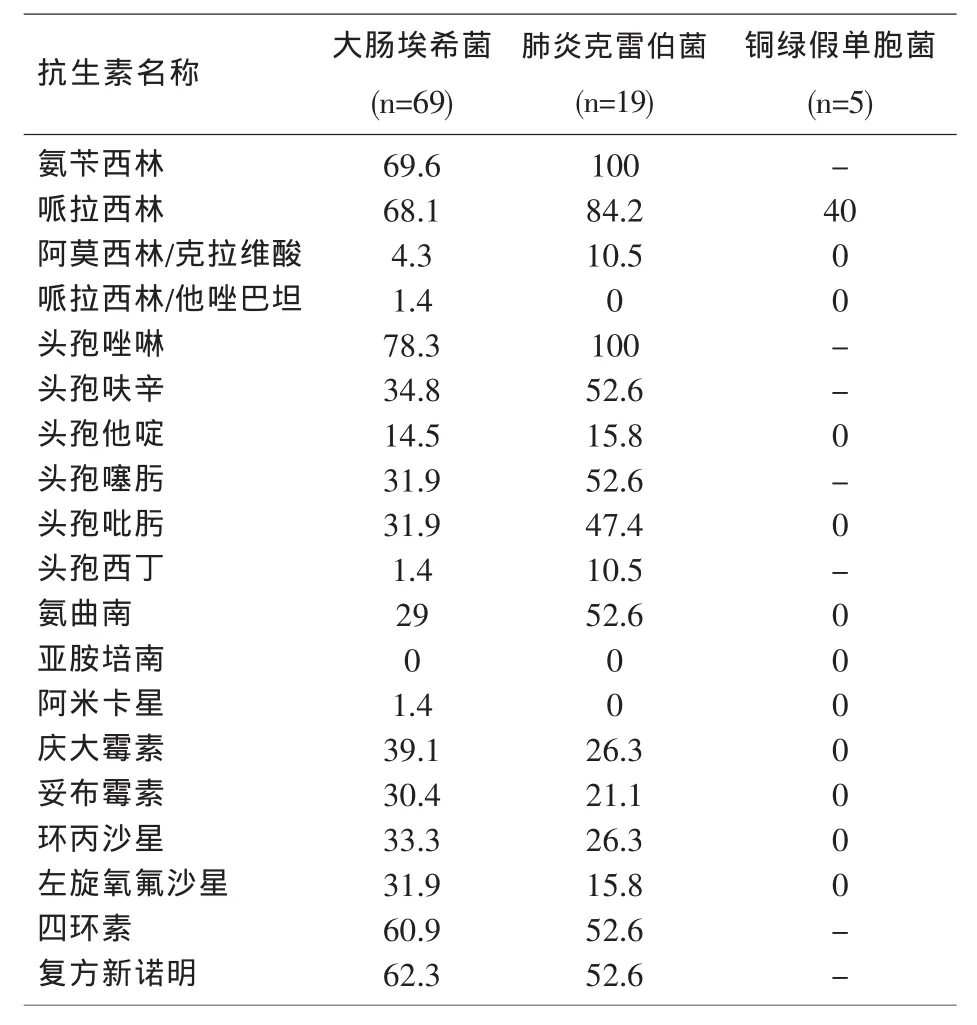
表3 血培养主要革兰阴性杆菌对抗菌药物的耐药率(%)
2.4 主要革兰阳性球菌的耐药特征 葡萄球菌普遍对青霉素及氨苄西林表现高耐药性(>80%),耐甲氧西林菌株分别占凝固酶阴性葡萄球菌和金色葡萄球菌的72.4%和18.2%。尚未发现耐万古霉素及利奈唑胺菌株。肠球菌对青霉素类、喹诺酮类及高浓度的庆大霉素和链霉素表现较高敏感性,对奎奴普丁/达福普汀、四环素及利福平的耐药率则高达50%以上,未发现对万古霉素及利奈唑胺耐药肠球菌。见表4。
3 讨论
2013年1月-2014年12月东莞市厚街医院共送检血培养标本2460份,检出阳性病原菌237例,阳性率9.6%,与国内多家医院报道相似[4,5]。本院血液感染主要菌群为革兰阴性杆菌 (114株,占48.1%),检出率居前5位的病原菌依次为CNS、大肠埃希菌、肺炎克雷伯菌、金黄色葡萄球菌和肠球菌,与其他医院[6-8]存在差异,这可能与地区差异、病区差异、时间差异和用药差异有关。本院CNS居于血培养病原菌的第一位,但需要提出的是,由于大多数临床医生只送检单份的血培养,本研究无法排除CNS污染的可能。阳性病原菌临床科室分布以ICU、普外科及呼吸内科为主,可能与这些科室住院患者年龄大、病程长、病情严重、手术后有关[9,10]。
血培养病原菌的耐药性监测一直是指导临床合理用药的重要依据。革兰阴性杆菌的耐药监测显示,大肠埃希菌和肺炎克雷伯菌产ESBLs的检出率分别为31.9%和52.6%,对氨苄西林的耐药率超过60%。大肠埃希菌对氨基糖苷类、喹诺酮类、磺胺类及四环素类药物的耐药率均高于肺炎克雷伯菌,与文献报道基本一致[11],但两者均对含酶抑制剂的抗菌药物、丁胺卡那霉素及头孢西丁耐药率较低,且尚未发现对亚胺培南耐药的菌株。提示对于产ESBLs引起的感染,哌拉西林/他唑巴坦、阿莫西林/克拉维酸、丁胺卡那霉素及头孢西丁可作为经验用药,而碳氢酶烯类药物作为革兰阴性杆菌的最后一道防线,广泛使用该类药物势必导致耐碳氢酶烯类菌株增多甚至泛滥,因此建议临床应慎用此类抗菌剂。相比而言,血培养中的铜绿假单胞菌对多种抗菌药表现高敏感性,说明本院并未出现耐药菌株,但也应积极监测以预防。
革兰阳性球菌中CNS和金黄色葡萄球菌对苯唑西林的耐药率分别为72.4%和18.2%,与全国血流感染细菌监测报告[12]的80.5%和54.5%相比,耐甲氧西林的金黄色葡萄球菌明显低于全国,这可能与收集的病例有关,同时也与本院各项防控措施发挥作用有关。CNS总的耐药率高于金黄色葡萄球菌,与报道相符[13,14]。常见葡萄球菌对青霉素、氨苄西林、头孢唑啉高度耐药,对喹努普汀/达福普汀和利福平的耐药率较低,均不足20%,未发现对万古霉素和利奈唑胺耐药的葡萄球菌。肠球菌除对喹努普汀/达福普汀、四环素、利福平和红霉素比较耐药外,其他抗生素均表现较高敏感性,未发现对万古霉素和利奈唑胺耐药的肠球菌。因此,糖肽类药物仍然是治疗严重革兰阳性球菌血流感染的首选药物,但应用时应严格控制适应证,以减少耐药菌株的产生。
总之,临床大量使用各类抗菌药物,导致细菌的耐药率不断上升,应引起高度的重视。因此,了解血流感染病原菌的耐药性对指导临床用药有重要的意义[15]。
[1]马全玲,魏殿军.血流感染的危险因素及相关预防措施[J].医学综述,2010,7(16):2038-2040.
[2]CLSI.Performance standards for antimicrobial susceptibility testing[S].Twenty second Informational supplement M100-S22 2012,32(3).
[3]叶应妩,王毓三,申子瑜,等.全国临床检验操作规程[M].第 3版.南京:东南大学出版社,2006:755-842.
[4]张鸿.武汉市青山区血培养病原菌的分布及耐药性分析[J].实验与检验医学,2011,29(4):411-412.
[5]张肖,夏文颖,顾兵,等.血培养阳性病原菌种类及耐药性监测[J].南京医科大学学报,2012,32(1):119-124.
[6]张勇军,徐晓棠.2123例血培养标本病原菌分布及耐药性分析[J].实验与检验医学,2008,26(2):88.
[7]孔繁林,储从家,管新龙,等.28292份临床血液标本细菌培养结果[J].中国感染控制杂志,2011,10(3):209-213.
[8]赵声远,肖淑珍,韩立中,等.住院患者血流感染分离病原体及其耐药性[J].中国感染控制杂志,2014,13(5):266-270.
[9]Leong IY,Tai DY.Is increasing age associated with mortality in the critically ill elderly[J].Singapore Med J,2002,43(1):33-36.
[10]Valles J,Ferrer R.Bloodstream infection in the ICU[J].Infect Dis Clin North Am,2009,23(3):557-569.
[11]钟桥石,胡龙华,熊建球,等.血流感染病原菌分布及耐药特征分析[J].中国抗生素杂志,2012,37(6):1-5.
[12]吕媛,李耘,薛峰,等.卫生部全国细菌耐药监测网(Mohnarin)2011-2012年度血流感染细菌耐药监测报告[J].中国临床药理学杂志,2014,30(3):278-288.
[13]卜黎红,朱以军,徐瑞龙,等.综合性医院7506例血培养病原菌分布和耐药性分析[J].中华医院感染学杂,2010,20(3):408-411.
[14]顾涛.新生儿败血症70例临床特征及病原菌分析[J].中华全科医学,2011,9(2):215-216.
[15]肖永红.开展耐药监测,促进抗菌药物合理使用[J].中国执业药师,2009,8(3):325.
