泛耐药鲍曼不动杆菌主动外排泵a d e B基因表达及耐药性研究
2015-06-05徐轶章白苓章洁苓尚姝张楠胡晓彦
徐轶 ,章白苓 ,章洁苓 ,尚姝 ,张楠 ,胡晓彦
(1、江西省人民医院高干病房,江西 南昌330006;2、南昌大学第二附属医院检验科,江西 南昌330006)
由于抗菌药物在临床的广泛使用,鲍曼不动杆菌已成为医院感染的重要病原菌,检出率和耐药率不断攀升,并且由单一耐药到多重耐药,甚至出现对临床常用抗菌药物呈泛耐药现象[1],鲍曼不动杆菌耐药机制十分复杂,近年来对修饰酶、降解酶和作用靶位的改变等方面耐药机制的研究较多,而对主动外排系统在鲍曼不动杆菌耐药机制中的作用研究甚少。主动外排系统由细菌胞膜介导抗菌剂外排的蛋白组成,是导致细菌多重耐药的重要原因[2,3]。为了解鲍曼不动杆菌主动外排泵基因,探讨其耐药机制,我们对主动外排泵adeB基因表达水平与临床分离的泛耐药鲍曼不动杆菌(pan-drug resistance Acinetobacter baumannii,PRABA)耐药性的关系进行研究,现报告如下。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集南昌大学第二附属医院2010年1月至2011年12月临床分离的PRABA菌36株,江西省人民医院2010年1月至2011年12月临床分离的PRABA菌14株,共50株。标本种类包括痰液30株、伤口分泌物13株、尿液5株、血液2株。同一患者的重复标本按1株计算。其中ICU20株,呼吸内科15株,神经外科10株,骨科5株,4株PSABA菌株。所有菌株经Vitek2-compact微生物鉴定仪鉴定。质控菌株:铜绿假单胞菌ATCC 27853,大肠埃希菌ATCC 25922。
1.1.2 主要仪器及试剂 Vitek2-Compact全自动微生物鉴定仪(法国生物梅里埃公司);9700PCR扩增仪(美国ABI公司);凝胶成像分析系统(英国GENE GENIUS 公司)。 氧氟沙星(OFLX)、庆大霉素(GEN)、四环素(TET)、头孢噻肟(CTX)均购自中国药品生物品检定所;亚胺培南(IPM杭州默沙东有限公司);泵抑制剂羰基氰氯苯腙 (CCCP),购自美国Sigma公司。RNA提取Trizol试剂盒为美国Molecular Research Center公司产品,聚合酶链反应(PCR)及逆转录PCR(RT-PCR)试剂盒为美国Promega公司产品,引物由上海生工生物工程公司合成。
1.2 方法
1.2.1 外排泵表型检测 用琼脂稀释法检测5种抗菌药物 OFLX、GEN、TET、CTX、IPM 的 MIC。 同时制备含有CCCP的MH琼脂,CCCP浓度20μg/ml,同样用琼脂稀释法检测上述5种抗菌药物对各菌株的MIC值。加入CCCP后的MIC值下降≥4倍时,则可判定外排泵表型阳性[4]。
1.2.2 adeB基因检测 细菌DNA提取采用煮沸法。 引物合成:P1:5′-AAA GAC TTC AAA GAG CGG ACT A-3′;P2:5′-TCA CGC ATT GCT TCA CCG-3′。 反应总体积 50μl;Taq 酶 25μl,上、下游引物 P1、P2 各 2μl,模板 DNA 2μl,双蒸水 19μl。 反应条件:94℃ 5min;94℃ 30s,55℃ 1min,72℃ 1min,30个循环;72℃7min。扩增产物经琼脂糖凝胶电泳后,在凝胶成像系统下成像分析结果。随机选取10个PCR阳性产物送上海生工生物公司测序。
1.2.3 adeB基因表达水平检测 细菌总RNA提取按试剂盒说明进行。RT-PCR扩增引物为P1和P2,内参基因recA扩增引物序列为5′-TTT CAC AAC CCG ACA ATG-3′和 5′-TGC CTC GCT CAT AAG ACG-3′。操作方法参照说明书进行一步法RT-PCR 反应。 反应条件:45℃ 45min;95℃ 2min;94℃ 30s,55℃ 1min,72℃ 1min,30 个 循 环 ;72℃7min。PCR产物经琼脂糖凝胶电泳后,凝胶成像系统成像后用美国Quantity One 4.4软件分析所得相对灰度值。
1.2.4 统计前处理 用WHO NET5.4和SPSS13.0统计软件进行数据分析,计量资料以(x±s)表示,两组比较采用t检验,P<0.05时差异有统计学意义。
2 结果
2.1 外排泵表型检测结果 50株PRABA菌株对OFLX、GEN、TET、CTX、IPM 的 MIC 值范围分别为36 ~128μg/ml、2048 ~8192μg/ml、1024 ~2048μg/ml、512~1024μg/ml和 4~128μg/ml。
以加入CCCP的MIC值比不加降低4倍或以上作为外排表型阳性的判定标准,OFLX 45株阳性、GEN 50株全部阳性、TET 42株阳性、CTX 50株全部阳性、IPM 45株阳性。在仅含 20μg/ml CCCP的琼脂平板中,所有试验菌株均生长良好,表明20μg/ml CCCP对细菌生长无抑制作用。
2.2 adeB基因检测结果 50株PRABA菌和4株PSABA菌株产物均检测到目的基因adeB基因条带,片段约为675bp,ATCC 27853未见扩增片段。结果见图1(部分结果图)。随机选取10个阳性PCR产物经测序后,在GenBanK基因库中比对分析,7号菌株结果与登陆号NC009085.1的菌株亲缘关系最近,其同源性为100%,3号菌株结果与登陆号NC009085.1的菌株亲缘同源性为98%,其他菌株同源性为99%。见图2。
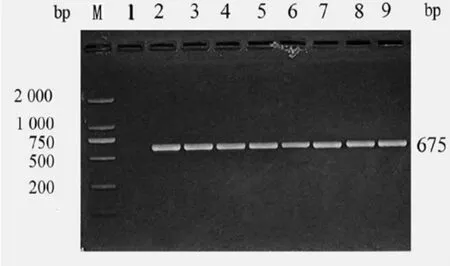
图1 adeB基因PCR扩增产物电泳结果
图2 adeB基因测序图
2.3 adeB基因表达水平检测结果 以adeB和recA电泳条带灰度值的比值(adeB/recA)表示adeB相对表达水平,PRABA组和PSABA组细菌株adeB/recA 计算结果分别为(3.52±0.68)和(0.85±0.04),差异有统计学意义(P<0.01)。
3 讨论
鲍曼不动杆菌广泛分布于自然界和医院环境,是医院感染的重要病原菌[5],鲍曼不动杆菌作为医院内感染的重要病原菌已引起世界范围内的广泛重视,随着β-内酰胺类抗生素和第三代头孢菌素等广谱抗生素的广泛应用,诱导了大量耐药株的产生,由单一抗生素耐药发展到多重耐药,甚至出现了泛耐菌株,给抗感染治疗带来巨大困难[5,6]。从本组50株泛耐药鲍曼不动杆菌菌株来源,主要来源于ICU、呼吸内科、神经外科和骨科,标本主要为痰液和伤口分泌物,ICU、呼吸内科、神经外科鲍曼不动杆菌分离率高,与这3个科室住院患者住院时间长,大多有严重疾病和长期使用广谱抗生素有关。
鲍曼不动杆菌耐药机制复杂,其中细菌的主动外排泵系统是介导细菌多重药物耐药的主要机制[7],依据氨基酸序列的同源性可分为5个主要超家族[8],包括ATP结合盒超家族(ABC)、主要易化子超家族(MFS)、耐药节结化分化家族(RND)、多药及毒性化合物外排家族(MATE)和小多重耐药性家族(SMR)。
Sophie Magnet等在一株鲍曼不动杆菌多重耐药株BM 4454中发现存在adeABC基因簇编码的泵出系统,经证实,AdeABC是鲍曼不动杆菌所特有[9]。AdeABC外排泵隐藏在野生的鲍曼不动杆菌中,其作用受到AdeRS调控[10],AdeB蛋白包含12个跨膜片段,此类转运蛋白对多种抗生素有转运作用,属于RND类[11]。我们研究发现,临床分离的泛耐药株和敏感株均能检测到adeB基因[12,13]。通过进一步检测该基因mRNA的表达水平,发现泛耐药菌株表达水平显著高于敏感株[13,14],这种编码外排泵的基因高表达可能导致了该菌的泛耐药和多重耐药。外排泵基因adeABC位于鲍曼不动杆菌的染色体基因组中,无论敏感或耐药菌株均普遍存在,而在敏感菌株中不表达或低表达,可能与泵基因上游的调控序列有关。
本研究中通过PCR扩增受试菌株的adeB基因,测序分析显示其序列与GenBank上登陆的登陆号NC009085.1adeB的同源性为98.0%~100%,证实扩增产物为adeB基因。
CCCP作为一种外排耐药系统抑制剂,是一种抑制质子转运的解偶联剂,可以阻断菌体表面蛋白能量的供应,使外排泵无法正常工作,药物不被外排而蓄积于菌体内,恢复细菌对药物的敏感性[15]。我们研究试验表明,PRABA菌株加入CCCP 20μg/ml后,四环素、氧氟沙星、亚胺培南、头孢噻肟、庆大霉素MIC值小于原值的1/4或1/4以下,分别为84%~100%,以庆大霉素下降最明显。这说明CCCP外排泵抑制剂对逆转鲍曼不动杆菌耐药行之有效,但是对于不同抗菌药物的耐药性逆转程度有所差异。表明鲍曼不动杆菌中存在主动外排机制,鲍曼不动杆菌的高度耐药与药物主动外排系统密切相关。
综上所述,主动外排系统在介导鲍曼不动杆菌多重耐药和泛耐药中发挥重要作用,编码基因adeB高表达导致鲍曼不动杆菌同时对几类药物耐受,泵抑制剂能够部份逆转这种耐受,但是,有关外排泵的底物与耐药表型的关系还未完全明确,因此,应加强鲍曼不动杆菌耐药机制的基础研究,改进药物设计,研发新型药物,为临床更好地选择药物和更有效地治疗疾病提供理论基础。
[1]Chan P C.Control of an outbreak of pandrug resistant Acinetobacter baumannii colonization and infection in a neonatal intensive care unit[J].Infect Control Hosp Epidemiol,2007,28(4):423-429.
[2]Viveiros M,Martins M,Couto I,et al.New met hods for the identification of efflux mediated MDR bacteria,genetic assessment of regulators and efflux pump constituents,characterization of efflux systems and screening for inhibitors of efflux pumps[J].Curr Drug Targets,2008,9(9):760-778.
[3]Poole K.Efflux mediated antimicrobial resistance[J].J Antimicrob Chemother,2005,56(1):20-51.
[4]Ribera A,Ruiz J,Anta MT,et al.Effect of an efflux pump inhibi-tor on the MIC of nalidixic acid for Acinetobacter baumannii and Stenotrophomonas maltophilia clinical isolates [J].J Antimicrob Chemother,2002,49(4):697-698.
[5]史俊艳,张小江,徐英春.2007年中国CHINET鲍曼不动杆菌耐药性监测[J].中国感染与化疗杂志,2009,9(3):196-200.
[6]胡莹,刘晓莉,马润,等,昆明地区烧伤病房鲍曼不动杆菌的耐药性和分子流行病学调查[J].实验与检验医学,2014,32(5):508-510.
[7]于翠香,傅爱玲,王英田,等,多重耐药鲍曼不动杆菌抗菌制剂外排泵基因研究[J].中国抗生素杂志,2013,38(8):629-632.
[8]Li XZ,Zhang L,Nikaido H.Efflux pumpmedicated intrinsic drug resistance in Mycobacterium smegmatis[J].Antimicrob Agents Chemother,2004,48(7):2415-2423.
[9]Chu YW,Chau SL,Houang ET.Presence of active efflux systemsAdeABC,AdeDE andAdeXYZ in differentAcine tobacter genomic DNA groups[J].J Med Microbiol,2006,55(4):477-478.
[10]Macharand I,Damier-Piolle L,Caurvalin P,et al.Expression of the RND-type efflux pump AdeABC in Acinetobacter baumannii is regulated by the AdeRS two-component system[J].Antimicrob A-gents Chemother,2004,48(9):3298-3304.
[11]Camp C,Tatum OL.A review of Acinetobacter baumannii as a highly successful pathogen in times of war[J].Lab Med,2010,41:649-657.
[12]王悦,宋诗铎,王玉宝,22株多重耐药鲍曼不动杆菌临床株的外排泵AdeABC和AdeIJK的表迏研究 [J].中国抗生素杂志,2009,34(5):304-308.
[13]宋晓萍,刘萍萍,孙明娥,等,鲍曼不动杆菌耐药性监测与外排泵adeB基因表迏水平检测 [J].国际检验医学杂志,2011,32(12):1297-1298.
[14]吴春阳,钱雪峰,张剑峰,等,多重耐药鲍曼不动杆菌外排泵基因和外膜蛋白基因的检测[J].临床检验杂志,2013,31(7):531-534.
[15]孙静娜,董威,赵帅,等,多重耐药鲍曼不动杆菌外排泵表型和基因型的研究[J].中华检验医学杂志,2014,37(10):763-766.
