青萝卜与红萝卜的生物活性物质及抗氧化能力分析
2015-06-05张皓月吴益梅夏雪刘丹陈清张芬侯艳霞马杰汤浩茹孙勃
张皓月,吴益梅,夏雪,刘丹,陈清,张芬,侯艳霞,马杰,汤浩茹,孙勃*
(1.四川农业大学园艺学院,四川雅安625014;2.山西林业职业技术学院,太原030009;3.毕节市农业科学研究所,贵州毕节551700)
青萝卜与红萝卜的生物活性物质及抗氧化能力分析
张皓月1,吴益梅1,夏雪1,刘丹1,陈清1,张芬1,侯艳霞2,马杰3,汤浩茹1,孙勃1*
(1.四川农业大学园艺学院,四川雅安625014;2.山西林业职业技术学院,太原030009;3.毕节市农业科学研究所,贵州毕节551700)
以青萝卜与红萝卜为材料,研究不同食用部位(叶柄、根皮和根肉)中维生素C、类胡萝卜素、花青素、原花青素、叶绿素、类黄酮和总酚含量及抗氧化能力的水平.结果表明:青萝卜与红萝卜不同食用部位间生物活性物质及抗氧化能力差异显著,根皮和叶柄中的含量明显高于根肉;青萝卜中的原花青素、类胡萝卜素和叶绿素含量高于红萝卜,红萝卜中的维生素C、花青素和总酚含量高于青萝卜.抗氧化能力分析采用常见的铁离子还原能力(ferric reducing antioxidant power,FRAP)和2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基清除能力[2,2′-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]分析法,相关性分析表明,FRAP与全部生物活性物质均呈极显著或显著正相关,而ABTS仅与类胡萝卜素和叶绿素呈极显著或显著正相关,提示FRAP法更适合用于萝卜抗氧化能力的测定.
生物活性物质;抗氧化能力;青萝卜;红萝卜;食用部位
SummaryRadish(Raphanus sativus),an important original Raphanus vegetable,is widely distributed in China.It exhibits high nutritional value because of rich in vitamins,phenolic compounds,and dietary fiber.Many bioactive compounds show the important biological functions,such as antioxidant and anticarcinogenic effects. Therefore,the colored vegetables,as a rich source of various bioactive compounds,have achieved more and more attentions.Radish can be divided into white radish,green radish and red radish according to skin color.Green and red radishs,which were widely grown in Sichuan Province,could be consumed not only in fresh but also as main raw materials of Sichuan pickles,and the edible parts include the petiole,root peel and root flesh.Although the nutrient qualities in root flesh of radish have been investigated,limited information is available about the bioactive compounds and antioxidant capacities among different edible parts in green radish and red radish.
We aimed to investigate the variation of the contents of vitamin C,carotenoids,anthocyanins,proanthocyanidins,chlorophylls,flavonoids,and total phenolics,as well as antioxidant capacities among different edible parts in green radish and red radish.Our systematic study on radish will provide the foundation to guide human consumption.
In September 2013,the seeds of green radish(cv.Lutouqing)and red radish(cv.Hongyou)were sown at Ya’an City,Sichuan Province.Petioles and roots were harvested together in early morning,put on ice and transported to laboratory within 10 min.For each sampling,five plants were collected as a replicate,and four independent replicates were taken for analysis.The samples were cleaned and separated according to different edible parts,and then the contents of bioactive compounds and antioxidant capacities were determined.The correlations were analyzed by SPSS 18.0 software.
The results showed that both contents of bioactive compounds and antioxidant capacities exhibited remarkable differences among different edible parts in green radish and red radish.In general,the lower contents were found in flesh.The contents of proanthocyanidins,carotenoids and chlorophylls in green radish were notably higher than those in red radish.On the contrary,the contents of vitamin C,anthocyanins and total phenolics in red radish were higher than those in green radish.Moreover,significant positive correlations were found between ferric reducing antioxidant power(FRAP)and all bioactive compounds,respectively,whereas 2,2′-azino-bis(3-ethyl-benzothiazoline-6-sulfonic acid)(ABTS)was just significantly correlated with carotenoids and chlorophylls.The results suggested that FRAPis suitable for the analyses of antioxidant capacity in radish.
In conclusion,the contents of bioactive compounds and antioxidant capacities show significant differences among edible parts and species of radish.The edible parts of green radish and red radish contain high nutritional value,and are as good candidate for human daily consumption.
萝卜(Raphanus sativus)为十字花科萝卜属的一二年生草本双子叶植物,是原产我国的一种根菜类蔬菜.萝卜具有很高的营养价值,含有丰富的维生素、酚类物质和膳食纤维等成分[1-3].随着生活水平的提高,人们对于食物多样性和健康的关注与日俱增,对于蔬菜品质的认识已经逐渐从外观和常规营养品质转移到维生素、类胡萝卜素和总酚等生物活性物质上,这些生物活性物质往往具有较强的抗氧化和抗癌等功效[1,4-6],有色蔬菜因为颜色种类丰富,且富含多种生物活性物质,逐渐受到越来越多的关注和利用.萝卜根据皮色可分为白萝卜、青萝卜和红萝卜等类型,青萝卜和红萝卜在四川地区广泛栽培,除鲜食外,还是腌制四川泡菜的主要原料,食用部位包括叶柄、根皮和根肉.
目前,国内外对萝卜的营养品质和保健价值已有一定的研究,但这些研究多是以根肉为研究对象[3,7-8],并且多局限于常规或单一营养成分的分析[2-3,6-7],而对与保健功效密切相关的成分,如类黄酮、总酚和抗氧化能力等的系统研究又多集中在芽菜上[1,9].迄今为止,对于青萝卜与红萝卜不同食用部位的生物活性物质和抗氧化能力等的分析鲜有报道.基于此,本试验以四川地区常用的青萝卜与红萝卜为材料,比较不同食用部位中生物活性物质和抗氧化能力的差异,以期全面地了解青萝卜与红萝卜的营养价值,为人们日常消费和膳食营养提供理论依据.
1 材料与方法
1.1 试验材料
供试青萝卜与红萝卜品种分别为“露头青”和“红优”.2013年9月15日在四川省雅安市播种,待产品器官成熟后开始采收.采收时挑选生长健壮、成熟度一致、无病虫害及机械损伤的青萝卜与红萝卜植株各20株,每5株作为一个生物学重复,共4个重复.将肉质根与叶柄一同采收,放入带冰的泡沫箱中迅速运回实验室.将萝卜清洗后按照叶柄、根皮和根肉3个食用部位进行分割,各部位样品分别混匀后用于生物活性物质和抗氧化能力的测定.
1.2 测定方法
1.2.1 维生素C含量测定 准确称取鲜样5 g于研钵中,加入草酸溶液研磨,残渣用草酸溶液洗涤,合并滤液,用草酸溶液定容到25 m L,5 000 r/ min离心5 min,吸取上清液,过滤,用于高效液相色谱(high performance liquid chromatography,HPLC)分析.HPLC条件:检测波长243 nm,流速1.0 m L/min,色谱柱为C18反相色谱柱.通过标准曲线计算不同器官中的维生素C含量[4].
1.2.2 类胡萝卜素含量测定 以V(正己烷)∶V(乙醇)∶V(丙酮)=1∶1∶1的混合溶剂提取样品中的色素,以空白溶液作对照,用紫外分光光度计在450 nm下测定其吸光度,计算类胡萝卜素含量[10].
1.2.3 花青素含量测定 准确称取0.5 g样品,加入20 m L含有1%盐酸的甲醇溶液,在4℃条件下浸提24 h,将提取液稀释后,在535 nm下测定其吸光度,计算样品花青素含量[11].
1.2.4 原花青素含量测定 称取1.0 g样品置入50 m L离心管中,加入20 m L提取液[V(丙酮)∶V(去离子水)∶V(醋酸)=75∶24.5∶0.5],在室温条件下振荡1 h.5 000 r/min离心10 min,吸取上清液作为原花青素提取液.在酶标板上每孔加入对二甲氨基丙烯醛[4-(dimethylamino)cinnamaldehyde,DMACA]溶液210μL,样品70 μL,640 nm下进行吸光度扫描,以原花青素B2(procyanidin B2)为标准品绘制回归曲线,进而计算各样品中原花青素的含量[12].
1.2.2 叶绿素含量测定 称取新鲜样品0.2 g置于研钵中,加少量碳酸钙和石英砂及80%丙酮1 m L研成匀浆,再加80%丙酮9 m L继续研磨至组织变成白色.过滤后用80%丙酮定容至25 m L,用分光光度计分别在波长663 nm和645 nm下测定叶绿素提取液吸光度,计算叶绿素含量.
1.2.6 类黄酮含量测定 称取1.0 g样品置入80%丙酮溶液中,室温下抽提1 h后,4℃5 000 r/ min离心10 min,收集上清液作为类黄酮提取液.在酶标板上每孔分别加入上清液30μL,95%乙醇90 μL,10%三氯化铝6μL,1 mol/L醋酸钾6μL和去离子水168μL,室温反应40 min.用酶标仪测定415 nm下的吸光度,计算类黄酮含量,以μg/g的槲皮素为单位[13].
1.2.7 总酚含量测定 将样品在乙醇溶液中充分研磨后定容至25 m L,水浴1 h,5 000 r/min离心10 min,吸取上清液作为总酚提取液.取提取液0.3 m L分别加入福林酚溶剂和碳酸钠溶液,静置2 h,在760 nm下测量吸光值.根据标准曲线计算萝卜不同食用部分中的总酚含量[5].
1.2.8 FRAP法测定抗氧化能力 将样品在乙醇溶液中研磨后水浴1 h,5 000 r/min离心10 min,吸取上清液作为提取液.提取液中加入FRAP工作液,水浴10 min,在593 nm波长处测吸光值.根据标准曲线计算萝卜不同食用部位的抗氧化能力[14].
1.2.9 ABTS法测定抗氧化能力 将样品在乙醇溶液中研磨后水浴1 h,5 000 r/min离心10 min,吸取上清液作为提取液.在酶标板上每孔加入上清液6μL和ABTS工作液320μL,室温反应30 s,在734 nm处进行吸光度扫描,每3 min扫描记录1次,共30 min,计算样品的抗氧化能力[15].
1.3 数据分析
试验数据均采用Excel 2010软件进行处理,以4次重复的平均值±标准差表示.用SPSS 18.0软件进行数据统计和差异显著性以及相关性分析.
2 结果与分析
2.1 主要生物活性物质分析
青萝卜与红萝卜不同食用部位中7种主要生物活性物质的变化见图1.从中可以看出,各项生物活性物质在不同类型和食用部位间差异显著.根皮和叶柄中各项生物活性物质均显著高于根肉.其中,青萝卜根皮中类胡萝卜素、原花青素和叶绿素含量最高,青萝卜叶柄中类黄酮含量最高,红萝卜根皮中维生素C、花青素和总酚含量最高,而青萝卜根肉中维生素C、类胡萝卜素、原花青素、叶绿素和总酚含量最低,红萝卜根肉中花青素和类黄酮含量最低.
按照在不同类型和食用部位中的分布情况,这些生物活性物质可以分为3类.第一类为维生素C、花青素和总酚,其特点为红萝卜含量高于青萝卜,在红萝卜中呈现根皮>叶柄>根肉的趋势,在青萝卜中呈现叶柄≥根皮>根肉的趋势;第二类为原花青素、叶绿素和类胡萝卜素,其特点为青萝卜含量高于红萝卜,在红萝卜中呈现叶柄>根皮≥根肉的趋势,在青萝卜中呈现根皮>叶柄≥根肉的趋势;第三类为类黄酮,其特点为青萝卜与红萝卜含量无明显差异,食用部位呈现叶柄>根皮>根肉的趋势.
在青萝卜与红萝卜中,根肉占食用部位总生物量的比例最高,超过80%,其次是根皮,约占总生物量的10%,叶柄最低,仅占总生物量的5%左右.而各食用部位所占比例在青萝卜与红萝卜间无显著差异(图1).
2.2 抗氧化能力分析
分别采用FRAP法和ABTS法对青萝卜与红萝卜的抗氧化能力分析.图2表明,不同萝卜类型和食用部位间的抗氧化能力差异显著,但2种方法测得的结果有所不同.FRAP法结果表明,根皮抗氧化能力最强,其次是叶柄,根肉最低;而青萝卜与红萝卜间无显著差异.青萝卜根皮的抗氧化能力(FRAP)最强,达到10.2μmol/g,青萝卜根肉最弱,仅为2.3 μmol/g,两者抗氧化能力(FRAP)相差达4.38倍. ABTS法结果表明,叶柄抗氧化能力最强,其次是根皮,根肉最低;而青萝卜各食用部位的抗氧化能力均显著高于红萝卜,青萝卜叶柄的ABTS清除率最高,达到29.15%,红萝卜根肉最低,仅为7.28%,不足青萝卜叶柄含量的30%.

图1 青萝卜与红萝卜不同食用部位中主要生物活性物质的质量分析Fig.1 Contents of bioactive compounds among different edible parts of green radish and red radish
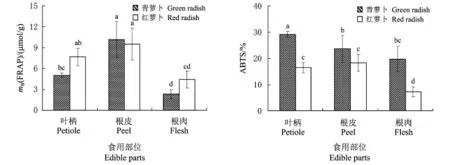
图2 青萝卜与红萝卜不同食用部位中抗氧化能力Fig.2 Antioxidant capacities among different edible parts of green radish and red radish
2.3 生物活性物质及抗氧化能力间的相关分析
青萝卜与红萝卜生物活性物质及抗氧化能力间的相关分析结果见表1.FRAP法测定的抗氧化能力各生物活性物质含量均呈极显著或显著的正相关关系,其中与原花青素含量的相关系数最高,达到0.658,而ABTS法测定的抗氧能力仅与类胡萝卜素和叶绿素含量呈显著和极显著正相关.此外,FRAP和ABTS法之间无显著相关性.
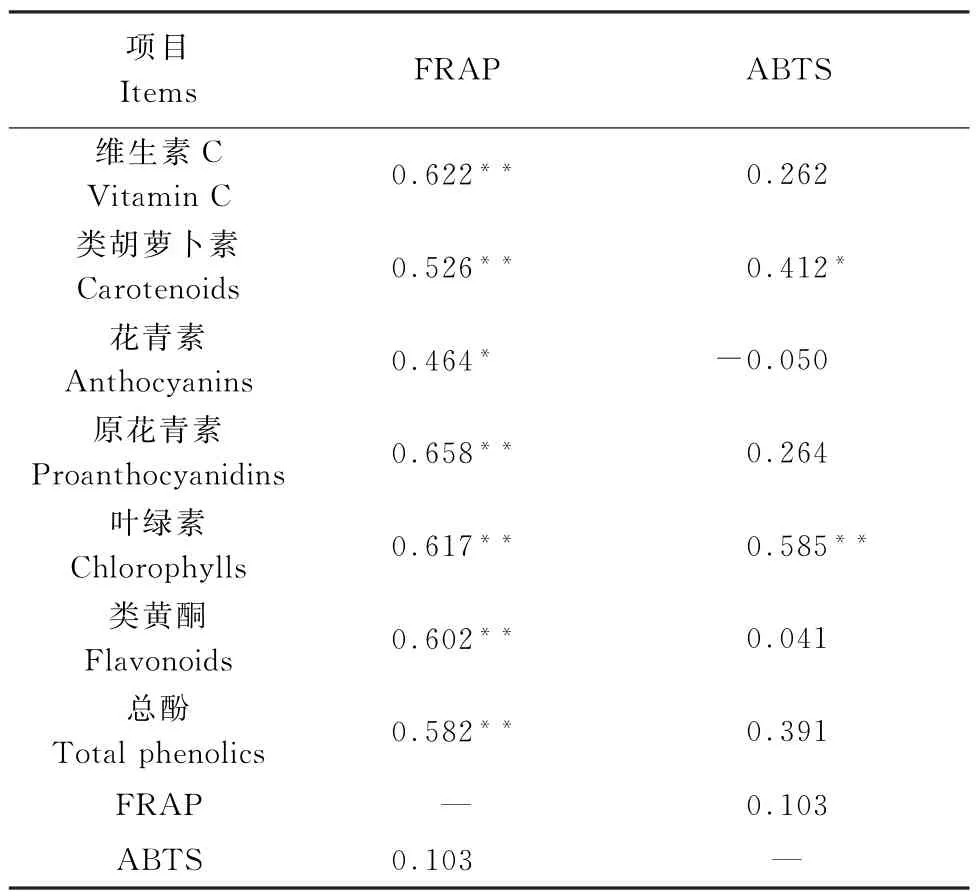
表1 青萝卜与红萝卜生物活性物质及抗氧化能力间的相关性Table 1 Correlation coefficients between bioactive compounds and antioxidant capacities in green radish and red radish
3 讨论
果蔬不同组织器官间的生物活性物质及抗氧化能力存在显著差异.Park等[16]的研究结果表明,“Hong Feng No.1”萝卜根皮的花青素含量显著高于根肉.与萝卜同为十字花科蔬菜的青花菜和花椰菜等叶片的叶绿素、类胡萝卜素、维生素C和总酚等含量以及抗氧化能力均显著高于花球、茎和根系等器官[17-18],而青花菜和花椰菜花球中的维生素C和芥子油苷等含量则显著高于茎中的含量[17-19].具体到食用器官,不同部位间的含量也存在显著差异.在费约果果实中,总酚、类黄酮和原花青素等物质主要集中在果皮中,其次是果肉,果浆中积累最少[20].而在柑橘、苹果、梨、葡萄等水果中,酚类物质等也大量积累在果实的果皮部分[6].本试验结果表明,萝卜不同食用部位间在生物活性物质含量和抗氧化能力上均差异很大,特别是在根肉中的分布均明显低于叶柄与根皮.这种分布特点很可能是萝卜植株为适应环境而逐步进化形成的,是植物对环境适应性的体现.研究表明,包含花青素、原花青素、类黄酮等在内的酚类物质均能够参与植物对生物胁迫(如病原菌和昆虫等)和非生物胁迫(如干旱和低温等)的抗性反应[4,6,16].而维生素C也能参与植物对干旱胁迫等的响应[21].萝卜的根皮作为土壤中病原菌和昆虫入侵植物的屏障,积累较多的生物活性物质,有助于提高植物的抗性.而萝卜的叶柄部分既要承担养分从营养器官叶片向贮藏器官根中的运输,同时还要面对各种逆境,因此生物活性物质的积累有助于其更好地完成其生理功能.此外,不同发育时期对各类生物活性物质也有不同程度的影响,如鲁燕舞等[9]发现萝卜芽菜中的总酚含量超过1 mg/g,显著高于本试验中各样品.
果蔬不同类型及品种间的营养成分也存在显著差异.Lu等[7]测定了42个萝卜品种的可溶性固形物、维生素C、粗纤维、干物质量、蛋白质等营养成分,并对结果进行主成分分析,发现不同品种间各营养成分差异显著.其中42个品种含维生素C的范围为141.6~334.1μg/g,而本试验中青萝卜与红萝卜根肉含维生素C的量分别为180.5和201.9 μg/g,与Lu等[7]的结果一致.张丽等[3]对3个类型6个品种萝卜根肉的常规营养成分进行分析,发现红萝卜的膳食纤维含量高于青萝卜,而青萝卜的维生素C含量高于红萝卜,这与本研究的维生素C结果有所不同,这可能是由于选取的品种与部位不同导致的.本试验结果表明,青萝卜与红萝卜间的生物活性物质差异显著,青萝卜中的原花青素、类胡萝卜素和叶绿素含量较高,而红萝卜中的维生素C、花青素和总酚含量较高,日常膳食中搭配食用,既可营养均衡,又兼顾颜色.
大量研究表明,维生素C、类胡萝卜素、花青素、原花青素、类黄酮、总酚和叶绿素等生物活性物质均具有较强的抗氧化性[1,4-5,12,16],而抗氧化能力则是反映样品所有抗氧化物综合效果的指标.常用的抗氧化能力测定方法分为4类,分别是基于电子转移(single electron transfer,SET)的方法(包括FRAP和ABTS法等);基于氢原子转移(hydrogen atom transfer,HAT)的方法;活性氧自由基清除能力法;金属离子螯合能力法[22].其中FRAP法具有原理明确、操作简便、反应时间短、易于标准化等优点;ABTS法具有快速简便、与抗氧化剂的生物活性相关性强等优点.这2种方法被广泛应用于包括果蔬类、血清等在内的生物样品总抗氧化能力的测定[20,23].而本试验发现,FRAP法与ABTS法测出的结果不尽相同,且2种方法无显著相关性,相关系数仅为0.103.而李华等[22]通过对296篇SCI文献和45篇CNKI核心期刊文献的结果进行分析发现,不同研究中抗氧化能力测定方法间的相关性存在明显差异,以FRAP和ABTS为例,32篇文献中相关性大于0.8的有17篇,相关性介于0.5和0.8之间的有8篇,相关性介于0.3和0.5之间的有1篇,相关性小于0.3的有6篇.造成这种差异的原因除了实验误差外,主要是由于两者抗氧化的作用机制及测定样品的不同所致.在本试验中,FRAP法与全部的生物活性物质均呈极显著或显著正相关,而ABTS法仅与类胡萝卜素和叶绿素呈极显著或显著正相关,说明对青萝卜与红萝卜进行抗氧化能力测定时,FRAP法可能更为合适.
本试验采用的青萝卜和红萝卜是萝卜中非常重要的2个类型,在四川地区栽培广泛,除鲜食外,还是腌制四川泡菜的主要原料.青萝卜与红萝卜的叶柄、根皮和根肉均被作为腌制泡菜的原料,但在日常膳食中,作为蔬菜有色部分的叶柄和根皮却常常被丢弃.本试验结果表明,同为有色蔬菜的青萝卜与红萝卜的叶柄和根皮中含有丰富的生物活性物质和具有抗氧化能力,且均显著高于根肉,因此,我们建议除腌制泡菜外,叶柄和根皮也作为鲜食的食材,以便人体获得更多的营养成分,避免不必要的浪费;青萝卜与红萝卜营养有所不同,建议食用时适量搭配.总之,本研究结果可为人们日常膳食与营养搭配提供一定的理论依据和参考.
(References):
[1] Yuan G F,Wang X P,Guo R F,et al.Effect of salt stress on phenolic compounds,glucosinolates,myrosinase and antioxidant activity in radish sprouts.Food Chemistry,2010,121(4):1014-1019.
[2] Tatsuzawa F,Toki K,Saito N,et al.Anthocyanin occurrence in the root peels,petioles and flowers of red radish(Raphanus sativus L.).Dyes and Pigments,2008,79:83-88.
[3] 张丽,宋曙辉,王文琪,等.不同萝卜品种营养成分比较.北方园艺,2004,20:57-58.
Zhang L,Song S H,Wang W Q,et al.Comparison of nutrition components in different radish cultivars.Northern Horticulture,2004,20:57-58.(in Chinese with English abstract)
[4] Sun B,Yan H Z,Liu N,et al.Effect of 1-MCP treatment on postharvest quality characters,antioxidants and glucosinolates of Chinese kale.Food Chemistry,2012,131:519-526.
[5] Volden J,Bengtsson G B,Wicklund T.Glucosinolates,L-ascorbic acid,total phenols,anthocyanins,antioxidant capacities and colour in cauliflower(Brassica oleracea L. ssp.botrytis);effects of long-term freezer storage.Food Chemistry,2009,112:967-976.
[6] Ignat I,Volf I,Popa V I.A critical review of methods for characterisation of polyphenolic compounds in fruits and vegetables.Food Chemistry,2011,126:1821-1835.
[7] Lu Z L,Liu L W,Li X Y,et al.Analysis and evaluation of nutritional quality in Chinese radish(Raphanus sativus L.). Agricultural Sciences in China,2008,7(7):823-830.
[8] 卢刚,庄晓英,叶纨芝.萝卜肉质根膨大过程库活性与蛋白质变化研究.浙江大学学报:农业与生命科学版,2004,30(1):39-43.
Lu G,Zhuang X Y,Ye W Z.Changes of sink activity and soluble protein during tap-root thickening in Raphanus sativus L.Journal of Zhejiang University:Agriculture& Life Sciences,2004,30(1):39-43.(in Chinese with English abstract)
[9] 鲁燕舞,张晓燕,耿殿祥,等.光质对萝卜芽苗菜总酚类物质含量及抗氧化能力的影响.园艺学报,2014,41(3):545-552.
Lu Y W,Zhang X Y,Geng D X,et al.Effects of light quality on total phenolic contents and antioxidant activity in radish sprouts.Acta Horticulturae Sinica,2014,41(3):545-552.(in Chinese with English abstract)
[10] 魏佳,贾承国,李振,等.利用突变体研究植物激素对番茄果实品质的影响.核农学报,2009,23(3):521-525.
Wei J,Jia C G,Li Z,et al.Effects of phytohormones on quality characters of tomato fruit by using phytohormone mutants.Journal of Nuclear Agricultural Sciences,2009,23(3):521-525.(in Chinese with English abstract)
[11] 李彦慧.李属彩叶树种耐SO2机制研究.保定,河北:河北农业大学,2008.
Li Y H.Studies on mechanism of SO2tolerance of coloredleaf tree species in Prunus.Baoding,Hebei:Hebei Agricultural University,2008.(in Chinese with English abstract)
[12] Prior R L,Fan E,Ji H P,et al.Multi-laboratory validation of a standard method for quantifying proanthocyanidins in cranberry powders.Journal of the Science of Food and Agriculture,2010,90(9):1473-1478.
[13] Chang C C,Yang M H,Wen H M,et al.Estimation of total flavonoid content in propolis by two complementary colorimetric methods.Journal of Food and Drug Analysis,2002,10:178-182.
[14] Benzie I F,Strain J J.The ferric reducing ability of plasma(FRAP)as a measure of“antioxidant power”:The FRAP assay.Analytical Biochemistry,1996,239:70-76.
[15] Wootton-Beard P C,Moran A,Ryan L.Stability of the total antioxidant capacity and total polyphenol content of 23 commercially available vegetable juices before and after in vitro digestion measured by FRAP,DPPH,ABTS and Folin-Ciocalteu methods.Food Research International,2011,44:217-224.
[16] Park N,Xu H,Li X H,et al.Anthocyanin accumulation and expression of anthocyanin biosynthetic genes in radish(Raphanus sativus).Journal of Agricultural and Food Chemistry,2011,59(11):6034-6039.
[17] 孙勃,许映君,徐铁峰,等.青花菜不同器官生物活性物质和营养成分的研究.园艺学报,2010,37(1):59-64.
Sun B,Xu Y J,Xu T F,et al.Variation of bioactive compounds and nutrients among different organs of broccoli(Brassica oleracea var.Italica Planck).Acta Horticulturae Sinica,2010,37(1):59-64.(in Chinese with English abstract)
[18] 孙勃,许映君,袁高峰,等.花椰菜主要生物活性物质及抗氧化能力分析.核农学报,2010,24(2):330-335.
Sun B,Xu Y J,Yuan G F,et al.Bioactive compounds and their antioxidant capacity in cauliflower(Brassica oleracea L. ssp.Botrytis).Journal of Nuclear Agricultural Sciences,2010,24(2):330-335.(in Chinese with English abstract)
[19] Nishikawa F,Kato M,Hyodo H,et al.Ascorbate metabolism in harvested broccoli.Journal of Experimental Botany,2003,54(392):2439-2448.
[20] 罗娅.5个费约果品种果实多酚类物质含量及其抗氧化能力比较.食品科学,2014,35(23):88-91. Luo Y.Polyphenolic compounds and antioxidant acitivity of fruit of five Feijoa varieties.Food Science,2014,35(23):88-91.(in Chinese with English abstract)
[21] Brossa R,Lpez-Carbonell M,Jubany-Mar T,et al. Interplay between abscisic acid and jasmonic acid and its role in water-oxidative stress in wild-type,ABA-deficient,JA-deficient,and ascorbate-deficient Arabidopsis plants. Journal of Plant Growth Regulation,2011,30:322-333.
[22] 李华,李佩洪,王晓宇,等.抗氧化检测方法的相关性研究.食品与生物技术学报,2008,27(4):6-11.
Li H,Li P H,Wang X Y,et al.Relativity about ten antioxidant methods.Journal of Food Science and Biotechnology,2008,27(4):6-11.(in Chinese with English abstract)
[23] 朱玉昌,焦必宁.ABTS法体外测定果蔬类总抗氧化能力的研究进展.食品与发酵工业,2005,31(8):77-80.
Zhu Y C,Jiao B N.Research progress on ABTS assay in determination of TAA in fruits and vegetables in vitro.Food and Fermentation Industries,2005,31(8):77-80.(in Chinese with English abstract)
Analysis of bioactive compounds and antioxidant capacities in green radish and red radish.Journal of Zhej iang University(Agric.&Li fe Sci.),2015,41(1):75-81
Zhang Haoyue1,WU Yimei1,Xia Xue1,Liu Dan1,Chen Qing1,Zhang Fen1,Hou Yanxia2,Ma Jie3,Tang Haoru1,Sun Bo1*(1.College of Horticulture,Sichuan Agricultural University,Ya’an,Sichuan 625014, China;2.Shanxi Forestry Vocational and Technical College,Taiyuan 030009,China;3.Bijie Institute of Agricultural Science,Bijie 551700,Guizhou,China)
bioactive compounds;antioxidant capacities;green radish;red radish;edible parts
S 631
A
10.3785/j.issn.1008-9209.2014.07.111
四川省教育厅重点项目资助(14ZA0016).
孙勃,Tel:+86 835 2882293;E-mail:14099@sicau.edu.cn
联系方式:张皓月,E-mail:haoyuecheung@163.com
2014 07 11;接受日期(Accepted):2014 08 27;
日期(Published online):2015 01 19 URL:http://www.cnki.net/kcms/detail/33.1247.S.20150119.1657.007.html
