法舒地尔对老年慢性阻塞性肺疾病合并肺动脉高压的随机对照研究
2015-06-01胡燕霞
胡燕霞,柳 毅
法舒地尔对老年慢性阻塞性肺疾病合并肺动脉高压的随机对照研究
胡燕霞,柳 毅
目的 评价法舒地尔对慢性阻塞性肺疾病(COPD)合并肺动脉高压(PAH)的临床疗效、安全性及其对血浆细胞因子白介素-1(IL-1)、白介素-6(IL-6)及内皮素-1(ET-1)表达的影响。方法 将90例COPD合并PH患者随机分为治疗组和对照组,每组45例,进行随机对照临床试验。治疗组在基础治疗的基础上,用法舒地尔注射液20 mL+5%葡萄糖注射液250 mL,iv gtt,q24h治疗;对照组在基础治疗的基础上,给予生理盐水20 mL+5%葡萄糖注射液250 mL,iv gtt,q24h治疗,两组疗程均为15 d。观察两组患者在治疗初始以及治疗15 d动脉氧分压(PaO2)、动脉血氧饱和度(SaO2)、平均肺动脉压(mPAP)及6 min步行试验变化、治疗有效率;采用ELISA法测定两组患者在治疗初始以及治疗15 d血清IL-1、IL-6、ET-1值的变化。结果 治疗组PaO2、SaO2、平均肺动脉压、6 min步行试验改善情况明显优于对照组,差异有统计学意义(P<0.05);且治疗组IL-1、IL-6、ET-1浓度明显低于治疗前(P<0.05);治疗组IL-1、IL-6、ET-1浓度明显低于对照组(P<0.05)。结论 法舒地尔注射液治疗COPD合并PAH患者的临床疗效明显优于对照组,且未发现明显毒副作用,其作用机制可能与法舒地尔注射液能有效降低COPD合并PAH患者血浆IL-1、IL-6及ET-1的水平有关。
法舒地尔注射液;慢性阻塞性肺疾病;肺动脉高压;白介素-1;白介素-6;ET-1
0 引言
慢性阻塞性肺疾病(COPD)是累及气道、肺实质以及肺血管的肺部慢性炎症。临床研究表明,其慢性炎症由多种炎症介质如IL-1、IL-6及ET-1等介导。法舒地尔作为Rho激酶选择性抑制剂,在临床上主要用于改善和预防各种病因导致的脑缺血症状。自1996年法舒地尔在日本上市以来,其对于肺血管的作用一直受到研究者的广泛关注,大量的动物实验和临床研究均表明法舒地尔能够安全有效地治疗肺动脉高压(PAH)。本研究通过随机临床试验,观察法舒地尔注射液治疗COPD合并PAH患者的有效性和安全性。同时观察法舒地尔注射液对COPD急性加重期患者的血清细胞因子IL-1、IL-6及ET-1水平的影响,探讨法舒地尔治疗COPD合并PAH的机制,为临床用药提供评价依据。
1 对象与方法
1.1 病例选择 90例COPD合并PAH患者均系九江市第一人民医院呼吸科2011年1月至2012年12月的住院患者。所有患者均签署临床试验知情同意书。
1.1.1 诊断标准 超声心动图诊断标准:目前国际推荐超声心动图拟诊 PAH 的肺动脉收缩压标准为>40 mmHg,COPD相关性PAH的定义为:静息状态平均肺动脉压(mPAP)>25 mmHg或运动状态mPAP>30 mmHg,重度肺动脉高压为mPAP>45 mmHg。
1.1.2 纳入标准 ①符合慢性阻塞性肺疾病诊断标准的住院患者;②符合肺动脉高压诊断标准;③患者签署知情同意书;④患者年龄60~80岁。
1.1.3 排除标准 有肺动脉瓣及右室流出道狭窄、三尖瓣病变、下肢功能障碍不能进行6 min步行试验(6MWD)、严重肝肾功能损害、体循环压较低的患者(血压<90/50 mmHg)或高血压患者(血压>170/110 mmHg)。
1.2 试验设计 本试验采用随机、单盲对照的临床药物试验方法,单盲对象为所有参与本试验的受试者。采用SAS统计分析系统,给定种子数,由计算机生成随机数字表,并且选择与本试验无关的其他专业人员按随机数字表将对应的分组代码装入信封,临床医生选择符合条件的受试者,按分组代码将受试者选择进入不同的试验分组。
1.3 治疗方法 所有符合入选标准的患者按照以上方法随机分为治疗组和对照组,每组45例,疗程为15 d,所有受试者均接受基础治疗。基础治疗包括:①控制性氧疗(2 L/min);②用头孢类抗菌药物作为抗感染药物治疗;③祛痰选用沐舒坦(氨溴索);④解痉选用多索茶碱。在此基础治疗上,治疗组给予法舒地尔注射液20 mL+5%葡萄糖注射液250 mL,iv gtt;对照组给予生理盐水20 mL+5%葡萄糖注射液250 mL,iv gtt。
1.4 观测指标
1.4.1 治疗前与治疗15 d后,详细询问患者病史,观察临床症状、体征,同时行血气分析测量PaO2、SaO2,心脏彩色超声测量mPAP,记录6 min步行距离。
1.4.2 实验室指标 两组患者于治疗前、治疗15 d后抽取外周静脉血5 mL。采用ELISA法检测IL-1、IL-6、ET-1,试剂盒由北方免疫试剂研究所提供。
1.4.3 疗效判断标准 显效:无明显紫绀,缺氧症状明显改善,呼吸困难显著改善,动脉PaO2升高>30 mmHg,超声心动图提示肺动脉收缩压评估下降30~40 mmHg;有效:紫绀减轻,缺氧症状轻度改善,呼吸困难较前缓解,PaO2升高>10 mmHg,超声心动图提示肺动脉收缩压评估下降10~20 mmHg;无效:紫绀及呼吸困难无改善,或病情加重。

2 结果
2.1 两组一般资料比较 2011年l月至2012年12月COPD合并PAH的老年患者90例,其中男68例,女22例。对照组45例,平均年龄(72.4±8.9)岁,有吸烟史24例,病史13~22年,平均19年;治疗组45例,平均年龄(75.6±10.1)岁,有吸烟史19例,病史10~23年,平均18年。两组患者的年龄、性别、病因、病程、病情比较差异无统计学意义(P>0.05),具有可比性。
2.2 两组疗效比较 治疗组显效31例,有效12例,无效2例,总有效率95.6%;对照组显效24例,有效11例,无效10例,总有效率77.8%。治疗组总有效率高于对照组(χ2=6.15,P=0.013)。
2.3 两组治疗前后动脉血气、心脏彩色多普勒比较 治疗后,治疗组PaO2高于对照组(P=0.00),SaO2高于对照组(P=0.00),平均肺动脉压低于对照组(P=0.031)。见表1。
2.4 6 min步行试验结果 治疗组6MWD为(245±19)m、(381±32)m,治疗前后差异有统计学意义(P=0.00);对照组为(238±16)m、(328±19)m,治疗前后比较差异有统计学意义(F=574.8,P=0.00)。治疗后,治疗组6MWD较对照组显著延长(P=0.00)。
2.5 两组患者治疗前后血浆IL-1、IL-6及ET-1水平比较 治疗前两组IL-1、IL-6、ET-1比较差异无统计学意义(P>0.05);治疗15 d后,治疗组IL-1、IL-6、ET-1明显降低(P<0.05)且低于对照组(P<0.05)。见表2。

表1 治疗前、后两组mPAP、PaO2、SaO2比较
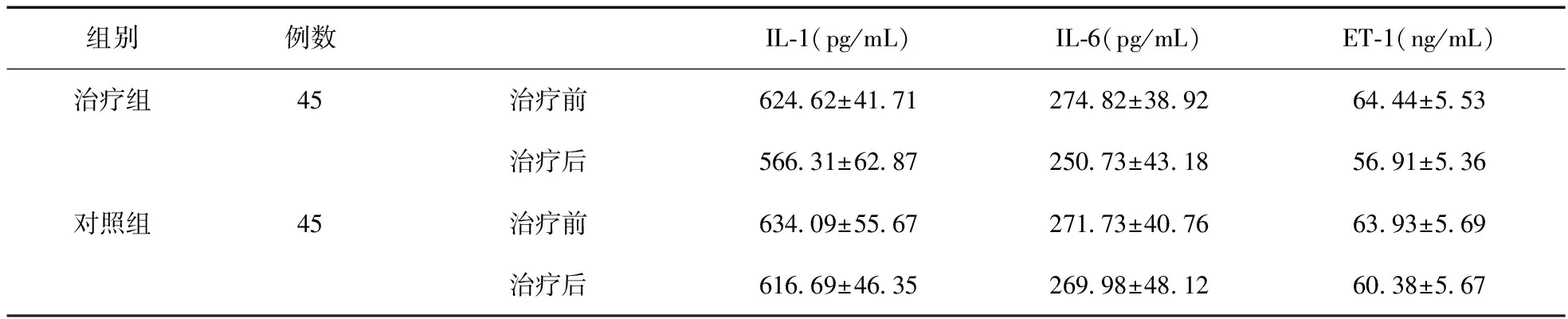
表2 治疗前、后两组IL-1、IL-6、ET-1比较
3 讨论
COPD发病率及致残率均日益增高,有报道,2030年COPD将成为全世界第3大致死性疾病,死亡人数将接近全球死亡总数的8.5%,给社会和个人均带来了沉重的负担[1]。COPD容易进展至PAH,邹霞英等[2]通过观察发现,88例未经系统规范治疗的COPD患者,经20年随访,5年并发PAH的有9例(10.2%),10、15、20年分别为24例(27.3%)、32例(35.2%)、36例(40.9%)。COPD合并PAH的主要机制为缺氧性肺血管收缩、肺血管内皮功能失调和肺血管重塑。研究表明,慢性缺氧和野百合碱所致大鼠PAH模型以及严重PAH患者肺组织和肺动脉中Rho激酶活性均显著增高[3-4]。Rho激酶是一种通过细胞内信号转导作用调节血管平滑肌细胞收缩、细胞迁移、增殖以及凋亡等的酶类,其抑制剂法舒地尔可以渗透入血管平滑肌细胞,与ATP竞争Rho激酶催化区的ATP结合位点,特异地阻断Rho激酶活性,使收缩的血管平滑肌松弛,减轻肺动脉压力。
本组数据结果显示,对照组治疗后,mPAP与治疗前比较未见明显改变,而治疗组治疗后患者肺动脉高压明显改善、动脉血氧分压增高、6 min步行距离明显增加。治疗前,两组IL-1、IL-6、ET-1浓度无明显差异(P>0.05);治疗15 d后,治疗组IL-1、IL-6、ET-1浓度明显降低(P<0.05),且低于对照组(P<0.05)。这是因为法舒地尔作为Rho激酶抑制剂,可通过调节内皮素-1和5-羟色胺降低肺血管肌化及肌动蛋白应力纤维形成,改善COPD患者血管内皮功能,减少IL-6、ET-1等炎症介质的产生,从而减少缩血管细胞因子致肺血管收缩[5];同时,Rho激酶抑制剂能增加eNOS表达,减少炎性细胞移行和炎性分子的上调[6-8],抑制Ang Ⅱ诱导单核细胞趋化因子蛋白-l mRNA表达,降低肺血管收缩和重构[9],增加舒血管因子的表达,减轻血管的重塑,降低肺动脉压力,提高患者运动耐量,改善患者的生存状态[10-11]。法舒地尔可以改善低氧血症、减少肺部炎症、恢复血管内皮功能,使内皮细胞分泌ET-1减少、NO合成增加,肺动脉舒张,血管剪切力减弱,血液对血管壁的压力减少,因此,刺激内皮细胞分泌IL-1、IL-6等细胞因子减少[12-13]。由于肺动脉压力下降,患者运动耐量增强。
总之,法舒地尔作为一种特殊的Rho激酶抑制剂,在治疗COPD继发PAH有一定的疗效,能有效减少COPD患者外周血IL-1、IL-6、ET-1的浓度,降低患者肺动脉高压,增加患者的运动耐量,提高患者生活质量,有望成为一种相对经济有效的治疗PAH的新型药物。
[1] 刘贤兵,陈传辉,张伟.圣乔治呼吸问卷在评估中重度慢性阻塞性肺疾病患者治疗效果中的价值[J].重庆医学,2011,40(10):939-941.
[2] 邹霞英,辛达临,李志斌.慢性阻塞性肺疾病与肺动脉高压自然病程的探讨[J].国际呼吸杂志,2008,28(15):904-906.
[3] 张锐,刘岽,袁平,等.Rho激酶抑制剂治疗肺动脉高压的研究进展[J].中华医学杂志,2010,26(90):1869-1871.
[4] Huang JB,Liu YL,Sun PW,et al.Novel strategy for treatment of pulmonary hypertension:enhancement of apoptosis[J].LUNG,2010,188(3):179-189.
[5] Gao Y,Raj JU.Regulation of the pulmonary circulation in the fetus and newborn[J].Physiol Rev,2010,90(4):1291-1335.
[6] Loirand G,Guérin P,Pacaud P.Rho kinase in cardiovascular physiology and pathophysiology[J].Cire Res,2006,98:322-334.
[7] Morrell NW,Adnot S,Archer SL,et a1.Cellular and molecular basis of pulmonary arterial hypertension[J].J Am Coil Cardiol,2009,54(1 Supple):S20-S31.
[7] Olson MF.Applications for ROCK kinase inhibition[J].Curr Opin Cell Biol,2009,20(2):242-248.
[8] Do.e Z,Fukumoto Y,Takaki A,et a1.Evidence for Rho-kinase activation in patients with pulmonary arterial hypertension[J].Circ J,2009,73:1731-1739.
[9] Guilluy C,Rolli-Derkinderen M,Tharaux PL,et a1.Transglutaminase-dependent RhoA activation and depletion by serotonin in vascular smooth muscle cells[J].J Biol Chem,2007,282:2918-2928.
[10]Shimokawa H.Rho-kinase as a novel therapeutic target in treatment of cardiovascular diseases[J].J Cardiovasc Pharmacol,2002,39:319-327.
[11]Higashi M,Shimokawa H,Hattori T,et al.Long-term inhibition of Rho-kinase suppresses angiotensin II-induced cardiovascular hypertrophy in rats in vivo:effect on endothelial NAD(P)H oxidase system[J].Circ Res,2003,93:767-775.
[12]Shimokawa H,Takeshita A.Rho-kinase is an important therapeutic target in cardiovascular medicine[J].Arterioscler Thromb Vasc Biol,2005,25:1767-1775.
[13]Sugimoto M,Nakayama M,Goto TM,et a1.Rho-kinase phosphorylates eNOS at threonine 495 in endothelial cells[J].Biochem Biophys Res Commun,2007,361(2):462-467.
Randomized controlled study of the effects of fasudil on elderly patients with chronic obstructive pulmonary disease complicated with pulmonary arterial hypertension
HU Yan-xia,LIU Yi
(Jiujiang First People′s Hospital,Jiangxi 332000,China)
Objective To investigate the clinical efficacy and safety of fasudil on patients with chronic obstructive pulmonary disease(COPD)with pulmonary arterial hypertension(PAH)and the influence on plasma cytokines interleukin-l(IL-1),interleukin-6(IL-6)and endothelin-1(ET-1).Methods Ninety patients were randomly divided into treatment group(n=45) and control group(n=45).Patients in treatment group received fasudil injection 20 mL+5% glucose injection 250 mL,iv gtt,q24h,patients in control group were given normal saline 20 mL+5% glucose injection 250 mL,iv gtt,q24h.The two groups were treated for 15 days on the basis of basic therapy.The partial pressure of oxygen(PaO2),arterial oxygen saturation(SaO2),mean pulmonary arterial pressure(mPAP)and 6 minute walking distance(6MWD),IL-1,IL-6,ET-1 were detected before and after treatment.Results The treatment group got a significant improvement on PaO2,SaO2,mPAP,6MWD and a lower level of IL-1,IL-6 and ET-1 after treatment(P<0.05).Compared with control group,lower level of IL-1,IL-6 and ET-1 were observed in the treatment group(P<0.05).Conclusion Treatment of fasudil in patients with COPD complicated with PAH achieved better curative effect than control group,which might be correlated with IL-1,IL-6 and ET-1.
Fasudil hydrochloride injection;Chronic obstructive pulmonary disease;Pulmonary arterial hypertension;Interleukin-1;Interleukin-6;ET-1
2014-04-09
江西省九江市第一人民医院,江西 332000
10.14053/j.cnki.ppcr.201501031
