表没食子儿茶素没食子酸酯通过抑制Akt信号通路诱导大肠癌细胞凋亡
2015-06-01计春燕谭诗云
计春燕 谭诗云
表没食子儿茶素没食子酸酯通过抑制Akt信号通路诱导大肠癌细胞凋亡
计春燕 谭诗云
目的 探讨表没食子儿茶素没食子酸酯(EGCG)对大肠癌细胞系HT-29细胞增殖和凋亡的影响及可能的作用机制。 方法 体外培养的HT-29细胞,分为对照组和实验组,实验组和对照组加入同等体积的培养基,实验组用不同浓度(15~120 μg/ml)EGCG分别处理24、48、72 h,MTT比色法测定其对HT-29细胞增殖的影响;EGCG(浓度分别为0、15、30、60 μg/ml)处理HT-29细胞48 h后,流式细胞仪检测细胞凋亡,分光光度计检测Casepase-9相对活性,Rho123探针染色流式细胞仪检测线粒体膜电位变化,Western blot法检测Bax、Bcl-2、Akt、p-Akt、p-GSK-3β的表达。 结果 EGCG能有效抑制HT-29细胞增殖,且呈剂量和时间依赖性;EGCG(15、30、60 μg/ml)作用于HT-29细胞48 h后,细胞凋亡率分别为11.6%、23.4%、34.5%;Bax表达量上调,而Bcl-2表达量下调;Casepase-9相对活性显著增加;线粒体膜电位显著降低;此外,EGCG可抑制p-Akt及其下游蛋白p-GSK-3β的表达。 结论 EGCG可通过抑制HT-29细胞增殖并促进其凋亡,其作用机制可能与抑制Akt信号通路,继而激活线粒体凋亡途径相关。
表没食子儿茶素没食子酸酯; HT-29细胞; 凋亡; Akt信号通路
大肠癌是常见的消化道恶性肿瘤,其死亡率高居肿瘤相关死亡的第2位。全球每年有>120万的新增病例,并有>60万大肠癌患者死亡[1-2]。随着我国经济的发展、人民生活水平的提高、生活方式的西方化及体力活动的减少等因素,大肠癌的发病率和死亡率逐渐上升。大肠癌治疗方法以手术切除为主,辅以化疗,但常规的化疗药物毒性大且常出现耐药性,因此寻找具有抗肿瘤活性的天然化合物成为国内外研究热点。近年来研究发现绿茶中富含儿茶素,其具有多种药理学活性,包括抗肿瘤、抗炎、降血压、降脂、降血糖及抗氧化等。其中表没食子儿茶素没食子酸酯(epigallocatechingallate, EGCG)是儿茶素中含量最高、活性最强的单体,国内外研究证实,EGCG对前列腺癌、肝癌、乳腺癌等多种肿瘤细胞均有抑制作用[3-5]。
Akt信号通路在细胞代谢、增殖、凋亡及肿瘤发生发展过程中起重要调控作用,过度激活的Akt通路可促进细胞增殖并抑制细胞凋亡[6-7]。本研究旨在探讨EGCG对大肠癌HT-29细胞增殖和凋亡的影响,探讨其对Akt信号通路的影响,并分析其作用机制,以期为临床应用提供理论研究基础。
1 材料与方法
1.1 主要材料 大肠癌细胞HT-29细胞购自中国科学院上海细胞库;EGCG、罗丹明123(Rhodamine 123, Rho123)购自sigma公司;AnnexinV/PI试剂盒购于BENDER公司;胎牛血清、RPMI1640培养液购于碧云天生物技术研究所;MTT试剂盒、辣根酶标记山羊抗兔或山羊抗鼠IgG购于武汉谷歌生物科技有限公司;Caspase-9活性检测试剂盒购于南京凯基生物科技发展有限公司;Akt, p-Akt (Ser473), p-GSK-3β (Ser9), Bax, Bcl-2 及β-actin抗体购自Cell Signaling Technology公司。
1.2 方法
1.2.1 细胞培养:HT-29细胞培养于RPMI1640培养液中(含10%小牛血清,100 U/ml青霉素,100 μg/ml链霉素),置于37 ℃,饱和湿度,5%CO2培养箱内培养,根据生长情况2~3 d传代1次,取对数生长期细胞用于实验。
1.2.2 MTT比色法检测细胞活力:取对数生长期的HT-29细胞,调整细胞浓度(1×104/ml)种于96孔板内,每孔200 μl,细胞贴壁后分为对照组和实验组,实验组换EGCG终浓度为15、30、60、120 μg/ml的培养液,对照组加入等量的培养液,每组5个复孔,并设置调零孔(不含细胞孔中加入等量的培养液)。继续培养24、48、72 h,于实验结束前4 h每孔加入20 μl MTT溶液,继续孵育4 h,小心吸掉上清,每孔加150 μl DMSO,摇床上振荡10 min,结晶充分溶解后酶标仪上检测490 nm处的吸光值(A值),根据公式计算细胞活力:细胞活力(%)=[(实验组平均A值-调零孔A值)/(对照组平均A值-调零孔A值)]×100%。
1.2.3 流式细胞仪检测细胞凋亡:将对数生长期细胞(浓度为1×106/ml)接种于6孔板中,贴壁后分为对照组和实验组,实验组加入含EGCG(终浓度为0、15、30、60 μg/ml)的培养液,对照组加入等量培养液,继续培养48 h后,收集细胞,离心、洗涤后加入AnnexinV-FITC 和PI,室温避光染色。筛网过滤后送上流式细胞仪检测细胞凋亡率。
1.2.4 分光光度法检测Caspase-9活性变化:细胞接种及分组同上,收集细胞,分别加入50 μl冷裂解缓冲液,冰浴裂解15 min,然后4 ℃,1200 r/min离心15 min,将上清移至预冷的离心管中,置于冰上,取5 μl用BCA法测定蛋白浓度,取50 μl调好蛋白浓度(2~4 g/L),加入20 μl缓冲液吹打均匀,加入5 μl Caspase-9反应底物Ac-LEHD-pNA,细胞培养箱中避光孵育4 h,酶标仪上405 nm处测定吸光值(A405)。
1.2.5 Rho123染色流式细胞仪检测细胞线粒体膜电位水平:细胞接种及分组同上,收集细胞,PBS漂洗3次,重悬于1 ml的1 μg/ml Rho123中,放置培养箱中继续孵育30 min。PBS再洗涤3次,用EPICS-XL型流式细胞仪以507 nm为激发波长,529 nm为发射波长测定细胞内荧光强度。
1.2.6 western blot检测Akt、 p-Akt (Ser473)、p-GSK-3β (Ser9)、Bax、Bcl-2蛋白表达变化:细胞接种及分组同上,收集细胞,参照细胞浆蛋白抽提试剂盒的说明书提取细胞总蛋白,BCA法测定蛋白浓度,蛋白样品加入1/5体积的5×上样缓冲液,沸水煮沸5 min后上样(20 μg/孔),行10%SDS-聚丙烯酰胺凝胶电泳,后电转至PVDF膜上,5%脱脂奶粉室温封闭1 h,分别加入1∶1000稀释的兔抗或鼠抗人Akt、 p-Akt (Ser473)、 p-GSK-3β (Ser9)、 Bax及Bcl-2蛋白,4 ℃过夜,β-actin作为内参,TBST洗膜后加入1∶1000稀释的辣根酶标记的山羊抗兔或山羊抗鼠IgG,室温孵育2 h,再次洗膜后加入ECL发光液显色,观察各条带深浅变化。
1.3 统计学分析 所有资料经SPSS 17.0统计软件处理,计量资料以均数±标准差表示,两样本间参数比较采用独立样本t检验,以P< 0. 05 为差异具有统计学意义。
2 结果
2.1 EGCG对HT-29细胞活力的影响 EGCG在15~120 μg/ml浓度范围内均能抑制HT-29细胞的活力,且随着药物浓度的增加,抑制作用越明显,同一药物浓度,随着作用时间的延长,细胞活力亦逐渐降低,呈显著的剂量和时间依赖效应。见表1。

表1 EGCG对HT-29细胞活力的影响
注:与EGCG 0 μg/ml比较,*P<0.05
2.2 EGCG对HT-29细胞凋亡的影响 HT-29细胞经EGCG处理后行流式细胞仪凋亡检测结果显示,EGCG(15、30、60 μg/ml)处理后,细胞凋亡率较对照组的凋亡率(2.3%)明显升高,分别为11.6%、23.4%、34.5%。见图1。

图1 EGCG对HT-29细胞凋亡率的影响
2.3 EGCG对HT-29细胞Bax、Bcl-2表达的影响 Western blot结果显示,EGCG(15、30、60 μg/ml)作用HT-29细胞48 h后,Bax蛋白表达随着药物浓度的升高也逐渐增加,而Bcl-2蛋白表达量则逐渐降低,呈浓度依赖性。见图2。
2.4 EGCG对HT-29细胞Caspase-9活性的影响 Caspase-9活性检测结果显示,EGCG(15、30、60 μg/ml)处理后,HT-29细胞Caspase-9相对活性分别为0.177±0.04、0.231±0.05和0.306±0.04,与对照组(0.108±0.03)比较,Caspase-9相对活性明显升高(P<0.05)。
2.5 EGCG对HT-29细胞线粒体膜电位的影响 细胞
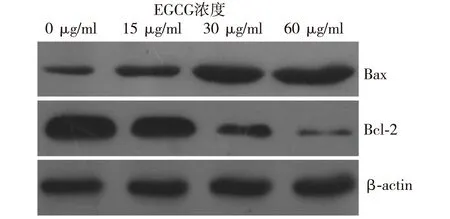
图2 EGCG对HT-29细胞Bax、Bcl-2表达的影响
线粒体膜电位检测结果发现,EGCG(15、30、60 μg/ml)处理48 h后,HT-29细胞线粒体荧光强度随着药物浓度的升高逐渐降低,分别为76.48±2.34、56.32±2.46、37.76±2.16(P<0.05);Rho123荧光强度值可间接反映线粒体膜电位(MMP)相对强度。结果显示EGCG能降低HT-29细胞的线粒体膜电位。
2.6 EGCG对HT-29细胞Akt信号通路的影响 EGCG(15、30、60 μg/ml)作用HT-29细胞48 h后,Western blot 检测Akt信号通路相关蛋白,细胞总的Akt表达量没有变化,而p-Akt表达减少,同时,Akt下游效应蛋白p-GSK-3β表达也减少,且呈浓度依赖性。表明EGCG能抑制Akt磷酸化,并抑制下游蛋白的活性,即抑制Akt信号通路。见图3。

图3 EGCG对HT-29细胞Akt信号通路相关蛋白表达的影响
3 讨论
细胞凋亡是维持多细胞机体平衡的一个重要生理机制,细胞过度增殖及凋亡不足在结肠癌发生发展中起重要作用[8],通过抑制细胞增殖并促进细胞凋亡可能是肿瘤治疗的有效途径。本研究发现,EGCG在15~120 μg/ml浓度范围内均能有效抑制HT-29细胞的增殖,且随着药物浓度的增加和作用时间的延长,抑制作用亦逐步增强,呈明显的剂量和时间依赖效应。此外,本研究进一步探讨了EGCG对是否通过促进细胞凋亡发挥抑制细胞的增殖作用。流式细胞仪结果显示,EGCG处理HT-29细胞后,细胞凋亡率明显升高。提示EGCG能抑制大肠癌细胞增殖并诱导细胞凋亡。
细胞凋亡是程序化、多基因调控的细胞死亡过程,凋亡过程受到凋亡促进蛋白和凋亡抑制蛋白的共同调节及其相互间协调。Bcl-2是一种内膜蛋白,主要存在于线粒体、内质网和核膜上,Bcl-2在多种肿瘤细胞中表达,是公认的强效凋亡抑制分子,主要是通过增强线粒体膜电位,保持线粒体内外膜的完整性,及抑制钙离子释放,阻止核酸内切酶活化等机制发挥抗凋亡作用[9-11];Bax亦属于Bcl-2家族成员,但其与Bcl-2作用相反,Bax可直接激活死亡效应因子Caspase或改变细胞膜通透性引起细胞色素C释放某些离子和小分子通过细胞膜,进而促进细胞凋亡[12]。细胞Bcl-2和Bax比例改变可调控细胞凋亡发生与否[13],当Bcl-2占优势时,细胞具有抗凋亡作用,反之,当Bax表达上调时,细胞易被诱导凋亡。本研究发现,HT-29细胞经EGCG处理48 h后,细胞Bax蛋白表达量逐渐升高,而Bcl-2蛋白表达量则逐渐降低,呈浓度依赖性。同时细胞线粒体膜电位降低,Caspase-9活性显著升高。Caspase家族的激活在细胞凋亡过程中扮演着至关重要的角色,被认为是诱发细胞凋亡的直接效应物。Caspase-9作为线粒体凋亡途径的关键酶,处于Caspase“瀑布式”激活的顶端,其活化可进一步激活Caspase-3,后者是细胞凋亡的“执行器”,其活化标志着凋亡进入不可逆阶段[14],继而裂解DNA修复相关分子、凋亡抑制蛋白、细胞外基质蛋白和骨架蛋白等,最终促进细胞凋亡。这些结果提示EGCG可能通过线粒体途径诱导HT-29细胞凋亡。
本研究进一步探讨了EGCG引起凋亡的机制。Akt及p-Akt在多种类型的肿瘤中过表达,p-Akt是Akt的活化形式,活化的Akt在介导细胞生长、增殖、侵袭转移、凋亡、抵抗化疗、放疗等方面有重要作用[15-16]。Akt磷酸化激活后,可对下游相关蛋白包括BAD、Caspase-9、GSK-3β、NF-κB等进行调节,最终促进细胞增殖并抑制细胞凋亡。Akt激活后可使BAD磷酸化,后者与Bcl-2或Bcl-xL解聚,游离的Bcl-2发挥凋亡抑制作用[17]。此外,Akt信号通路可直接或间接调控其他信号通路[18],因此,抑制Akt信号通路可能成为肿瘤治疗的有效方法。本研究发现,EGCG处理HT-29细胞后,细胞总Akt表达量没有变化,而p-Akt表达减少,同时,Akt下游效应蛋白p-GSK-3β表达也减少。表明EGCG能抑制Akt信号通路。
总之,本研究结果发现EGCG可抑制HT-29细胞增殖,并促进细胞凋亡,其机制可能与EGCG抑制Akt信号通路,继而激活线粒体凋亡途径相关。EGCG的潜在作用机制尚需进一步探索和研究,作为前景广阔的抗肿瘤药物,EGCG有望能成为高效低毒的抗肿瘤药物,单独或与传统化疗药物联合应用于临床。
[1] Strimpakos AS, Cunningham D, Mikropoulos C, et al. The impact of carcinoembryonic antigen flare in patients with advanced colorectal cancer receiving first-line chemotherapy [J]. Ann Oncol, 2010,21(5): 1013-1019.
[2] Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[3] 刘晓亮,袁长吉,庄平,等.EGCG对口腔鳞癌细胞增殖及信号传导通路的影响[J].华中科技大学学报:医学版,2013,42(5):530-534.
[4] 周薇,戴奇刚,邓鑫,等.EGCG对人肝癌细胞株HepG2裸鼠移植瘤COX-2、VEGF和bFGF表达的调控[J].中山大学学报:医学科学版,2013,34(3):364-370.
[5] 赵刚,李红,史海涛,等.EGCG对肝癌细胞HepG2凋亡及脂肪酸合酶表达的影响[J].西安交通大学学报:医学版,2014,35(2):245-248.
[6] Brazil DP, Yang ZZ, Hemmings BA. Advances in protein kinase B signalling: AKTion on multiple fronts[J]. Trends Biochem Sci, 2004, 29(5):233-242.
[7] Manning BD, Cantley LC. AKT/PKB signaling: navigating downstream[J]. Cell, 2007,129(7):1261-1274.
[8] LaCasse EC, Mahoney DJ, Cheung HH, et al. IAP-targeted therapies for cancer [J]. Oncogene, 2008, 27(28): 6252-6275.
[9] 邹成林,陈维均,孙晓顺,等.促血小板生成素对大鼠脑缺血再灌注脑组织的保护作用. [J].实用老年医学,2014,28(1):46-48.
[10]Gogada R, Prabhu V, Amadori M, et al. Reseratrol induces p53-independent, X-linked inhibitor of apoptosis protein (XIAP)-mediated Bax protein oligomerization on mitochondria to initiate cytochrome c release and caspase activation [J]. J Biol Chem, 2011, 286(33): 28749-28760.
[11]Pucci B, Bertani F, Karpinich NO, et al. Detailing the role of Bax translocation, cytochrome C release, and perinuclear clustering of the mitochondria in the killing of HeLa cells by TNF [J]. J Cell Physiol, 2008, 217(2): 442-449.
[12]马增煌.A1蛋白与前列腺特异性抗原在前列腺癌与前列腺增生疾病中联合检测的意义[J].实用老年医学,2014,28(1):49-51.
[13]Kim KY, Seol JY, Jeon GA, et al. The combined treatment of aspirin and radiation induces apoptosis by the regulation of bcl-2 and caspase-3 in human cervical cancer cells[J]. Caner Lett, 2003, 189(2): 157-166.
[14]Mazumder S, Plesca D, Almasan A. Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis [J].Methods Mol Biol, 2008, 414: 13-21.
[15]Vivanco I, Sawyers CL. The phosphatidylinositol 3-kinase AKT pathway in human cancer[J]. Nat Rev Cancer, 2002, 2(7): 489-501.
[16]Lindsley CW. The Akt/PKB family of protein kinases: a review of small molecule inhibitors and progress towards target validation: a 2009 update[J]. Curr Top Med Chem, 2010, 10(4):458-477.
[17]Wang Z, Yang J, Fisher T, et al. Akt activation is responsible for enhanced migratory and invasive behavior of arsenic-transformed human bronchial epithelial cells[J]. Environ Health Perspect, 2012, 120(1):92-97.
[18]Song L, Xiong H, Li J, et al.Sphingosine kinase-1 enhances resistance to apoptosis through activation of PI3K/Akt/NF-êB pathway in human non-small cell lung cancer[J]. Clin Cancer Res, 2011, 17(1): 1839-1849.
EGCG induces cell apoptosis through inhibiting Akt signaling pathway in HT-29 colorectal cancer cells
JIChun-yan.DepartmentofGastroenterology,HubeiXinhuaHospital,Wuhan430015,China;TANShi-yun.DepartmentofGastroenterology,People’sHospitalofWuhanUniversity,Wuhan430060,China
Objective To investigate the effect of epigallocatechingallate (EGCG) on cell proliferation and apoptosis in colorectal cancer line HT-29 cells and to explore the possible mechanisms. Methods HT-29 cells were cultured in vitro, and were divided into two groups, control group and drug-treated group. The control group received only the culture medium. After treatment by EGCG at different concentrations respectively at different time, the cell survival was determined by MTT method. Apoptosis was detected by flow cytometry. The relative activity of caspase-9 was monitored by spectrophotometer. The mitochondrial membrane potential was evaluated by flow cytometry analysis after Rho123 probe staining. Western blot was used for Bcl-2, Bax, Akt, p-Akt and p-GSK-3β protein analysis. Results From the data of MTT, the cell proliferation of HT-29 cells was inhibited by EGCG at a dose-dependent and time-dependent manner. Flow cytometry analysis showed that EGCG significantly induced cell apoptosis. After treatment with EGCG(15,30,60 μg/ml) , the apoptosis rate of HT-29 cells was 11.6%, 23.4%, 34.5%, which showed an obvious concentration-effect relationship. The treatment with EGCG promoted the expression of pro-apoptotic factor Bax, and suppressed the expression of anti-apoptotic factor Bcl-2. The relative activity of caspase-9 of EGCG group was increased. Furthermore, the mitochondrial membrane potential was reduced. The data of western blot showed that EGCG decreased the expression of p-AKT and downstream effector of Akt, p-GSK-3β at a dose-dependent manner. Conclusions EGCG inhibits the cell proliferation and induces cell apoptosis of HT-29 cells, and the effects of antitumor may be associated with inhibition of the Akt signaling pathway, thus activating mitochondria apoptosis pathway.
epigallocatechingallate; HT-29 cell; apoptosis; Akt signaling pathway
湖北省自然科学基金课题(302-131854)
430015湖北省武汉市,湖北省新华医院消化内科(计春燕);430060湖北省武汉市,武汉大学人民医院消化内科(谭诗云)
R 735.34
A
10.3969/j.issn.1003-9198.2015.07.019
2014-08-15)
