长链非编码RNA及其在胃癌中的作用
2015-06-01于航杨爱明陆星华
于航,杨爱明,陆星华
中国医学科学院北京协和医学院北京协和医院消化内科,北京100730
长链非编码RNA及其在胃癌中的作用
于航,杨爱明,陆星华
中国医学科学院北京协和医学院北京协和医院消化内科,北京100730
长链非编码RNA;胃癌
人类基因组DNA约93%被转录为RNA,其中仅2%的核酸序列用于编码蛋白质,其余98%的核酸序列均为编码能力极低甚至无编码功能的非编码RNA (noncoding RNA,ncRNA),且其中绝大多数被转录成长度>200个核苷酸的所谓“长链非编码RNA(long noncoding RNA,lncRNA)”[1]。长期以来,这些不具有蛋白编码潜能的基因组序列曾被认为是基因组在进化过程中积累的无功能“垃圾序列”而未受到重视。近年来,随着高通量测序等技术的广泛应用,越来越多的研究数据显示,lncRNA在表观遗传学调控、转录和转录后调控等在内的多个层面上参与机体多种生理和病理过程的调节。本文结合近年来针对lncRNA的研究现状,对lncRNA结构、分类、调控机制及与胃恶性肿瘤的关系进行综述。
长链非编码RNA结构
lncRNA指长度大于200个核苷酸的非编码RNA转录本,这一概念由日本科学家Okazaki等[2]于2002年首次提出,他们在对小鼠全长cDNA文库大规模测序过程中发现了大量较长的非编码RNA转录本,然而并未针对其功能作进一步研究。2007年,Rinn等[3]报道了一条长2.2 kb的功能性长链非编码RNA HOTAIR,并发现HOTAIR可以与多梳蛋白复合体相互作用,参与机体生长发育过程的调节。此后,lncRNA得到了越来越多的关注,并且随着高通量测序技术的发展,研究人员得以鉴定出更多的lncRNA,并进一步研究了其功能。
lncRNA可位于细胞核或细胞质中,多由RNA聚合酶Ⅱ转录。lncRNA长度变异性较大,部分可长至100 kb[4]。有研究估计,人类基因组中约有15 000个lncRNA,其转录水平低于蛋白编码基因,并具有组织特异性[5]。
虽然lncRNA在转录本中占很大比例,但目前已明确分子结构的 lncRNA仅占极少数。Niazi等[6]对204个功能性lncRNA进行分析,发现了lncRNA部分结构特征,包括内含子数量少、碱基对中GC含量低、缺乏起始密码子和开放阅读框架等。Novikova等[7]研究发现,部分 lncRNA通过与小 RNA(microRNA,miRNA)配对结合,而对编码基因表达水平进行转录后调节;部分 lncRNA可以和信使 RNA(messenger RNA,mRNA)反义结合调控其剪切过程。此外,lnc-RNA分子的二级结构和三级结构也在其调控功能中发挥重要作用。
长链非编码RNA分类
依据lncRNA基因与编码基因间的位置关系,可以将其分为5类[8]:(1)正义lncRNA(sense lncRNA):与正义链上另一转录本的一个或多个外显子重叠; (2)反义lncRNA(antisense lncRNA):与反义链上另一转录本的一个或多个外显子重叠;(3)双向lnc-RNA(bidirectional lncRNA):与同一条链上的编码基因转录方向相比,可同时向其相同或相反方向进行转录;(4)内含子lncRNA(intronic lncRNA):由某一转录本的一个内含子区域转录形成;(5)基因间lnc-RNA(long intergenic noncoding RNA,lincRNA):不与编码基因重叠,而位于两个基因之间。
lincRNA是lncRNA家族的主要组成部分,约占总数的2/3。Khalil等[9]研究发现许多lincRNA都通过与多梳抑制复合体 2(polycomb repressing complex 2,PRC2)及其他染色质重塑复合体结合而发挥作用,而通过RNA干涉技术敲除PRC2相关lincRNA后,被PRC2抑制的基因可以重新得到活化。
长链非编码RNA作用机制
lncRNA通过各种方式作用于编码基因,调控编码基因的功能。关于lncRNA具体作用机制的研究尚处于探索阶段,目前发现可能的作用机制主要包括: (1)lncRNA的转录影响相邻编码基因表达;(2)转录后的lncRNA作为调控因子影响编码基因的表达[10]。
lncRNA转录本身即可对邻近编码基因的表达能力产生很大影响。发生转录的lncRNA若位于编码基因上游启动子区域,则可以干扰下游基因表达[11]。lnc-RNA转录还可导致组蛋白重塑,从而抑制与其重叠的编码基因表达[12]。
lncRNA分子可以作为调控因子作用于编码基因,影响后者的表达水平。lncRNA可以将蛋白质靶向结合到特定基因位点并发挥相应作用。有研究认为多梳蛋白家族常通过这种与lncRNA结合方式发挥作用,如PRC2家族EZH2通过与lncRNA RepA结合,而靶向结合至相应基因位点发挥组蛋白甲基转移酶的作用[13]。部分lncRNA是miRNA的前体分子,如Xist和Tsix两种lnc-RNA可作为miRNA前体分子产生长度约25~42个核苷酸的miRNA,并通过这些miRNA进一步发挥基因调控作用[14]。此外,有部分lncRNA可以通过碱基配对方式结合miRNA,并竞争性抑制这些miRNA与mRNA结合,进而影响miRNA的调控功能。还有一些lncRNA可以作为细胞内结构组分,介导核酸-蛋白质复合体的形成及维持细胞结构和正常有丝分裂功能。
长链非编码RNA与恶性肿瘤
恶性肿瘤的发生,常常与维持机体细胞正常生长、分化过程的基因异常调控有关。仅少数肿瘤由遗传性单基因突变所致,绝大部分肿瘤的发生是体细胞突变的结果。近年来关于肿瘤发生机制研究的一项重大进展,是由单纯在蛋白质编码基因中寻找肿瘤发生的基因机制,转变为在全基因组中寻找各种不同的调控组分。实际上,全基因组关联分析 (genomo-wide association studies,GWAS)结果发现,大多数恶性肿瘤的高危基因座都不在蛋白质编码区域,而是在编码基因内含子部分或基因间区域。因此,可以认为这些非编码位点在肿瘤发生过程中发挥了重要作用[15]。
近年来,对肿瘤组织和正常组织的对比研究发现,lncRNA在包括前列腺癌、结直肠癌、乳腺癌、膀胱癌、肝癌、胃癌在内的多种恶性肿瘤中均有异常表达 (表1)。这些lncRNA可以作为致癌或抑癌分子,对肿瘤细胞转录、染色质重塑、微血管侵袭等过程进行调控。lncRNA在恶性肿瘤组织中异常表达的特性,使其成为很好的肿瘤生物标志物,可在肿瘤早期诊断中发挥重要作用。
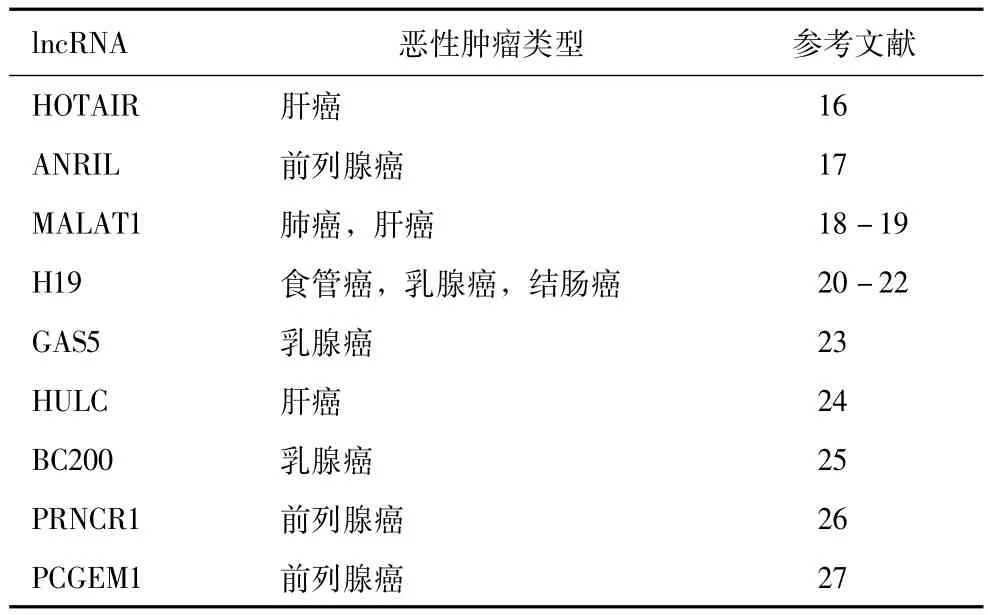
表1长链非编码RNA在不同恶性肿瘤中的异常表达
长链非编码RNA与胃癌
胃癌是最常见的消化道恶性肿瘤之一,位居肿瘤死因的第2位。近年来,许多研究发现,lncRNA可以作为致癌或抑癌因素,在胃癌的发生、发展中起重要作用 (表2)。
Zhang等[28]通过qRT-PCR技术,检测80例胃癌及癌旁正常组织中的lncRNA-H19表达水平,发现H19在胃癌组织中的表达水平明显高于正常组织,且H19表达水平与胃癌TNM分期及肿瘤浸润深度呈正相关。细胞功能实验发现,H19沉默表达可以抑制细胞增殖性。由此可以认为,H19在胃癌病因学及预后判断中具有重要作用。
除了lncRNA-H19,lncRNA-00152也被证实在胃癌发生中发挥致癌作用[29]。lncRNA-00152是新近发现的一种lncRNA,属于lincRNA。qRT-PCR结果显示,71例胃癌组织中lincRNA-00152表达水平明显高于癌旁正常组织,且其表达水平与肿瘤浸润深度存在相关性。统计学分析发现,lincRNA-00152对胃癌诊断的灵敏度和特异度分别达 62.5%和 68.1%,提示 lincRNA-00152可作为胃癌诊断的标志物。
除致癌作用外,lncRNA还可以作为抑癌因素发挥调控作用。Sun等[30]对72例胃癌组织及癌旁正常组织标本进行qRT-PCR分析,发现lncRNA-MEG3在胃癌组织中表达水平显著下降,且MEG3表达水平低者预后更差。细胞功能分析发现,过表达MEG3胃癌细胞系的细胞生长受到明显抑制;相反,胃癌细胞系MEG3沉默表达可以促进细胞增殖。针对MEG3作用机制的进一步研究显示,在过表达MEG3细胞系中,p53蛋白表达水平明显升高,提示MEG3可能通过激活p53基因而发挥抑癌作用。
研究发现,lncRNA-FENDRR也可在胃癌中发挥抑癌作用。Xu等[31]对158例胃癌组织及癌旁正常组织进行qRT-PCR分析,发现肿瘤组织中FENDRR表达量明显下降,而FENDRR表达下降可能通过抑制组蛋白去乙酰化酶 (histone deacetylase,HDAC)起作用。分析158例胃癌患者的临床资料,发现FENDRR表达水平与肿瘤浸润深度和淋巴结转移数目呈负相关。小鼠动物实验结果显示,注射过表达FENDRR胃癌细胞系的小鼠,胃癌肺转移结节数低于对照组,表明FENDRR可以降低胃癌细胞的转移能力。对FENDRR作用的分子机制研究发现,FENDRR通过在转录水平上负向调节纤维连接蛋白1(fibronectin 1,FN1)表达量,而影响细胞侵袭和转移能力。

表2长链非编码RNA在胃恶性肿瘤中的作用
展望
近年来,lncRNA在恶性肿瘤中的作用越来越受到重视,但与miRNA等小非编码RNA相比,lncRNA研究仍处于初始阶段,还面临许多困难。随着生物芯片技术、高通量测序技术等新一代测序技术的快速发展,将会有越来越多的lncRNA被发现,lncRNA在恶性肿瘤中的作用机制也会得到进一步深入研究,从而为癌症诊断、预后判断及治疗提供新的靶点。
[1]Kapranov P,Cheng J,Dike S,et al.RNA maps reveal new RNA classes and a possible function for pervasive transcription[J].Science,2007,316:1484-1488.
[2]Okazaki Y,Furuno M,Kasukawa T,et al.Analysis of the mouse transcriptome based on functional annotation of 60770 full-length cDNAs[J].Nature,2002,420:563-673.
[3]Rinn JL,Kertesz M,Wang J,et al.Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs[J].Cell,2007,129:1311-1323.
[4]Mercer TR,Dinger ME,Mattick JS.Long non-coding RNAs: insights into functions[J].Nat Rev Genet,2009,10: 155-159.
[5]Derrien T,Johnson R,Bussotti G,et al.The GENCODE v7 catalog of human long noncoding RNAs:analysis of their gene structure,evolution,and expression[J].Genome Res,2012,22:1775-1789.
[6]Niazi F,Valadkhan S.Computational analysis of functional long noncoding RNAs reveals lack of peptide-coding capacity and parallels with 3'UTRs[J].RNA,2012,18:825-843.
[7]Novikova IV,Hennelly SP,Sanbonmatsu KY.Sizing up long non-coding RNAs:Do lncRNAs have secondary and tertiary structure?[J].Bioarchitecture,2012,2:189-199.
[8]Ponting CP,Oliver PL,Reik W.Evolution and functions of long noncoding RNAs[J].Cell,2009,136:629-641.
[9]Khalil AM,Guttman M,Huarte M,et al.Many human large intergenic noncoding RNAs associate with chromatin-modifying complexes and affect gene expression[J].Proc Natl Acad Sci,2009,106:11667-11672.
[10]Wilusz JE,Sunwoo H,Spector DL.Long noncoding RNAs: functional surprises from the RNA world[J].Genes Dev,2009,23:1494-1504.
[11]Martens JA,Laprade L,Winston F.Intergenic transcription is required to repress the Saccharomyces cerevisiae SER3 gene[J].Nature,2004,429:571-574.
[12]Camblong J,Iglesias N,Fickentscher C,et al.Antisense RNA stabilization induces transcriptional gene silencing via histone deacetylation in S.cerevisiae[J].Cell,2007,131: 706-717.
[13]Zhao J,Sun BK,Erwin JA,et al.Polycomb proteins targeted by a short repeat RNA to the mouse X chromosome[J].Science,2008,322:750-756.
[14]Ogawa Y,Sun BK,Lee JT.Intersection of the RNAi and X-inactivation pathways[J].Science,2008,320:1336-1341.
[15]Cheetham SW,Gruhl F,Mattick JS,et al.Long noncoding RNAs and the genetics of cancer[J].Br Cancer,2013,108:2419-2425.
[16]Yang Z,Zhou L,Wu LM,et al.Overexpression of long noncoding RNA HOTAIR predicts tumor recurrence in hepatocellular carcinoma patients following liver transplantation[J].Ann Surg Oncol,2011,18:1243-1250.
[17]Yap KL,Li S,Munoz-Cabello AM,et al.Molecular interplay of the noncoding RNA ANRIL and methylated histone H3 lysine 27 by polycomb CBX7 in transcriptional silencing of INK4a[J].Mol Cell,2010,38:662-674.
[18]Ji P,Diederichs S,Wang W,et al.MALAT-1,a novel noncoding RNA,and thymosin beta4 predict metastasis and survival in early-stage non-small cell lung cancer[J].Oncogene,2003,22:8031-8041.
[19]Luo JH,Ren B,Keryanov S,et al.Transcriptomic and genomic analysis of human hepatocellular carcinomas and hepatoblastomas[J].Hepatology,2006,44:1012-1024.
[20]Hibi K,Nakamura H,Hirai A,et al.Loss of H19 imprinting in esophageal cancer[J].Cancer Ras,1996,56:480-482.
[21]Berteaux N,Lottin S,Monte D,et al.H19 mRNA-like noncoding RNA promotes breast cancer cell proliferation through positive control by E2F1[J].J Biol Chem,2005,280: 29625-29636.
[22]Tsang WP,Ng EK,Ng SS,et al.Oncofetal H19-derived miR-675 regulates tumor suppressor RB in human colorectal cancer[J].Carcinogenesis,2010,31:350-358.
[23]Mourtada-Maarabouni M,Pickard MR,Hedge VL,et al.GAS5,a non-protein-coding RNA,controls apoptosis and is downregulated in breast cancer[J].Oncogene,2009,28: 195-208.
[24]Panzitt K,Tschernatsch MM,Guelly C,et al.Characterization of HULC,a novel gene with striking up-regulation in hepatocellular carcinoma,as noncoding RNA[J].Gastroenterology,2007,132:330-342.
[25]Iacoangeli A,Lin Y,Morley EJ,et al.BC200 RNA in invasive and preinvasive breast cancer[J].Carcinogenesis,2004,25:2125-2133.
[26]Chung S,Nakagawa H,Uemura M,et al.Association of a novel long non-coding RNA in 8q24 with prostate cancer susceptibility[J].Cancer Sci,2011,102:245-252.
[27]Petrovics G,Zhang W,Makarem M,et al.Elevated expression of PCGEM1,a prostate-specific gene with cell growthpromoting function,is associated with high-risk prostate cancer patients[J].Oncogene,2004,23:605-611.
[28]Zhang EB,Han L,Yin DD,et al.c-Myc-induced,long,noncoding H19 affects cell proliferation and predicts a poor prognosis in patients with gastric cancer[J].Med Oncol,2014,31:914-921.
[29]Pang Q,Ge J,Shao Y,et al.Increased expression of long intergenic non-coding RNA LINC00152 in gastric cancer and its clinical significance[J].Tumour Biol,2014,35: 5441-5447.
[30]Sun M,Xia R,Jin F,et al.Downregulated long noncoding RNA MEG3 is associated with poor prognosis and promotes cell proliferation in gastric cancer[J].Tumour Biol,2013,35:1065-1073.
[31]Xu TP,Huang MD,Xia R,et al.Decreased expression of the long non-coding RNA FENDRR is associated with poor prognosis in gastric cancer and FENDRR regulates gastric cancer cell metastasis by affecting fibronectin1 expression[J].J Hematol Oncol,2014,7:63.
[32]Sun M,Jin FY,Xia R,et al.Decreased expression of long noncoding RNA GAS5 indicates a poor prognosis and promotes cell proliferation in gastric cancer[J].BMC Cancer,2014,14:319.
[33]Xu C,Shao Y,Xia T,et al.lncRNA-AC130710 targeting by miR-129-5p is upregulated in gastric cancer and associates with poor prognosis[J].Tumour Biology,2014,35: 9701-9706.,
[34]Zhang EB,Kong R,Yin DD,et al.Long noncoding RNA ANRIL indicates a poor prognosis of gastric cancer and promotes rumor growth by epigenetically silencing of miR-99a/ miR449a[J].Oncogarget,2014,5:2276-2292.
[35]Shao Y,Chen H,Jiang X,et al.Low expression of lncRNAHMlincRNA717 in human gastric cancer and its clinical significances[J].Tumour Biol,2014,35:9591-9595.
Q752;R735.2
A
1674-9081(2015)02-0146-04
10.3969/j.issn.1674-9081.2015.02.014
2014-12-03)
杨爱明电话:010-69155778,E-mail:yangaiming@medmail.com.cn
