PPARγ转录阻遏NF—κβ通路抗体外循环肺损伤的影响及作用机制
2015-05-30杨威张小强董啸
杨威 张小强 董啸
【摘要】目的:探讨过氧化物酶体增殖物激活受体-γ(PPARγ)转录阻遏NF-κβ通路抗体外循环肺损伤的影响及其作用机制。方法:建立体外循环肺损伤动物模型并进行分组,对照组大鼠只进行麻醉和CPB 插管,不进行CPB转流;模型组大鼠进行30min 深低温停循环;干预组大鼠经舌下静脉注射0.3mg/kg 过氧化物酶体增殖物激活受体-γ(PPAR-γ)选择性激动剂罗格列酮(ROSI)30min后,进行30min 深低温停循环,以上每组动物10只。应用Western blotting检测三组动物肺组织PPAR-γ和NF-κβp65蛋白的表达;Elisa法检测三组动物血清D-二聚体和热休克蛋白70(HSP70)水平。结果:与对照组比较,模型组动物PPARγ表达有所增加,但两组比较差异无统计学意义(P>0.05),而NF-κβp65表达明显升高(P<0.01);ROSI预处理后,动物PPARγ表达较模型组明显升高,而NF-κβp65表达明显降低(P<0.01)。与对照组比较,模型组动物血清D-二聚体水平明显升高,而HSP70明显降低(P<0.01);ROSI预处理后,动物血清D-二聚体水平明显降低,而HSP70明显升高,比较差异均有统计学意义(P<0.01)。结论:PPARγ转录通过抑制NF-κβ通路对体外循环肺损伤发挥保护作用。
【关键词】过氧化物酶体增殖物激活受体-γ;核转录因子-κβ通路;体外循环;肺损伤
【中图分类号】R285.5 【文献标志码】A 【文章编号】1007-8517(2015)23-0022-02
体外循环心脏手术为外科常用治疗方法,由于手术过程常合并全身炎症反应和缺血再灌注损伤,往往引起肺功能下降,对术后患者疾病康复产生不利影响[1]。目前,关于体外循环肺保护的研究越来越受到关注,相关机制涉及白细胞反应、补体激活、氧自由基过量产生、细胞因子作用等[2]。
过氧化物酶体增殖物激活受体(PPARs)为核激素受体超家族成员。研究表明,PPARγ参与机体多种生理反应调节,尤其对炎性反应发挥了广泛的调节作用,如降低活化氧释放、减少细胞因子以及影响细胞的增殖分化和凋亡[3]。然而,关于PPARY在体外循环(CPB)术后肺损伤过程中如何变化鲜见报道。研究采取常规体循环肺损伤模型,以分析PPARγ在体外循环肺损伤中的作用及其机制,现报道如下。
1 材料与方法
1.1 动物模型与分组 动物为成熟雄性昆明种大鼠,体外循环肺损伤大鼠模型由南昌大学心血管病研究所提供,体重250~300g。根据干预方式不同进行动物分组:对照组,大鼠只进行麻醉和CPB 插管,不进行CPB转流;模型组:大鼠进行30min 深低温停循环;干预组:大鼠经舌下静脉注射0.3mg/kg PPAR-γ选择性激动剂罗格列酮(ROSI)30 min后,进行30min 深低温停循环;以上每组动物10只。
1.2 组织标本采集 大鼠处死后取右肺固定于4%甲醛溶液中,梯度蔗糖溶液脱水,石蜡包埋,切片,片厚为4μm;组织经脱蜡后,进行苏木精和伊红染色,镜下观察组织结构病理变化;取左肺分放于冻存管中,置于-80℃保存,以备下一步实验测定。
1.3 Western blotting检测 取出-80℃保存的左肺组织,提取组织总蛋白,蛋白上样,行SDS-PAGE电泳分离,硝酸纤维素膜转膜,封闭,再进行一抗、二抗处理,室温脱色摇床避光处理1h,洗膜,荧光系统扫描,应用β-actin 作内参,记录每个条带灰度积分值;采取NIH Image图像软件分析各指标平均吸光度值(average absorbance,AA),对样品积分值/内参照积分值比值进行统计学处理;检测包括PPAR-γ、NF-κβp65表达。
1.4 Elisa检测 各组动物于造模后4h 取外周血约5ml,3000r/min 离心10min,储于-80℃ 保存备测,或直接在酶标仪上进行检测,检测指标有D-二聚体和热休克蛋白70(HSP70),试剂盒由北京群晓科苑生物技术有限公司提供。
1.5 统计学处理 数据采用SPSS19.0统计学软件进行分析,计量资料应用均数±标准差(x±s)表示,采用t检验,计数资料用χ2检验,P<0.05表示差异具有统计学意义。
2 结果
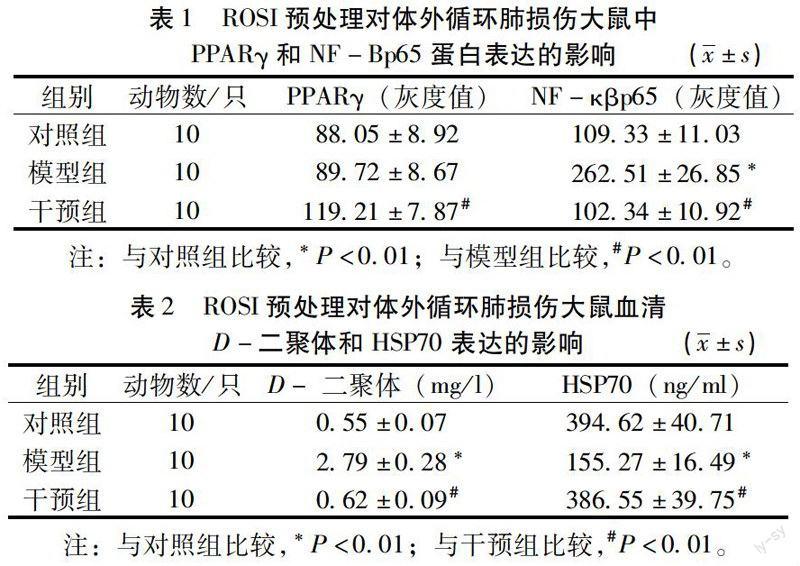
2.1 PPARγ和NF-κβp65蛋白表达比较 由表1可知,与对照组比较,模型组动物PPARγ表达有所增加,但两组比较差异无统计学意义(P>0.05),而NF-κβp65表达明显升高(P<0.01);ROSI预处理后,动物PPARγ表达较模型组明显升高,而NF-κβp65表达明显降低,比较差异均有统计学意义(P<0.01)。
2.2 D-二聚体和HSP70水平比较 由表2可知,与对照组比较,模型组动物血清D-二聚体水平明显升高,而HSP70明显降低(P<0.01);ROSI预处理后,动物血清D-二聚体水平较模型组明显降低,而HSP70明显升高,比较差异均有统计学意义(P<0.01)。
3 讨论
CPB 技术为心脏外科心内直视手术开展的必需条件,故CPB术后必须面对肺功能损伤的并发症,而如何预防和治疗成为当前心外科急需解决的重要难题[4-5]。研究发现,肺缺血再灌注损伤和全身炎症反应是CPB术后肺损伤的主要发生机制,该发现使并发症的预防和治疗得到明显进步[6]。关于CPB术后肺损伤的分子机制的研究有利于新的治疗方案以及防治药物的开发,从而减少CPB术后肺功能损伤的发生。
PPARγ作为依赖配体活化转录因子的一种,也是调节炎症反应的关键点;PPAR-γ可结合于多种核转录因子以及胞质辅助蛋白,通过反式抑制作用,调节炎介质合成和抗炎介质产生,是维持细胞抗炎和促炎过程动态平衡的调节点[7]。PPAR-γ由配体激活后对炎症性疾病引起的炎症反应起抑制作用[8]。研究发现,NF-κβ参与多种炎症反应过程,可释放多炎性介质,是细胞核内炎性介质相关基因转录的启动开关[9]。CPB术后肺功能损伤过程中炎症反应是主要的危害物质,且NF-κβ是多种疾病过程中肺损伤调节的重要因素[10]。因此,PPAR-γ激动剂可能经抗炎途径发挥保护肺损伤的作用。PPAR-γ对NF-κβ抑制作用明显,具体途径多条,如可直接结合NF-κβ亚基p65/p50,形成转录抑制复合物,降低NF-κβ与DNA结合活性,抑制NF-κβDNA合成,从而抑制其表达[11]。研究显示,模型组动物NF-κβp65表达明显升高;而采取PPAR-γ激动剂ROSI预处理后,动物PPARγ表达较模型组明显升高,而NF-κβp65表达明显降低,表明PPAR-γ被活化后,可能通过抑制NF-κβ途径发挥对CPB术后肺损伤的保护作用。
研究证实,HSP70参与了PPAR-γ配体激活、对肺损伤有保护作用,且HSP70 的抗炎作用与其减少炎症介质产生、增强抗炎细胞因子水平、尤其是抑制NF-κB 活性密切相关[12]。D-二聚体作为交联纤维蛋白的最终降解产物,是凝血与纤溶功能的重要分子标志物。研究发现,多种疾病引起的肺损伤过程中,D-二聚体呈现高水平状体,且D-二聚体与肺功能呈负相关[13]。研究结果显示,模型组动物较对照组血清D- 二聚体水平明显升高,而HSP70明显降低;ROSI预处理后,动物血清D- 二聚体水平明显降低,而HSP70明显升高(P<0.01)。证实了PPAR-γ激动剂ROSI预处理可引起机体D-二聚体水平降低[14]。
综上所述,PPARγ转录在CPB术后体外循环肺损伤中起到保护作用,其阻遏NF-κβ通路以及通过影响血清D-二聚体和HSP70水平可能在其中发挥了重要作用,值得进一步探究。
参考文献
[1] Cheng C,Li S,Wang Y,Chen S,et al.Ischemic postconditioning alleviates lung injury and maintains a better expression of aquaporin-1 during cardiopulmonary bypass[J].Chinese Medical Journal,2014,127(23):4012-4018.
[2] Apostolakis EE,Koletsis EN,Baikoussis NG,et al.Strategies to prevent intraoperative lung injury during cardiopulmonary bypass[J].J Cardiothorac Surg,2010,11,5:1.
[3] 何斌综,何庆.PPARγ及配体在肺损伤中的作用[J].西部医学,2007,19(5):956-958.
[4] Kohira S,Oka N,Inoue N,et al.Effect of the neutrophil elastase inhibitor sivelestat on perioperative inflammatory response after pediatric heart surgery with cardiopulmonary bypass: a prospective randomized study[J].Artif Organs,2013,37(12):1027-1033.
[5] Yamazaki S,Inamori S,Nakatani T,et al.Activated protein C attenuates cardiopulmonary bypass-induced acute lung injury through the regulation of neutrophil activation[J].J Thorac Cardiovasc Surg,2011,141(5):1246-1252.
[6] 曾源,杨威,张小强,等.前B细胞克隆增强因子在体外循环术后肺血管内皮通透性增加中的机制研究[J].重庆医学,2013,42(28):3388-3392.
[7] Wu Y,Wu Q,Zhang H,et al.Lack of genetic associations between PPAR-γ gene rs1801282 polymorphism and Alzheimer's disease in general population: a meta-analysis[J].Gene,2015,563(2):120-124.
[8] Cuzzocrea S,Pisano B,Dugo L,et al. Rosiglitazone,a ligand of the peroxisome proliferator-activated receptor-gamma,reduces acute inflammation[J].Eur J Pharmacol,2004,483(1):79-93.
[9] Lee JI,Burckart GJ.Nuclear factor kappa B:important transcription factor and therapeutic target[J].J Clin Pharmacol,1998,38(11):981-993.
[10] Carpenter TC,Schroeder W,Stenmark KR,et al.Eph-A2 promotes permeability and inflammatory responses to bleomycin-induced lung injury[J].Am J Respir Cell Mol Biol,2012,46(1):40-47.
[11] Aranda A,Pascual A.Nuclear hormone receptors and gene expression[J].Physiol Rev,2001,81(3):1269-1304.
[12] Vreugdenhil HA,Haitsma JJ,Jansen KJ,et al.Ventilator-induced heat shock protein 70 and cytokine mRNA expression in a model of lipopolysaccharide-induced lung inflammation[J].Intensive Care Med,2003,29(6):915-922.
[13] 孙博,刘楠,邢晓燕,等.急性Stanford A 型主动脉夹层围术期急性肺损伤与D-二聚体相关性的探讨[J].心肺血管病杂志,2013,32-(1):26-29.
[14] 孙艺铸,王静,于鲁欣,等.过氧化物酶体增殖物激活受体-/核转录因子-B转导通路在脓毒症所致凝血功能障碍中的作用[J].中华危重病急救医学,2015 ,27(6):520-524.
(收稿日期:2015.08.31)
