正交试验法探讨氢氧化亚铁制备的最佳实验条件
2015-05-30贝伟浩
贝伟浩

[摘 要]以硫酸亚铁溶液的配制方法、硫酸亚铁溶液的浓度、氢氧化钠溶液的浓度为因素采用单指标的正交试验法来探讨氢氧化亚铁的最佳制备条件。实验表明,仅硫酸亚铁溶液的配制方法对氢氧化亚铁沉淀白色持续时间长短有显著影响。
[关键词]正交试验 氢氧化亚铁 制备 最佳实验条件
[中图分类号] G633.8 [文献标识码] A [文章编号] 16746058(2015)080102
氢氧化亚铁的制备实验是中学化学的一个重要演示实验。由于氢氧化亚铁难溶于水,所以一般用可溶性的亚铁盐溶液和强碱溶液相互作用来制取。但由于Fe2+具有还原性,尤其在碱性环境中还原性更强,因而在空气中制取所得到的氢氧化亚铁沉淀迅速被氧化,很难看到白色絮状沉淀的生成。各种参考资料关于该实验的改进常有报道,但仪器复杂或现象不尽如人意。在此,我试图采用单指标的正交试验法来探讨其最佳制备条件,以期达到较好的效果。
一、实验指标的确定
本实验选定氢氧化亚铁沉淀白色持续时间为指标评价实验结果的优劣。氢氧化亚铁沉淀白色持续时间用秒表记录,记录时间以秒(s)为单位,白色持续时间越长则实验效果越好。
二、因素、水平的确定
一般来说,制取氢氧化亚铁沉淀都选择硫酸亚铁溶液和氢氧化钠溶液反应,其影响因素是:硫酸亚铁溶液的浓度及其配制方法、氢氧化钠溶液的浓度及其配制方法、是否隔绝溶液与空气的接触、反应温度、药品的纯度及是否变质、反应操作等。选择恰当的因素和水平有利于最佳实验条件的获取。为此,需要通过实验初步确定各因素水平的大致范围。
1.反应温度的选择
为了确定不同温度条件下对制取氢氧化亚铁沉淀的可能影响,在此选择25℃、40℃、60℃三个温度点进行实验。硫酸亚铁溶液浓度选择5%,氢氧化钠溶液浓度选择15%,采用液态石蜡液封。其实验结果如表1所示。
实验结果表明,三个不同温度条件下氢氧化亚铁沉淀白色持续时间相差不大。因此本实验选择常温下(25℃)进行制取氢氧化亚铁沉淀的研究。
2.硫酸亚铁溶液浓度及配制方法的选择
(1)硫酸亚铁溶液浓度的选择
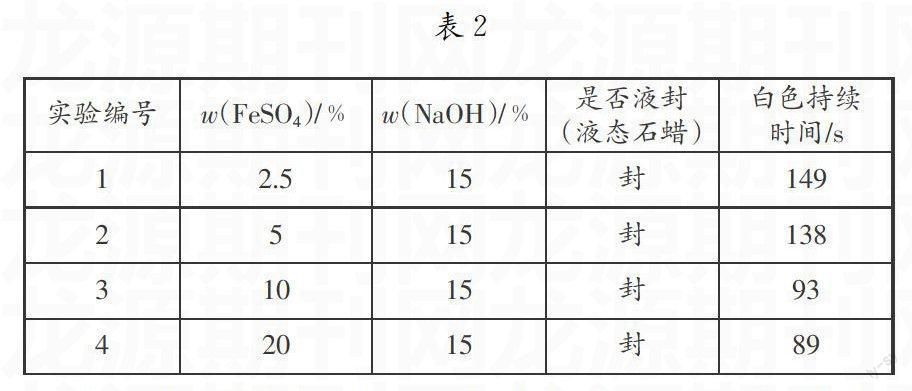
在25℃下,硫酸亚铁溶液浓度为2.5%、5%、10%、20%,氢氧化钠溶液浓度为15%,采用液态石蜡液封做初步实验。
其实验结果如表2所示。
实验结果表明:硫酸亚铁溶液浓度在10%和20%时,氢氧化亚铁沉淀白色持续时间相差不大,因此选择硫酸亚铁溶液浓度在2.5%、5%、10%下进行研究。
(2)硫酸亚铁溶液的配制方法
硫酸亚铁溶液的配制方法也是本实验的关键。在本实验中均采用新制的硫酸亚铁溶液与氢氧化钠溶液反应,为了确定不同的硫酸亚铁溶液配制方法对实验效果的影响,把硫酸亚铁溶液配制方法作为一个因素来研究。在实验中采用三种方法配制硫酸亚铁溶液。
配制方法1:在试管里盛蒸馏水5毫升,煮沸以去除其中溶解的氧气。加入1~2滴20%H2SO4进行酸化,再加入称量好的洗净的硫酸亚铁绿色晶体(先把外层黄色物质的三价铁的碱式盐刮掉,再用少量不含氧蒸馏水冲洗1~2次),但不要摇动,以防混入空气。为了加速溶解,微微加热。加入光亮的铁丝一小团。随后在溶液上面加2~3cm液体石蜡。
配制方法2:在试管里盛蒸馏水5毫升,煮沸以去除其中溶解的氧气,再加入称量好的洗净的硫酸亚铁绿色晶体。微微加热并摇动。随后在溶液上面加2~3cm液体石蜡。
配制方法3:在试管里盛蒸馏水5毫升,加入称量好的洗净的硫酸亚铁绿色晶体,微微加热并摇动。随后在溶液上面加2~3cm液体石蜡。
3.氢氧化钠溶液的浓度及配制
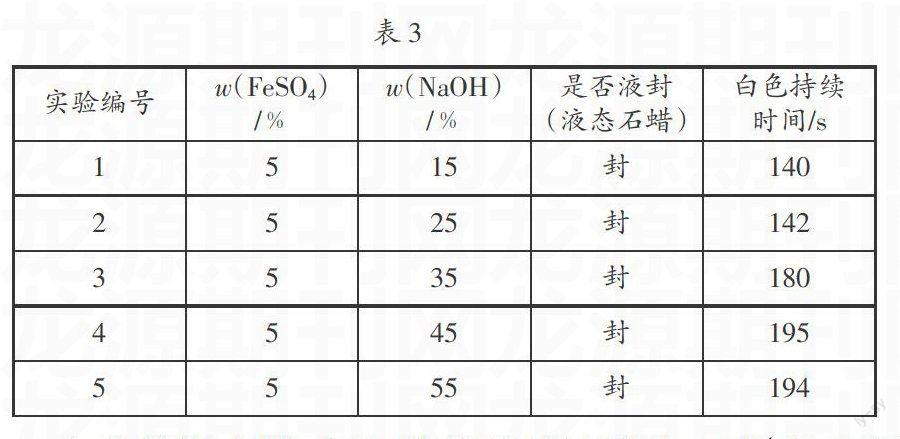
在25℃下,氢氧化钠溶液浓度为10%、25%、35%、45%、55%,硫酸亚铁溶液浓度为5%,采用液态石蜡液封作初步实验。
其实验结果如表3所示。
实验结果表明:氢氧化钠溶液浓度在15%和25%时,氢氧化亚铁沉淀白色持续时间相差不大;氢氧化钠溶液浓度在45%和55%时,氢氧化亚铁沉淀白色持续时间相差不大,因此选择氢氧化钠溶液浓度25%、35%、45%三水平作研究。
根据以上初步实验,本实验选定在25℃,有液封的条件下实验,其他因素、水平如表4所示。
三、实验原理及步骤
药品:铁丝、蒸馏水、硫酸(20%)、硫酸亚铁晶体、氢氧化钠、液体石蜡。
仪器:小试管、长滴管、药匙、天平、烧杯、玻璃棒、秒表。
实验选用分析纯试剂。
1.实验原理
使用硫酸亚铁晶体制备硫酸亚铁溶液,用液体石蜡封住硫酸亚铁溶液,以隔绝溶液与空气的接触。把吸有氢氧化钠溶液的长滴管插入硫酸亚铁溶液下层,滴加氢氧化钠溶液,发生反应:
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
2.制取步骤
(1)配制溶液
配制硫酸亚铁溶液:按照上述配制方法1、配制方法2和配制方法3分别配制硫酸亚铁溶液。
配制氢氧化钠溶液:用天平称取一定量的氢氧化钠固体,加到盛有蒸馏水的烧杯中,加热以加速氢氧化钠溶解并驱赶溶液中的氧气。
(2)制取氢氧化亚铁沉淀
①在试管中加入配制好的硫酸亚铁溶液,置于试管架上,用液体石蜡封住硫酸亚铁溶液。
②取长滴管迅速直接将已经煮沸处理的NaOH溶液伸入硫酸亚铁溶液下层滴加氢氧化钠溶液。
③观察试管中现象,用秒表记录白色持续出现时间。
四、实验方案的设计及其结果的直观分析和方差分析
本实验为三因素三水平的实验,选用L934正交表。
说明:F0.01(2,2)=99.000;F0.05(2,2)=19.000 。
五、实验结果与讨论
从上述直观分析的数据可见,在所选定的因素水平范围内,各因素对实验指标影响的主次关系为:
最佳实验配比为A2B1C3,即硫酸亚铁溶液浓度5%,硫酸亚铁溶液配制方法1,氢氧化钠溶液浓度45%。方差分析结果表明,仅硫酸亚铁溶液配制方法的改变对实验指标有显著影响。
验证性实验表明,该条件下(A2B1C3)氢氧化亚铁沉淀白色持续时间最长。
本实验表明,硫酸亚铁溶液的配制方法对氢氧化亚铁沉淀白色持续时间长短有显著影响。为了获得更长的氢氧化亚铁沉淀白色持续时间,关键的环节是硫酸亚铁溶液的配制。按照配制方法1可以有效减少硫酸亚铁溶液中氧气的含量,同时为了减少溶液中高铁离子Fe3+存在的机会,既除去高铁离子Fe3+,又不引入新的杂质,一般选用铁丝来还原高铁离子Fe3+。铁丝的存在可有效阻止二价铁被氧化。酸化用硫酸不能滴太多,否则会消耗氢氧化钠;也不能太稀,1∶5为宜,否则氢气的产生会太慢,不便于空气的排出。
(责任编辑 罗 艳)
