烟熏液对卤煮牛肉中12种多环芳烃含量的影响
2015-05-30杨潇蔡克周胡斌陈炎刘亚茜孟俊祥姜绍通陈从贵
杨潇 蔡克周 胡斌 陈炎 刘亚茜 孟俊祥 姜绍通 陈从贵
(1.合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009;
2.安徽宝迪肉类食品有限公司,安徽 淮北 235000
3.安徽国家粮食质量监测中心,安徽省粮油产品质量检测站,安徽 合肥 230031)
摘 要:采用固相微萃取-高效液相色谱(荧光检测器)检测法,研究添加不同质量分数烟熏液(0.05%~1.0%)对卤煮牛肉中12种多环芳烃含量的影响。结果表明:12 种多环芳烃中10 种在卤煮牛肉中被检测出,总量为355.76 ng/g,
其中萘(naphthalene,NA)含量最多,达到302.14 ng/g。添加烟熏液后,多环芳烃的总量显著降低(P<0.01),并随着烟熏液质量分数的增加,总量呈现明显降低趋势。在添加烟熏液质量分数为1%时,多环芳烃的总量由对照组355.76 ng/g降低到12.17 ng/g,其中苊(acenaphthene,AC)、苯并[k]荧蒽(benzo(k)fluoranthene,BkFA)和
苯并[a]芘(benzo(a)pyrene,BaP)甚至检测不到。因此,烟熏液对卤煮牛肉中多环芳烃的形成具有良好的抑制作用,这种作用可能与其抗氧化性有关。
关键词:烟熏液;高效液相色谱法;多环芳烃;抗氧化性
Effect of Liquid Smoke on the Contents of Twelve Polycyclic Aromatic Hydrocarbons in Stewed Beef
YANG Xiao1, CAI Kezhoul,*, HU Bing3, CHEN Yan1, LIU Yaxi1, MENG Junxiang2, JIANG Shaotong1, CHEN Conggui1
(1. Key Laboratory for Agricultural Products Processing of Anhui Province, College of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China; 2. Anhui Baodi Meat Food Co. Ltd., Huaibei 235000, China; 3. China National Supervision and Examination Center For Foodstuff Quality, Anhui Grain & Oil Quality Inspection Station, Hefei 230031, China)
Abstract: In this study, solid-phase microextraction and high performance liquid chromatography with fluorescence detector were adopted to investigate the influence of addition of different proportions of liquid smoke (0.05%–1.0%) on the contents of 12 polycyclic aromatic hydrocarbons (PAHs) in stewed beef. The results showed that 10 of the 12 polycyclic aromatic hydrocarbons investigated were detected from spiced boiled beef with a total amount of 355.76 ng/g and naphthalene (NA) was the most abundant (302.14 ng/g) among these compounds. The addition of smoke fluid resulted in a significant reduction in the total amount of PAHs (P < 0.01) in a concentration-dependent manner. The total amount of PAHs 355.76 ng/g in the control group was decreased to12.17 ng/g by adding 1% of liquid smoke, simultaneously leading to undetectable levels of acenaphthene, benzo(k)fluoranthene and benzo(a)pyrene. Overall, smoke fluid showed a good inhibitory effect on polycyclic aromatic hydrocarbons in spiced boiled beef, and this effect may be related to its oxidation resistance.
Key words: smoke fluid; high performance liquid chromatography; polycyclic aromatic hydrocarbons; oxidation resistance
中图分类号:TS251.61 文献标志码:A 文章编号:1001-8123(2015)07-0006-05
doi: 10.7506/rlyj1001-8123-201507002
癌症的发病率和人们的生活方式和饮食习惯密切相关,有研究[1]表明30%的恶性疾病都是人们的生活习惯造成的,对这些饮食习惯做部分改变则可能极大地减少恶性疾病的患病率。频繁食用高温下烹制而成的猪肉、牛肉、羊肉等肉制品被广泛认为是增加癌症患病率的主要因素之一[2-3]。
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是肉制品在高温烹制下产生的一种芳香族物质或者其衍生物,这类物质含有2个或者2个以上苯环结构[4]。多环芳烃在自然界中普遍存在,有机物质的不完全燃烧以及其热解反应也会产生,在肉制品的烹饪制作过程中会产生大量的氨基酸、肌酸、肌酐以及葡萄糖等小分子物质,这些小分子物质是多环芳烃形成的前体物质,在烹饪的高温条件下聚合反应生成多环芳烃,烹饪高温下大分子的蛋白质等物质也会分解产生多环芳烃[5-7]。
多环芳烃是一类典型的具有持久性的有毒物质[8-10],且具有致畸、致癌、致突变特性[11],16种PAHs被欧盟食品科学委员会列为优先控制污染物,其中7种亦被中国环保总局作为优先控制污染物加入黑名单中。苯并[a]芘是多环芳烃中最具有代表性的物质,它具有强致癌性,是一种由5个苯环构成的稠环芳香烃,其在常温下呈现为浅黄色晶体,水溶性差,具有良好的脂溶性。1933年科学家们就揭示了苯并[a]芘的分子结构,是公认的强致癌物质,微量的苯并[a]芘就可能引起局部的癌变[12-13]。动物实验[14]表明苯并[a]芘能够导致肝细胞、肺细胞以及外周淋巴细胞DNA的损伤。
有研究[15-16]表明在肉类烹饪高温条件下加入一些抗氧化物质可以起到抑制多环芳烃生成的效果,该研究探求洋葱和大蒜对肉饼中6 种多环芳烃含量的影响,结果表明,对照组中6 种多环芳烃的总量为2.0~7.2 ng/g,加入大蒜后多环芳烃的总量下降为0.05~0.6 ng/g,抑制效果显著(P<0.05)。这可能是由于抗氧化性物质在肉类烹饪的过程中抑制了蛋白质、脂肪等大分子物质分解产生自由基,减少了形成多环芳烃的前体物质的生成,从而最终表现为多环芳烃的生成量被抑制。
本实验通过福林酚法测定烟熏液中的总酚含量,然后以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)自由基清除率和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS)清除率测定其抗氧化能力。实验在牛肉卤煮过程中通过添加不同质量分数的烟熏液,以探求不同质量分数的烟熏液对于卤煮牛肉中多环芳烃含量的影响。
1 材料与方法
1.1 材料与试剂
新鲜牛后腿肉、精制食盐、精制白砂糖、海天老抽酱油均购自附近家乐福超市;山楂核烟熏香味液Ⅰ号 济南华鲁食品有限公司。
多环芳烃标准品:萘(naphthalene,NAP)、苊(acenaphthene,Ac)、芴(fluorene,FLU)、荧蒽(fluoranthene,FLT)、苯并[a]蒽(benzo(a)anthracene,BaA)、?(chrysene,CHR)、
苯并[b]荧蒽(benzo(b)fluoranthene,BbFA)、
苯并[k]荧蒽(benzo(k)fluoranthene,BkFA)、
苯并[a]芘(benzo(a)pyrene,BaP)、二苯并[a,h]蒽
(dibenzo(a,h)anthracene,DBahA)、苯并[g,h,i]苝
(benzo(g,h,i)perylene,BPE)、茚酚[1,2,3-cd]芘(indeno(1,2,3-cd)pyrene,IPY) 西格玛奥德里奇(上海)贸易有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、甲醇、二氯甲烷、乙腈、环己烷均为色谱纯;氢氧化钾、硫酸、
高硫酸钾、没食子酸均为分析纯。
1.2 仪器与设备
Agilent1100高效液相色谱仪、自动进样器、G1312荧光检测器、Florisil固相萃取柱(500 mg/3 mL)、
Eclipse PAH色谱柱 美国Agilent公司;紫外-可见光分光光度计 北京普析通用仪器有限责任公司;分析天平 深圳市怡华新电子有限公司;CR15RT型台式高速冷冻离心机 上海天美生化仪器设备工程有限公司;电动绞
肉机 石家庄晓进机械制造科技有限公司;SHZ-D(Ⅲ)循环水式真空泵 巩义市予光仪器有限责任公司;
G3 Heidolph 2旋转蒸发仪、固体微萃取装置 郑州宝晶科技有限责任公司;氮吹仪 杭州瑞诚仪器有限责任
公司。
1.3 方法
1.3.1 牛肉的卤煮处理
牛肉的前处理[17]:将新鲜牛后腿肉中可见的脂肪和筋膜去除,然后用直径5 mm的绞肉机将牛肉制成肉条。将处理好的牛肉放于温水中漂洗,然后放于锅中,加水煮沸,弃除悬浮泡沫和杂物,3 min后取出牛肉。
牛肉的卤制:向烧杯中加入1 g白砂糖、1 g盐、5 mL酱油以及150 mL蒸馏水,加热搅拌,使盐和白砂糖完全溶解,向其中加入烟熏液使其质量分数分别为0、0.05%、0.1%和1%,然后将50 g牛肉做成饼状,放于其中,卤煮2h,卤煮过程中始终保持卤液微沸。
1.3.2 DPPH自由基清除率的测定
根据Stjepan等[18]的方法做部分修改,依次配制质量浓度为0.05、0.1、0.2、0.4、0.5 mg/mL的烟熏液。取4 mL样品,加入4mL DPPH溶液充分混合,避光放置30 min,515 nm波长处测定吸光度A。取4 mL蒸馏水,加入4 mL DPPH溶液充分混合,避光放置30 min,515 nm波长处测定吸光度A0。重复3 次。根据公式(1)计算DPPH自由基清除率。
(1)
1.3.3 ABTS+·清除率的测定
根据Awika等[19]的方法,适当调整烟熏液质量浓度,使得测得A734 nm值在0.1~1.0之间。
用蒸馏水分别配制14 mmol/L ABTS溶液和4.9 mmol/L
高硫酸钾溶液,分别将上述两种溶液按照1∶1(V/V)比例混合过夜,临用前用乙醇将混合液稀释至吸光度A734 nm为0.70±0.02,此为ABTS试剂。向2.5 mL ABTS试剂中加入0.5 mL质量浓度为0.3、0.5、0.7、1.0 mg/mL的烟熏液稀释液,室温放置10 min,在734 nm波长处测定吸光度A2。同时测定2.5 mL ABTS与0.5 mL乙醇混合液的吸光度A1,根据公式(2)计算ABTS+·清除率。
(2)
1.3.4 烟熏液总酚含量的检测
烟熏液所呈现出来抗氧化性的大小是由烟熏液中总酚的含量决定的。测定方法参考黄莹像等[20]和GB/T 8313—
2008《茶叶中茶多酚和儿茶素类含量的检测方法 》。称取0.100 g没食子酸于100 mL容量瓶中,定容至刻度,摇匀,此为没食子酸标准储备溶液(1 000 μg/mL),应现配。用移液管分别移取0.1、0.2、0.3、0.4、0.5 mL的没食子酸标准储备液于100 mL容量瓶中,分别用蒸馏水定容至刻度,摇匀,质量浓度分别为10、20、30、40、50 μg/mL,此为没食子酸工作液。分别取1 mL待测液、没食子酸工作液于10 mL离心管中,再加入5 mL福林试剂(根据GB/T 8313—2008配制),摇匀,3 min后加入7.5%碳酸钠溶液4 mL,振荡,静置1 h后,765 nm波长处比色测定,以1 mL蒸馏水代替待测液作为空白。
将烟熏液稀释一定的倍数,按照标准曲线制作的方法对其进行处理,使吸光值在标准曲线中合适的范围内,根据标准曲线计算烟熏液中的总酚含量。
1.3.5 多环芳烃的提取[15,21]
样品提取:称取待测牛肉5.0 g于50 mL离心管中,加入10 mL甲醇和10 mL质量分数50%的KOH溶液。用高速剪切均质机将牛肉处理成均匀的溶液状,均质后向离心管中加入15 mL甲醇,将其超声提取30 min,然后在高速离心机中(6 000 r/min、4 ℃)离心5 min。取上清液于150 mL分液漏斗中,沉淀物用10 mL环己烷振摇混合,离心(6 000 r/min、4 ℃,5 min)后将上清液合并于150 mL分液漏斗中,沉淀物重复上述操作1 次,合并上清液。将合并后的上清液充分振摇1 min,静置5 min,弃除下层液体,上层液体为环己烷相。依次用10 mL 50%甲醇-水(1∶1,V/V)溶液、5 mL水和lmL 60%硫酸溶液,重复振摇(1 min)、静置分层(5 min),弃去下层液体操作,用蒸馏水对环己烷相进行清洗,直至环己烷相表现为中性。将清洗后的环己烷相通过无水硫酸钠,脱去其中的水分后转移到150 mL旋转蒸馏瓶中,对环己烷相旋转蒸发(40 ℃、30 r/min、152 mbar),蒸发至1~2 mL时取下样液。
样品纯化:先后用3 mL二氯甲烷和5 mL环己烷对Florisil(FL)固相萃取柱进行活化。将浓缩后的样液(1~2 mL)洗入固相萃取柱中,用少量环己烷洗涤旋蒸瓶并将洗涤液通过FL固相萃取柱中,然后用3 mL环已烷洗入柱子中;用9 mL的环己烷-二氯甲烷(3∶1,V/V)混合液洗脱FL固相萃取柱,用旋转蒸发仪(45 ℃、30 r/min、
152 mbar)浓缩洗脱液,浓缩至1~2 mL,将浓缩液转移到10 mL离心管中,氮吹仪中氮气吹干后准确加入2 mL乙腈,超声溶解后,用0.22 μL微孔滤膜过滤至HPLC进样瓶中,待测。
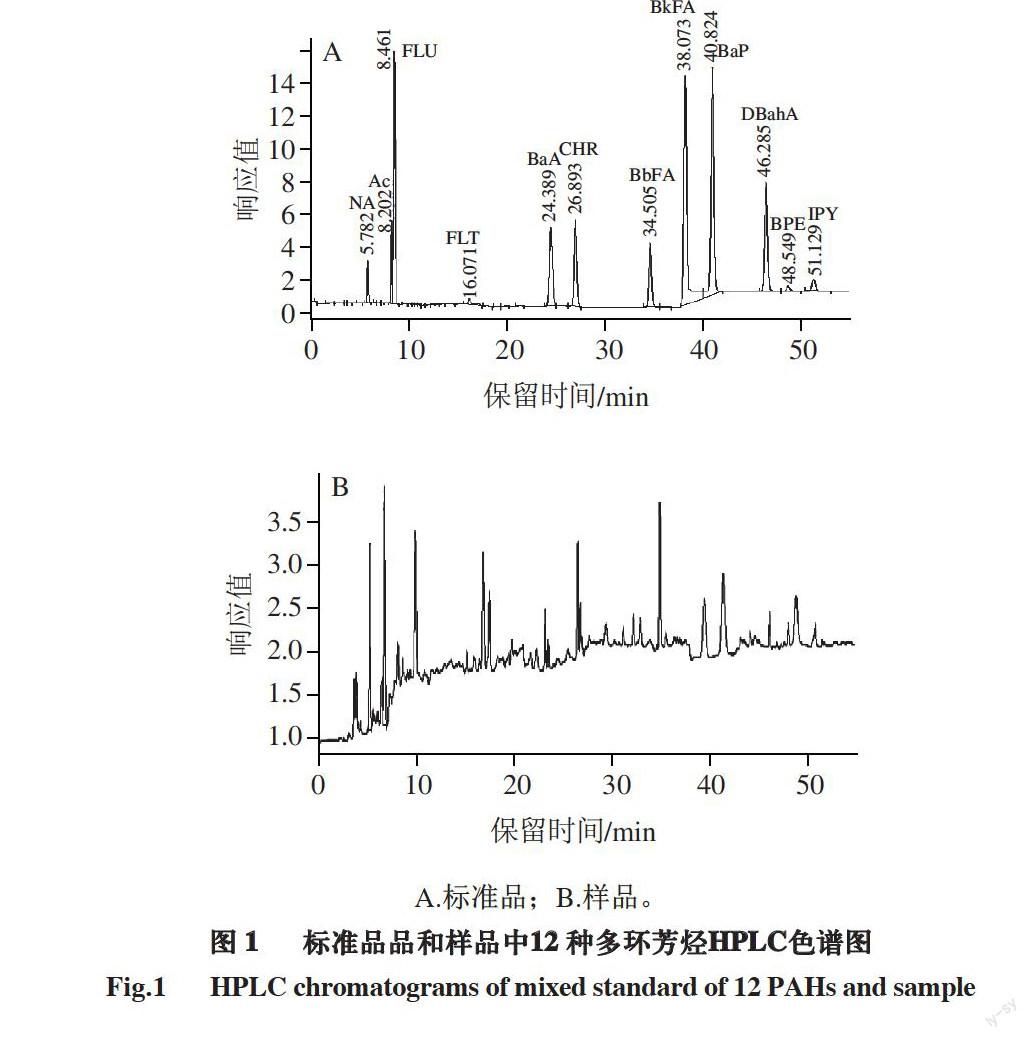
1.3.6 多环芳烃的检测分析
多环芳烃在肉制品中的含量极少,在通过上述前处理方法浓缩提取后经过串联有荧光检测器的高效液相色谱仪能够检测出来[22]。
色谱条件:色谱柱为Eclipse PAH (250 mm×4.6 mm,
5.0 μm);进样量:20 μL;柱温:35 ℃;流速:
1 mL/min;实验中采用双流动相:流动相A:乙腈,流动相B:水。
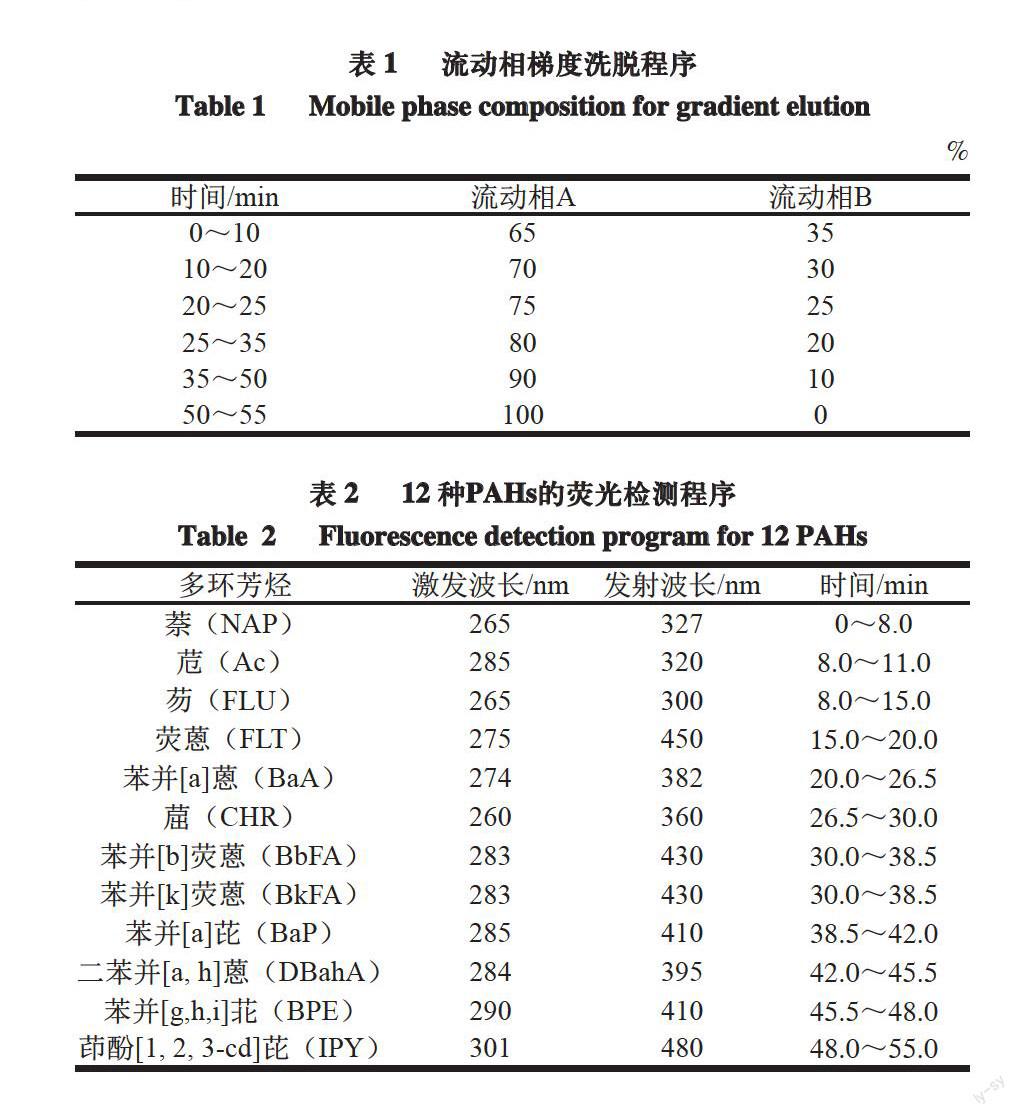
表 1 流动相梯度洗脱程序
1.4 数据分析
实验数据采用OriginPro 7.0进行统计分析,以平均
值±标准差表示,显著性检验采用Student,t检验方法,
P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 12种多环芳烃的HPLC色谱及其标准品检测曲线
取12 种多环芳烃混合标准液(1 μg/mL),依次梯度稀释成1、5、10、50、100 ng/mL标准液,通过高效液相色谱(high performance liquid chromatography,HPLC)检测,建立标准曲线。
A.标准品;B.样品。
图 1 标准品品和样品中12 种多环芳烃HPLC色谱图
Fig.1 HPLC chromatograms of mixed standard of 12 PAHs and sample
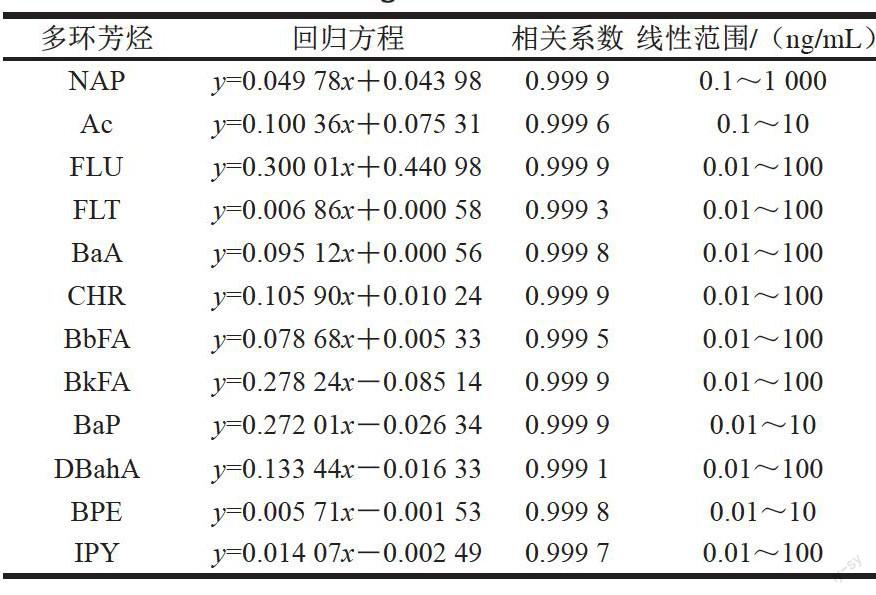
2.2 12 种多环芳烃的标准曲线
表 3 12 种多环芳烃标准品的线性关系、相关系数及线性范围
2.3 烟熏液中总酚含量的测定
以根据没食子酸标准溶液的质量浓度为横坐标
(mg/mL),以吸光度为纵坐标,检测绘出线性回归方程:y=0.011 8x+0.027 9,相关系数为0.992 1。实验中将烟熏液稀释500 倍测其吸光度(3 次平行),结果求平均数代入线性回归方程,得出烟熏液中的总酚含量为21.53 mg/mL。
2.4 烟熏液的DPPH自由基清除率
由图2可知,随着烟熏液质量浓度的不断增大,DPPH自由基清除率也在不断提高,当烟熏液质量浓度为0.05 mg/mL时,DPPH自由基清除率为10.3%,当烟熏液的质量浓度0.5 mg/mL时,DPPH自由基清除率达到了80.5%,清除率提高了8 倍,从总体趋势看,烟熏液质量浓度在0~0.1 mg/mL之间,增加烟熏液质量浓度,DPPH自由基清除率增速较快,当烟熏液的质量浓度超过0.1 mg/mL后,DPPH自由基清除率的增速有所减缓,这一趋势在烟熏液质量浓度为0.2~0.5 mg/mL之间更加明显。可以预见,继续增大烟熏液质量浓度,DPPH自由基清除率仍会有所增加,但增速进一步下降,直至增速趋于0,清除率趋于平衡。
图 2 DPPH自由基清除率随烟熏液不同质量浓度变化趋势
Fig.2 DPPH radical scavenging activity of liquid smoke as a function of concentration
2.5 烟熏液的ABTS+·清除率
图 3 ABTS+·清除率随烟熏液不同质量浓度变化趋势
Fig.3 ABTS+· scavenging activity of liquid smoke as a function of concentration
由图3可知,随着烟熏液质量浓度的不断增加,ABTS+·清除率也在不断的增加,这点和DPPH自由基清除率是一致的。但不同的是,ABTS+·清除率在烟熏液质量浓度为0.3~0.5 mg/mL之间有个短暂的平衡状态。在0~0.3 mg/mL之间,ABTS+·清除率随烟熏液质量浓度的增加增长较快,在0.3 mg/mL时达到49.70%,但在0.5 mg/mL时,ABTS+·清除率也仅为53.40%,增速很慢,几乎趋于平衡。烟熏液质量浓度为0.5~1.0 mg/mL
之间时,ABTS+·清除率又呈现快速增长状态,在
1.0 mg/mL达到75.57%,但这段区间上的增速明显低于0~0.3 mg/mL区间上的增速。
2.6 不同质量烟熏液对卤煮牛肉中多环芳烃含量的影响
表 4 不同质量浓度烟熏液对卤煮牛肉中多环芳烃含量的影响
由表4可知,空白对照组中检测出10 种多环芳烃,总量达到355.76 ng/g,只有FLU和BPE未检测出,其中NA的含量最多,达到302.14ng/g,FLT、BaA和DBahA的含量都超过了10 ng/g,分别为12.18、10.18、15.06 ng/g,BkFA和BbFA这两种多环芳烃含量较少,都低于1 ng/g,另外多环芳烃中典型物质BaP的含量为2.11 ng/g,低于国家标准5.0 ng/g。
加入烟熏液后,都出现了多环芳烃被抑制的效果,空白对照组中NA的含量达到了302.14 ng/g,加入质量分数0.05%烟熏液后,NA的含量下降到13.48 ng/g,继续增加烟熏液的质量分数,当质量分数达到1.0%时,NA的含量下降到3.19 ng/g,抑制效率达到了99%,抑制效果显著。烟熏液对于FLU、CHR、BkFA、BaP和DbahA这5 种多环芳烃的抑制效果是相似的,低质量分数烟熏液的加入就能对牛肉中这几种多环芳烃起到抑制效果,随着烟熏液质量分数的不断增加,抑制效果越来越强,当加入的质量分数达到1%时,FLU、BkFA和BaP的含量都降为0。
Ac、FLT、BbFA和IPY对烟熏液比较敏感,0.05%烟熏液的加入就将其含量抑制到0,继续增加烟熏液的质量分数,Ac始终未被检测到,但FLT、BbFA和IPY却被检测出来,说明低质量分数的烟熏液对于牛肉中FLT、BbFA和IPY的抑制效果更好。
3 结 论
烟熏液中含有各种酚类,总量达到21.53 mg/mL,这使得烟熏液具有良好的抗氧化能力,对DPPH自由基和ABTS+·具有良好的清除效果。空白对照组中检测出
10 种多环芳烃,总量达到355.76 ng/g,烟熏液的加入能够显著(P<0.05)抑制卤煮牛肉中多环芳烃的生成,随着烟熏液质量分数的增加,抑制效果也更加明显,加入质量分数为1%的烟熏液时,卤煮牛肉中多环芳烃的总量为12.17 ng/g,抑制效率达到96.6%。不同质量分数烟熏液对同类多环芳烃的抑制效果是不一样的,相同质量烟熏液对于不同类多环芳烃的抑制效果也有差异。其中烟熏液对多环芳烃的典型物质BaP的抑制效果显著,加入质量分数为1%的烟熏液时,BaP未被检测到。
参考文献:
[1] BLASZCZYK U, JANOSZKA B. Analysis of arenes in pan fried meat and its gravy by liquid chromatography with fluorescence detection[J]. Food Chemistry, 2008, 109(1): 235-242.
[2] BIANCHINI F, VAINIO H. Allium vegetables and organosulfur compounds: do they help prevent cancer[J]. Environmental Health Perspectives, 2001, 109(9): 893-902.
[3] MARIA D, PATRICIA S, MARIA A.Determination of polycyclic aromatic hydrocarbons in commercial liquid smoke flavorings of different compositions by gas chromatography-mas spectrometry[J].Journal of Agricultural and Food Chemistry, 2000, 48: 126-131.
[4] STOLYHWO A, ZDZISLAW E S. Polycyclic aromatic hydrocarbons in smoked fish: a critical review[J]. Food Chemistry, 2005, 91: 303-311.
[5] JASNA D, ALEKSANDAR P, WOLFGANG J. Polycyclic aromatic hydrocarbons (PAHs) in different types of smoked meat products from Serbia[J]. Meat Science, 2008, 80: 449-456.
[6] DIANA M, ANPING D, REINHARD N, et al. Development of a highly sensitive monoclonal antibody based ELISA for detection of benzo[a]pyrene in potable water[J]. Analyst, 2005, 130: 1078-1086.
[7] CHEN Binghuai, CHEN Yingchang. Formation of polycyclic aromatic hydrocarbons in the smoke from heated model lipids and food lipids[J]. Journal of Agricultural and Food Chemistry, 2001, 49(11): 5238-5243.
[8] 冯承莲, 夏星辉, 周迫, 等. 长江武汉段水体中多环芳烃的分布及来源分析[J]. 环境科学学报, 2007, 27(11): 1900-1908.
[9] 钱薇, 倪进治, 骆永明, 等. 高效液相色谱-荧光检测法测定土壤中的多环芳烃[J]. 色谱, 2007, 25(2): 221-225.
[10] 丁潇, 向志鹏, 韩斌, 等. 鞍山市大气PMIO中多环芳烃(PAHs)的污染特征及其来源[J]. 环境科学研究, 201l, 24(2): 162-171.
[11] BOLS N C, BRUBACHER J L, GANASSIN R C, el a1. Ecotoxicology and innate immunity in fish[J]. Des GompImmunol, 2001, 25(8): 853-873.
[12] PETER S. Determination of polycyclic aromatic hydrocarbons in smoked meet products and smoke flavouring food additives[J]. Journal of Chromatography B, 2002, 770: 3-18.
[13] 段小丽, 魏复盛. 世界科技研究与发展[J]. 院士论坛, 2003, 24(1): 11-17.
[14] LI D, FIROZI P F, WANG L E, et a1. Sensitivity to DNA damage induced by benzo (α) pyrene diol epoxide and risk of lung cancer[J]. Cancer Research, 2001, 61(4): 1445-1451.
[15] GARRY S, NESSLANY F, ALIOUAT E, et a1. Assessment of genotoxic effect of benzo (α) pyrene in endotracheally treated rat using the comet assay[J]. Meat Research, 2003, 122: 33-43.
[16] BEATA J. HPLC-fluorescence analysis of polycyclic aromatic hydrocarbons (PAHs) in pork meat and its gravy fried without additives and in the presence of onion and garlic[J]. Food Chemistry, 2011, 126: 1344-1353.
[17] 杨潇, 蔡克周, 卢进峰, 等. 烟熏液对卤煮牛肉中9种杂环胺含量的影响[J]. 食品科学, 2014, 35(21): 68-72.
[18] STJEPAN M, DAMIR I, BOZIDAR S G. A novel amperometric method for antioxidant activity determination using DPPH free radical[J]. Bioelectro Chemistry, 2005, 68(2): 175-180.
[19] AWIKA J M, ROONEY L W, WU Xianli, et al. Screening methods to measure antioxidant activity of Sorghum (Sorghum bicolor) and Sorghum products[J]. Journal of Agricultural and Food Chemistry, 2003, 51: 6657-6662.
[20] 黄莹像, 储大可, 邓晓婷, 等. 8种市售茶类饮料抗氧化活性及总酚含量的研究[J]. 广东农业科学, 2013, 18(4): 101-104.
[21] 孙秀梅, 梅光明, 陈雪昌, 等. 高效液相色谱荧光检测法测定水产品中15 种多环芳烃[J]. 南方水产科学, 2012, 8(3): 48-53.
[22] 王浩, 刘艳琴, 杨红梅, 等. 高效液相色谱法测定粮食中苯并芘残留的研究[J]. 粮油食品科技, 2007, 15(1): 53-54.
