乌珠穆沁肉羊自然放牧条件下肌内脂肪相关基因表达分析
2015-05-30曹欣宇梁图雅齐志欣斯琴其木格格日勒图
曹欣宇 梁图雅 齐志欣 斯琴其木格 格日勒图
摘 要:为研究自然放牧条件下不同月龄乌珠穆沁肉羊的股二头肌、肱三头肌、背最长肌3 个部位骨骼肌肌内脂肪相关基因的表达,采用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术测定肉羊生长过程中过氧化物酶体增殖剂激活受体γ亚型(peroxisome proliferator activated receptors,PPARγ)和脂肪酸合成酶(fatty acid synthase,FAS)相关基因(PPARγ、FAS)表达量。结果表明:两种基因表达量在各部位骨骼肌上的趋势相近。PPARγ基因的表达量在1月龄和12月龄较高,9月龄和18月龄较低;FAS基因的表达量在3月龄和12月龄较高,
9月龄和18月龄较低。通过对基因表达量与肌内脂肪的相关性分析可以得出,PPARγ基因和FAS基因的表达量与肌内脂肪含量呈负相关。
关键词:肉羊;肌内脂肪;PPARγ基因;FAS基因
Expression of Genes Related to Intramuscular Fat Content in Wuzhumuqin Sheep under Natural Grazing Conditions
CAO Xinyu, LIANG Tuya, QI Zhixin, Siqinqimuge, BORJIGIN Gerelt*
(College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018,China)
Abstract: To investigate the relationship between intramuscular fat contents and the related genes, biceps femoris (BF), triceps brachii (TB) and longissimus dorsi (LD) muscles were obtained from naturally grazing Wuzhumuqin sheep, and gene expression related to intramuscular fat contents were measured by real-time polymerase chain reaction (PCR). The results showed that the expression patterns of the peroxisome proliferator activated receptors (PPARγ) and fatty acid synthase (FAS) genes were similar in the three skeletal muscles. The PPARγ gene was highly expressed at 1 and 12 months of age but lowly expressed at 9 and 18 months of age, whereas the FAS gene was highly expressed at 3 and 12 months of age and also lowly expressed at 9 and 18 months of age. The correlation analysis revealed that there was a negative correlation between intramuscular fat contents and the expression of the PPARγ and FAS genes in skeletal muscle.
Key words: sheep; intramuscular fat; PPARγ gene; FAS gene
中图分类号:Q812 文献标志码:A 文章编号:1001-8123(2015)07-0025-05
doi: 10.7506/rlyj1001-8123-201507006
羊肉具有胆固醇含量低,营养价值高,味美多汁等品质特点[1-2]而受到广大群众的喜爱。影响羊肉品质的因素有很多,其中肌内脂肪含量是一个重要因素,肌肉不同部位脂肪含量的高低直接影响羊肉的风味、嫩度、多汁性等。肌内脂肪含量由年龄、环境、饲养以及肌内脂肪相关基因等多种因素来决定。参与基因调控的主要物质有过氧化物酶体增殖剂激活受体(peroxisome proliferator activated receptors,PPARs)[3-5]和脂肪酸合成酶(fatty acid synthase,FAS)。PPARs包括PPARα、PPARβ、PPARγ 3种亚型[4,6],能调控脂肪基因的表达并能使其脂肪细胞分化,调节脂类代谢相关基因和参与脂肪的吸收、运输、形成和分解过程[7]。FAS是机体内合成脂肪途径中的一个关键性的酶。FAS的表达可增加在体内甘油三酯的沉积而导致肥胖[8]。两种基因的表达在不同品种及不同骨骼肌组织中脂肪沉积存在着差异性。张长庆等[9]研究指出PPARγ基因在不同部位脂肪组织和肌肉组织中均有表达且部位不同而表达量具有差异性。Lee等[10]
研究指出PPAR基因的相对表达量在韩国牛27月龄的表达与其在12月龄时的韩国牛的相对表达量相比有3倍的关系。Clarke等[11]研究指出用高碳水化合物的日粮能提高其肝脏中FAS基因的表达,而高蛋白的日粮饲喂会降低FAS基因的表达。QiaoYong等[12]用实时荧光定量PCR法检测肌肉中FAS基因表达的发育性变化,发现FAS mRNA水平在新疆细毛羊和哈萨克羊肌肉中的发育模式各有不同,FAS基因mRNA的表达量与哈萨克羊肌内脂肪含量负相关。由于季节不同肉羊采食的牧草不同,肉羊在不同季节和生长阶段中肌内脂肪含量大不相同。梁图雅等[13]对乌珠穆沁肉羊不同月龄不同部位骨骼肌脂肪含量等进行了系统的研究,在此基础上本研究对自然放牧条件下乌珠穆沁肉羊不同月龄、不同骨骼肌部位的肌内脂肪相关基因表达量进行分析,更加深入的探讨自然放牧条件下季节变换对肉羊生长过程中肌内脂肪的影响。
1 材料与方法
1.1 材料与试剂
冬季出生并自然放牧条件的1、3、6、9、12、18月龄乌珠穆沁肉羊中各选3只。屠宰后采取股二头肌、肱三头肌、背最长肌的骨骼肌,小块分割后立即用液氮冷冻并密封保存备用。
Trizol RNA抽提试剂 美国TaKaRa试剂公司;BioRT Two Step反转录试剂盒、2×real time PCR Master Mix荧光定量PCR试剂、核酸燃料 北京百泰克生物有限公司;异丙醇、氯仿、无水乙醇、焦炭酸二乙酯 北京
全式金生物技术有限公司;5×TBE缓冲液、6×上样缓冲液溴酚兰、DNA Maker 天根生化科技有限公司。
1.2 仪器与设备
ND-1000型微量紫外分光光度计 美国NanoDrop公司;GDS-8000凝胶成像系统 美国UVP公司;高速冷冻离心机 湖南湘仪离心机仪器有限公司;电泳仪 北京百晶生物技术有限责任公司;CFX96TM实时荧光定量PCR仪 美国Bio-Rad公司。
1.3 方法
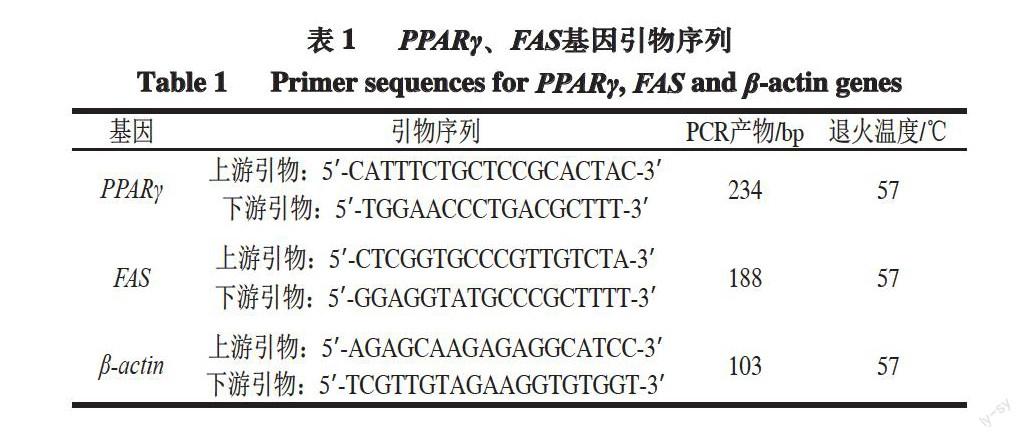
1.3.1 引物设计
目的基因PPARγ上下游引物序列参考Huang等[14]的方法,目的基因FAS上下游序列参考张英杰等[15]的方法。内参基因采用β-actin,其上下游引物序列参考吴琼彪等[16]的方法。引物如表1所示。
表 1 PPARγ、FAS基因引物序列
1.3.2 RNA的提取
取一定肉样在液氮中磨碎,约100 mg组织加入1mL裂解液。在25 ℃放置5 min,将其裂解细胞与溶剂混匀使核酸蛋白复合物完全分离。之后将样品4℃、12 000×g离心10 min,取上清液。上清液中加入0.2 mL氯仿,振荡15s,室温放置3 min。4 ℃、12 000×g离心15 min。待出现分层,分别为黄色有机相底层,无色水相上层以及中间层。小心提取含有RNA的水相转移到新管中,用冰异丙醇沉淀水相中的RNA,每使用1 mL Trizol加入0.5 mL异丙醇,低温放置10 min。4 ℃、12 000×g离心10 min,将上清液移去。75%乙醇洗涤RNA沉淀,每使用1 mL Trizol至少加1 mL 75%乙醇。4 ℃、7 500×g离心5 min,弃上清液。室温放置干燥RNA沉淀。再加25 μL无RNase水,轻摇RNA溶解。-80 ℃保存备用。
1.3.3 RNA浓度纯度检测
使用紫外分光光度计,用DEPC处理水校正零点,读取RNA样品OD260 nm/280 nm的比值及浓度。
1.4 数据分析
实时荧光定量PCR反应所得到的Ct值用运Excel软件进行计算其各自的表达量并用SAS软件进行显著性和与肌内脂肪含量的相关性分析。
2 结果与分析
2.1 乌珠穆沁肉羊不同月龄、不同骨骼肌部位PPARγ和FAS基因表达量
2.1.1 不同月龄、不同骨骼肌部位PPARγ基因表达
小写字母不同,表示相同部位、不同月龄间差异显著(P<0.05);大写字母不同,表示相同月龄、不同部位骨骼肌间差异显著(P<0.05)。下同。
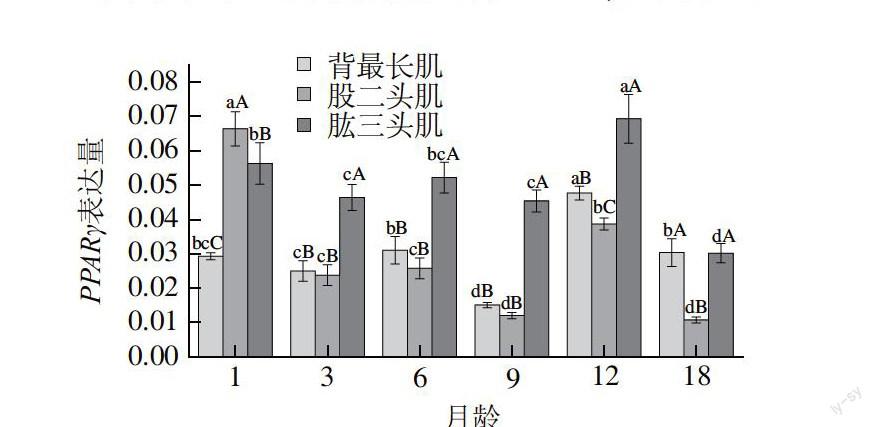
图 1 肉羊不同月龄不同骨骼肌部位PPARγ基因表达量
Fig.1 Relative expression levels of PPARγ gene in different muscles at different months of age
由图1可知,同一部位骨骼肌不同月龄之间的对比可以得出:对于背最长肌,肉羊PPARγ表达量1月龄和3月龄之间无显著差异;6月龄相对于3月龄其表达量显著提高(P<0.05);而9月龄的表达量最低,12月龄的表达量最高,均与1、3、6、9、18月龄间存在显著差异
(P<0.05);18月龄表达量与1月龄和6月龄表达量无显著差异,但比3月龄显著较高(P<0.05)。
对于股二头肌,肉羊1月龄PPARγ的表达量最高,与3、6、9、12、18月龄间存在显著差异(P<0.05);3月龄和6月龄PPARγ的表达量没有显著差异,且均显著高于9月龄PPARγ的表达量;12月龄PPARγ的表达量显著高于3、6、9、18月龄的表达量(P<0.05);18月龄PPARγ的表达量与9月龄没有显著差异,均显著低于1、3、6、12月龄的表达量(P<0.05)。
对于肱三头肌,1月龄PPARγ的表达量高于6月龄,但无显著性差异,1月龄PPARγ的表达量显著高于3月龄
(P<0.05);3、6、9月龄PPARγ的表达量没有显著差异;12月龄PPARγ的表达量显著高于1、3、6、9、18月龄(P<0.05);18月龄PPARγ的表达量其显著低于1、3、6、9、12月龄(P<0.05)。
同一个月龄段不同骨骼肌部位之间的对比可以得出:1月龄股二头肌的PPARγ基因表达量最高、肱三头肌次之、背最长肌最低,且3个部位间均存在显著差异
(P<0.05),背最长肌的表达量显著低于其他两个部位(P<0.05);3、6、9月龄背最长肌、股二头肌间PPARγ的表达量没有显著性差异,肱三头肌的表达量显著高于背最长肌和股二头肌两个部位(P<0.05);12月龄肱三头肌PPARγ的表达量显著高于其他两个部位(P<0.05),背最长肌的表达量显著高于股二头肌
(P<0.05)。18月龄背最长肌和肱三头肌表达量没有显著差异,均显著高于股二头肌表达量(P<0.05)。
2.1.2 不同月龄、不同骨骼肌部位FAS基因表达量
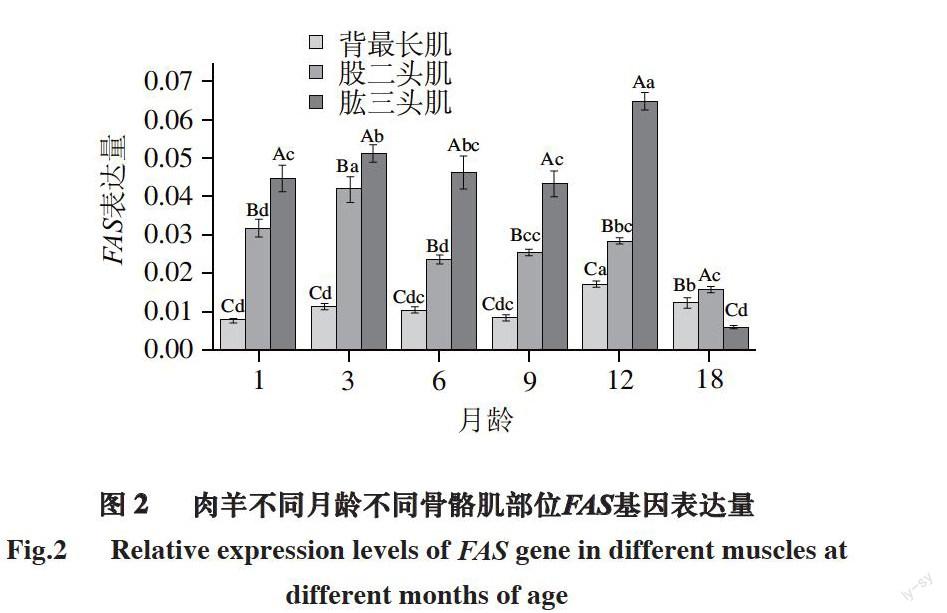
图 2 肉羊不同月龄不同骨骼肌部位FAS基因表达量
Fig.2 Relative expression levels of FAS gene in different muscles at different months of age
由图2可知,同一部位骨骼肌不同月龄之间的对比可以得出:对于肉羊背最长肌,3月龄、6月龄和12月龄之间FAS基因表达量无显著差异,但1月龄、9月龄、12月龄之间差异显著(P<0.05)。1月龄FAS的表达量极显著低于3月龄和6月龄((P<0.05),3月龄表达量显著高于9月龄,6月龄与9月龄之间无显著差异。1月龄与9月龄表达量无显著差异,9月龄表达量显著低于12月龄(P<0.05),18月龄相比于12月龄,表达量显著低
(P<0.05)。
对于股二头肌,1月龄FAS的表达量显著低于3月龄(P<0.05),3月龄的表达量最高,与1、6、9、12、18月龄间均具有显著差异(P<0.05);6月龄FAS的表达量稍低于9月龄FAS的表达量,而无显著差异;9月龄FAS的表达量低于12月龄FAS的表达量,但无显著差异;12月龄FAS的表达量显著高于18月龄FAS的表达量(P<0.05)。
对于肱三头肌,1月龄FAS的表达量显著低于3月龄FAS的表达量(P<0.05),3月龄FAS的表达量相对高于6月龄FAS的表达量,但无显著差异,6月龄FAS的表达量高于9月龄FAS的表达量,但无显著差异,9月龄FAS的表达量显著低于12月龄FAS的表达量(P<0.05),18月龄FAS的表达量显著低于1、3、6、9和12月龄FAS的表达量(P<0.05)。
同一个月龄段不同骨骼肌部位之间的对比可以得出:1、3、6、9、12月龄时肉羊的肱三头肌FAS的表达量最高,股二头肌FAS的表达量次之,背最长肌FAS的表达量最低,而且互相之间均存在显著差异(P<0.05);18月龄背最长肌FAS的表达量最高、股二头肌FAS的表达量次之、肱三头肌FAS的表达量最低,且均存在显著差异(P<0.05)。
2.2 乌珠穆沁肉羊肌内脂肪含量与PPARγ、FAS基因表达量及相关性分析
2.2.1 肌内脂肪含量与PPARγ、FAS基因表达量
表 2 肉羊不同月龄不同骨骼肌部位肌内脂肪含量与PPARγ、FAS基因表达量
由表2可知,PPARγ基因在9月龄和18月龄时表达相对较低,在12月龄时表达水平达到最高水平。FAS基因3月龄和12月龄表达量较高,18月龄表达量较低。2个基因的表达量与肌内脂肪含量的趋势正好相反,即与肌内脂肪含量呈负相关。
2.2.2 肌内脂肪含量与与PPARγ、FAS基因表达量相关性分析
由表3可知,在背最长肌部位上,PPARγ基因表达量与肌内脂肪含量之间呈负相关;在股二头肌上,其PPARγ基因表达量与肌内脂肪含量之间呈负相关;在肱三头肌上,其PPARγ基因表达量与肌内脂肪含量之间呈负相关。在背最长肌部位上,其FAS基因表达量与肌内脂肪含量之间呈负相关;在股二头肌部位上,其FAS基因表达量与肌内脂肪含量之间呈负相关;肱三头肌部位上,其FAS基因表达量与肌内脂肪含量之间的相关系数R为-0.980,在极显著水平上呈负相关。
表 3 肌内脂肪含量与PPARγ、FAS基因表达量相关性分析
3 讨 论
3.1 自然放牧条件下肉羊不同月龄,不同部位骨骼肌PPARγ基因与肌内脂肪的相关性
肉羊在自然放牧的条件下PPARγ基因表达量随月龄的变化在背最长肌、股二头肌和肱三头肌3个部位上的均有相同趋势。在9月龄和18月龄时表达量相对较低,而12月龄时达到最高水平。肉羊1月龄时,PPARγ基因表达量相对较高,其主要原因有可能是肉羊刚出生PPARγ基因要参与脂肪细胞的形成。3月龄时的肉羊通过运动、骨骼肌生长等原因,与1月龄相比较其PPARγ基因表达量变化较小。当肉羊6月龄时正值夏季,草原上牧草生长茂盛,PPARγ基因表达增加会使肌内脂肪增加。9月龄时牧草旺盛,肉羊肌内脂肪达到较高水平,因牧草旺盛机体本身具有较高的脂肪含量,而自身PPARγ基因表达量会降低并且不会过多表达使肌内脂肪沉积。12月龄的肉羊正处于冬季,因冬天牧草枯黄稀少,自身需要分化前脂肪细胞为脂肪细胞,因而PPARγ基因表达水平较高,使肌内脂肪含量保持在较低水平。18月龄时的肉羊又处于夏季,牧草旺盛,PPARγ基因表达量较低,原因可能是机体需要蓄积脂肪。因此,自然放牧的肉羊的PPARγ基因表达量以及肌内脂肪含量可能与牧草之间有很大的相关性。
在肉羊生长各个阶段,肌内脂肪含量与PPARγ基因表达量之间的相关性分析可知,背最长肌、股二头肌和肱三头肌部位上均存在负相关。这可能与PPARγ基因自身表达调控和本身脂肪丰富有一定的作用。有研究报道蒙古羊90~160日龄期间PPARγ基因与肌内脂肪含量相关系数为-0.884 9(P=0.1084)[17]。Huang等[14]研究发现在哈萨克羊中PPARγ基因在2~90日龄间的表达量与肌内脂肪含量呈负相关,其相关系数为-0.835(P<0.01)。郝称莉等[18]研究发现背最长肌PPARγ基因的表达量在4~12 月龄期间与肌内脂肪含量呈负相关,相关系数为-0.441(P=0.076),腰大肌PPARγ基因的表达量在2~12月龄期间与肌内脂肪含量呈负相关,相关系数为-0.120,股二头肌PPARγ基因的表达量在5~6月龄期间与肌内脂肪含量呈负相关,相关系数为-0.301。本实验中PPARγ基因与肌内脂肪含量相关性支持以上研究结果。
3.2 自然放牧条件下肉羊不同月龄不同部位骨骼肌FAS基因与肌内脂肪的相关性
自然放牧饲养条件下肉羊FAS基因随月龄变化的表达量为1月龄时背最长肌、股二头肌和肱三头肌部位上FAS基因表达量都在较低水平上。3月龄时肉羊FAS基因表达量升高,6月龄时肉羊FAS基因表达量在股二头肌部位上显著降低。
肉羊FAS基因表达量在1月龄时较低,原因可能是刚出生时主要以PPARγ等基因来调控脂肪细胞的形成。3月龄和12月龄的肉羊FAS基因表达量与1、6、9、18月龄时相比均偏高,而3月龄和12月龄的肉羊肌内脂肪含量均偏低,此原因可能与季节环境因素有关。又因3月龄和12月龄时冬季牧草缺少,肉羊机体需自身将葡萄糖等能量转变为脂肪,此过程中的最后一步合成脂肪酸时会需要FAS,因此机体本身的FAS基因表达量会增加,所以3月龄和12月龄时FAS基因表达量较高。9月龄和18月龄时牧草旺盛,机体自身的脂肪含量较多,所以肉羊FAS基因表达量较低。而6月龄的表达量与3月龄的表达量相比较低,可能与采食到的牧草量的增加有关。因此FAS基因表达量与肌内脂肪含量的相关关系为负相关。姚焰础[19]认为10~40 kg苏尼特羔羊肌内FAS基因持续表达,其表达量随体质量增加而下降,30 kg和40 kg时的表达量显著低于10 kg和20 kg(P<0.05),与本实验结果相同。
因此,自然放牧条件下肉羊的脂肪沉积和相关基因(PPARγ和FAS基因)的表达跟肉羊的生长(骨骼肌发达)、牧草以及饲养环境条件有着密切的关联性。
4 结 论
自然放牧条件下,肉羊与肌内脂肪相关的PPARγ和FAS基因表达量会随着月龄的增加、季节的变化而变化。肉羊PPARγ基因随着月龄增加的表达量为1月龄(刚出生)和12月龄(牧草枯竭)时表达较高,9月龄和18月龄(牧草旺盛)时表达较低。PPARγ和FAS基因相对表达量与肌内脂肪含量呈负相关。
参考文献:
[1] 梁富武. 乌珠穆沁羊的选育攻关[J]. 中国牧业通讯, 2010, 17: 38-39.
[2] 杨富民. 国内羊肉品质研究进展[J]. 甘肃科技, 2003, 19(2): 33-34.
[3] ENSER M, HALLETT K G, HEWETT B, et al. Fatty acid content and composition of UK beef and lamb muscle in relation to production system and implications for human nutrition[J]. Meat Science, 1998, 49(3): 329-341.
[4] LEMBERGER T, DESVERGNE B, WAHLII W. Peroxisome proliferator-activated receptors: a nuclear receptor signaling pathway in lipid physiology[J]. Annual Review of Cell and Developmental Biology, 1996, 12(1): 335-363.
[5] SCHOONJAN K, STAELS B, AUWERX J. Role of the peroxisome proliferator-activated receptor (PPAR) in mediating the effects of fibrates and fatty acids on gene expression[J]. Journal of Lipid Research, 1996, 37(5): 907-925.
[6] BRAISSANT O, FOUFELLE F, SCOTTO C, et al. Differential expression of peroxisome proliferator-activated receptors (PPARs): tissue distribution of PPARα, PPARβ and PPARγ in theadultrat[J]. Endocrinology, 1996, 137(1): 354-366.
[7] DEVINE J H, EUBANK D W, CLOUTHIER D E, et al. A dipose expression of the phosphoenolpyruvate carboxykinase promoter requires peroxisome proliferator-activated receptor γ and 9-cis-retinoic acid receptor binding to an adipocyte-specific enhancer in vivo[J]. Journal of Biological Chemistry, 1999, 274(19): 13604-13612.
[8] YAN Xinchun, WANG Yizhen, XU Zirong. Regulation of fatty acid synthase (FAS)gene expression in animals[J]. Acta Zoonutrimenta Sinica, 2002, 14(2): 1-4.
[9] 张长庆, 刘婷, 赵生国. PPARγ基因在荷斯坦公牛不同组织部位表达差异性研究[J]. 中国农学通报, 2014, 30(23): 13-18.
[10] LEE S H, PARK E W, CHO Y M, et al. Identification of differentially expressed genes related to intramuscular fat development in the early and late fattening stages of hanwoo steers[J]. Journal of Biochemistry and Molecular Biology, 2007, 40(5): 757-764.
[11] CLARKE S D, AMSTRONG M K, JUMP D B. Nutritional control of rat liver fatty acid synthase and S14 mRNA abundance[J]. The Journal of Nutrition, 1990, 120(2): 218-224.
[12] QIAO Yong, HUANG Zhiguo, XIE Zhuang, et al. Developmental changes of the FAS and HSL mRNA expression and their effects on the content of intramuscular fat in Kazak and Xinjiang sheep[J]. Journal of Genetics and Genomics, 2007, 34(10): 909-917.
[13] 梁图雅, 额日克古丽, 格日勒图. 乌珠穆沁羊生长过程中食肉营养成分变化分析[J]. 肉类研究, 2013, 27(7): 30-34.
[14] HUANG Z G, XIONG L, LIU Z S, et al. The developmental changes and effect on IMF content of H-FABP and PPARγ mRNA expression in sheep muscle[J]. Acta Genetica Sinica, 2006, 33(6): 507-514.
[15] 张英杰, 刘月琴, 刘景云. 日粮不同蛋白水平对绵羊脂肪和肌肉中FAS基因表达的影响[J]. 畜牧兽医学报, 2010, 41(7): 829-834.
[16] 吴琼彪, 格日勒图. 不同月龄乌珠穆沁羊骨骼肌中Myostatin表达量变化规律分析[D]. 呼和浩特: 内蒙古农业大学, 2013.
[17] 国家加工食品质量监督检验中心(广州), 广州市产品质量监督检验所等. GB/T 9695.18—2008 肉与肉制品 总灰分测定[S]. 北京: 中国标准出版社, 2008.
[18] 郝称莉. 湖羊肌肉组织H-FABP和PPARγ基因表达水平与肌内脂肪含量的相关研究[J]. 中国农业科学, 2008, 41(11): 3776-3783.
[19] 姚焰础. 苏尼特羔羊肌内脂肪细胞分化相关因子和肌内脂肪代谢关键酶基因表达发育规律的研究[D]. 呼和浩特: 内蒙古农业大学, 2008.
