乌珠穆沁羊生长过程中骨骼肌MyHC基因变化
2015-05-30冯青辉斯琴其木格苏和朝格赛薛宝玲格日勒
冯青辉 斯琴其木格 苏和 朝格赛 薛宝玲 格日勒
摘 要:研究不同生长阶段肉羊骨骼肌肌球蛋白重链(MyHC)基因相对表达量的变化规律,实验选择自然放牧条件下的1、3、6、9、12、18月龄的乌珠穆沁羊,屠宰后采取股二头肌、背最长肌,采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)法分离骨骼肌中肌球蛋白重链异构体,利用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术测定MyHC基因的相对表达量并探讨其变化规律。结果表明:从SDS-PAGE图中可以清晰地观察到4条条带分别为Ⅱa、Ⅱx、Ⅱb型与Ⅰ型。其中乌珠穆沁羊股二头肌和背最长肌中MyHC的Ⅰ型和Ⅱa型基因的相对表达量均高于Ⅱb型基因的相对表达量。
关键词:乌珠穆沁羊;骨骼肌;肌球蛋白重链基因;实时荧光定量聚合酶链式反应
Changes in Myosin Heavy Chain (MyHC) Gene from Skeletal Muscle during the Growth of Wuzhumuqin Sheep
FENG Qinghui1, Siqinqimuge1, SU He2, CHAO Gesai3, XUE Baoling1, BORJIGIN Gerelt1,*
(1.College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China;
2.Inner Mongolia Xilinhot Husbandry Bureau, Xilinhot 026000, China;
3.Inner Mongolia Xilinhgol Farming and Animal Husbandry Management, Xilinhot 026000, China)
Abstract: This study was aimed to investigate the changes in the relative expression level of myosin heavy chain (MyHC) gene from skeletal muscle during the growth of Wuzhumuqin sheep. Free-grazing Wuzhumuqin sheep were slaughtered at 1, 3, 6, 9, 12 and 18 months of age and the biceps femoris and longissimus dorsi muscles were excised. MyHC isoforms were separated from the muscles by sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE), and the relative expression level of MyHC gene was measured by real-time polymerase chain reaction (PCR). The results showed that four clear bands representing type Ⅱa, type Ⅱx, type Ⅱb and type Ⅰ, respectively, were observed in the electrophoretic pattern. The expression of MyHC type Ⅰ gene and type Ⅱa in biceps femoris and longissimus dorsi was higher than that of MyHC type Ⅱb gene. Understanding the MyHC gene expression in skeletal muscle during the growth of sheep is of great practical importance for improving meat quality and post-mortem physiological and biochemical characteristics.
Key words: Wuzhumuqin sheep; skeletal muscle; myosin heavy chain; real time-polymerase chain reaction (PCR)
中图分类号:TS251.53 文献标志码:A 文章编号:1001-8123(2015)07-0020-05
doi: 10.7506/rlyj1001-8123-201507005
骨骼肌是由多核细胞的肌纤维(肌细胞)组成。肌纤维由很多肌原纤维组成,而肌原纤维是由很多不同蛋白质而构成。其中肌球蛋白是一个由高度保守的多基因编码,含有多种同工蛋白的家族,它也是骨骼肌的主要收缩蛋白[1]。肌球蛋白分子由2个肌球蛋白重链和两对起调节作用的肌球蛋白轻链组成,具有ATPase活性[2]。在多种肌球蛋白同工型基因共同表达模式的作用下,肌纤维的表型呈多样性[3]。依据肌球蛋白重链(MyHC)基因的类型可将肌纤维分为4种,即MyHCⅠ、MyHCⅡa、MyHCⅡb和MyHCⅡx,它们分别特征性的对应4种不同类型的肌纤维Ⅰ、Ⅱa、Ⅱb和Ⅱx。在代谢上分别与慢速氧化型、快速氧化型、快速酵解型和中间类型肌纤维相对应[4-5]。肌纤维的类型及组成不仅决定了骨骼肌的生长发育,还会影响肉的生理生化特性及感官品质[6-7]。目前,国内外关于肌球蛋白重链基因表达规律的研究有很多。Changa等[8]指出肌球蛋白的分子类型依靠肌球蛋白重链相关基因来有效表达,通过MyHCⅠ、MyHCⅡa、MyHCⅡb、MyHCⅡx在骨骼肌上的表达和依据肌纤维与肌球蛋白重链的相关基因的特异性,动物骨骼肌肌纤维可对应的进行分型。杨晓静[9]对猪骨骼肌生长及肌纤维类型分布的分子机理进行了研究。杨飞云[10]
对猪骨骼肌肌纤维类型分布及转化的分子机理进行了研究。郭佳等[11]研究了金华猪背最长肌中不同肌球蛋白重链基因表达的发育性变化。张辉等[12]研究了FoxO1、肌纤维类型标志基因和MyHCⅠ、MyHCⅡb、MyHCⅡa和MyHCⅡx在特定骨骼肌中的表达规律,结果显示,FoxO1在不同骨骼肌类型中mRNA表达差异不显著(P>0.05),其蛋白表达与MyHC各亚型显著相关。沈洁等[13]
研究了家兔骨骼肌肌球蛋白重链构成的电泳。范晓华等[14]
研究了大鼠脊髓横断早期比目鱼肌质量与肌球蛋白重链亚型mRNA表达的变化。鲁建清等[15]研究了骨骼肌肌球蛋白重链与不同类型训练的影响。辛雪等[16]研究了巴美肉羊肌球蛋白重链基因的表达规律。此外有关鱼、牛和猪等动物身上也有较多的肌球蛋白重链基因研究报道[17-18]。
而有关对肉羊身上的研究很少,特别是肉羊生长过程中的肌球蛋白重链基因的表达研究极少。乌珠穆沁羊是我国优良肉用品种,集中在乌珠穆沁区域,近几年主要分布在锡林郭勒盟的东、西乌珠穆沁旗、阿巴哈纳尔旗部分地区[19]。乌珠穆沁羊是经过自然放牧和人工选择逐步繁育而形成的内蒙古地方优良品种之一,属肉用粗毛羊;具有体大、肉质嫩、肉中脂肪含量适中、含有多种对人体有益的矿物质并且发育生长迅速等特点。本实验对乌珠穆沁肉羊随着月龄的增加MyHCⅠ、MyHCⅡa、MyHCⅡb和MyHCⅡx各基因的相对表达量进行分析,旨在掌握肉羊随月龄的增加骨骼肌肌球蛋白重链基因的相对表达量的变化规律。
1 材料与方法
1.1 材料与试剂
内蒙古锡林郭勒盟自然放牧条件下的同一个羊群的乌珠穆沁羊各3 只,分别是1、3、6、9、12、18 月龄。将其屠宰后取股二头肌和背最长肌,样品分装,然后液氮中速冻,带回实验室放入-80 ℃保存。
Tris试剂 南京博尔迪生物科技有限公司;丙烯酰胺、蔗糖 天津永大化学试剂厂;双丙烯酰胺 上海紫一试剂厂;三氯甲烷 天津市科盟化工工贸有限公司;异丙醇 南京市新源化工;核酸染料 北京全式金生物技术有限公司;焦碳酸二乙酯、反转录试剂盒 大连宝生物有限公司。
1.2 仪器与设备
BG-power600型稳流恒压电泳仪 北京白晶生物技术有限公司;LHS-50CH恒温恒湿箱 上海一恒科学仪器有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;ChampGel6000凝胶成像仪北京赛智创业科技有限公司;BG-Qspin600转微型离心机 北京百晶生物技术有限公司;CFX96TM实时荧光定量
PCR仪 美国Bio-Rad公司;DSH-300A型回旋式恒温水浴振荡器 上海亚荣生化仪器厂。
1.3 方法
1.3.1 肌球蛋白的提取
骨骼肌肌球蛋白的提取方法参考Light等[20]的方法。取去掉脂肪以及大块结缔组织的肌肉组织切成碎块,称取10 mg。向10 mg的肌肉组织中加入500 μL蛋白质提取试剂Pro-Prep,3000V、0.3 min,匀浆3 次。将样品冰上静置30 min。4 ℃、13 000 r/min离心5min,分离上清液,并将其装好放入-20 ℃环境下保存备用。
1.3.2 SDS-PAGE电泳分离肌球蛋白重链异构体
SDS-PAGE电泳分离肌球蛋白重链异构体参考Light等[20]的方法进行分离。进行SDS-PAGE电泳,待蓝紫色线距离凝胶板底部2 cm处停止电泳。最后4 ℃染色约为2 h,4 ℃脱色,每1.5~2 h更换一次脱色液直至电泳条带清晰。
1.3.3 总RNA的提取
总RNA的提取方法参考Trizol法[21]。取100~200 mg的乌珠穆沁羊的股二头肌和背最长肌置于液氮中研磨,加液氮时应迅速、少量多次,并且肌肉组织应始终处于冷冻状态下。将标号1.5 mL无酶无菌EP管称量、去皮,然后拿小药匙取100 mg肌肉粉末放入其中。在1.5 mL无酶无菌EP管中加1 mL的Trizol,冰浴5 min。4 ℃、12 000 r/min,离心5 min,吸取上清液(约1 000 μL)。加200 μL氯仿(1/5体积),盖紧管盖,剧烈振荡15 s,无分相沉淀后室温静置5 min。4 ℃、12 000 r/min,离心15 min(离心后勿振荡或混匀)这时样品分为3 层,上层为RNA、中间层为DNA、下层为蛋白质。之后小心吸取上清液约500 μL转移到新的无酶无菌EP管中。加入等体积异丙醇,上下混合均匀,室温放置10 min。4 ℃、12 000 r/min,离心10 min后,得白色沉淀,丢弃上清。离心后可在管侧壁和管底看见少量的RNA胶状沉淀。管壁中加入焦碳酸二乙酯处理的75%乙醇1 mL,然后轻轻上下颠倒洗涤沉淀。4 ℃、12 000 r/min,离心5 min,弃上清。轻轻吹打沉淀,等RNA完全溶解后置于-80 ℃保存。分别取5 μLRNA溶液、2 μL缓冲液混匀,然后用1%琼脂糖凝胶电泳来检测总RNA质量的完整性,分析RNA的浓度和纯度。
1.3.4 反转录
利用大连宝生物工程有限公司反转录试剂盒的指导说明进行反转录操作,进而合成cDNA。
1.3.5 引物设计及合成
在National Center For Biotechnology Information(NCFI)网中查找到绵羊肌球蛋白重链MyHCⅠ、MyHCⅡa、MyHCⅡb和MyHCⅡx各基因的核苷酸序列,然后应用Primer Premier 5.0软件来对引物进行分析,之后由博览特生物技术有限公司进行引物的设计和合成。
1.3.6 PCR条件优化
由于目的基因PCR引物长度的最适退火温度与PCR反应体系的最适退火温度不同,cDNA浓度也不同,导致在做实时荧光定量PCR实验前,对PCR反应体系来进行温度梯度实验,以此来探究最佳退火温度。
1.3.7 实时荧光定量PCR
利用CFX96TMReal Time System实时PCR系统来进行实时定量扩增。用反转录的cDNA为模板,看家基因β-actin为内参,每个样品进行3个重复。Real-Time PCR体系中荧光物质的特异性与目的基因的目的片段来进行结合,CFX96TMReal Time System实时的PCR系统收集到荧光信号量与PCR产物量成正比。实时荧光定量PCR反应总体系为25μL,其中:灭菌ddH2O 8.5μL,cDNA的模板2μL,上游引物(10μmol/L)1μL,下游引物(10μmol/L)1μL,SYBR Premix Ex TaqⅡ(2×)12.5μL。
采用两步法来进行PCR反应程序:95℃预变性30s,60℃退火30s,总共40个循环。基因相对表达采用2-ΔΔCt公式计算。
2 结果与分析
2.1 RNA的质量评定
用1%琼脂糖凝胶电泳来检测总RNA质量的完整性。图1是股二头肌总RNA琼脂糖凝胶电泳,图2是背最长肌总RNA琼脂糖凝胶电泳。电泳检测的结果显示28S、18S、5S条带较为清晰,说明RNA几乎没有被降解,可在cDNA的合成和RT-PCR中使用。
图 1 股二头肌总RNA质量鉴定结果
Fig.1 Identification of total RNA isolated from biceps femoris
图 2 背最长肌总RNA质量鉴定结果
Fig.2 Identification of total RNA isolated from longissimus dorsi
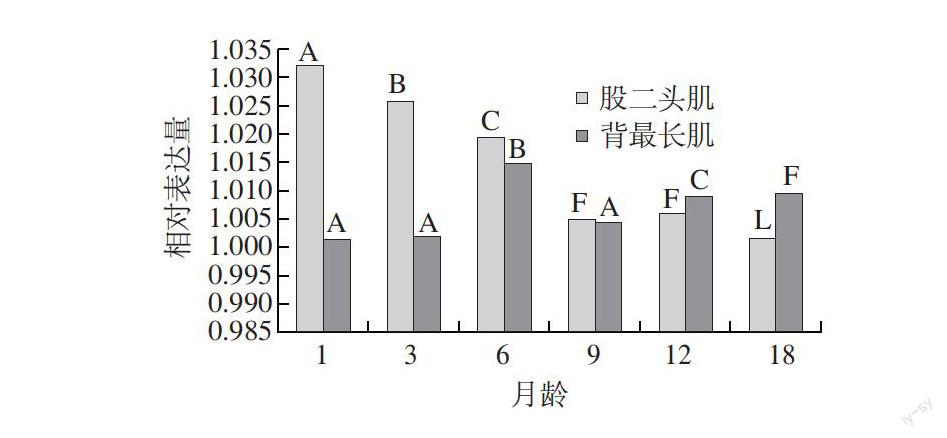
2.2 PCR产物扩增结果
图 3 普通RT-PCR产物琼脂糖电泳图
Fig.3 Agarose gel electrophoresis of RT-PCR products
由图3可知,普通RT-PCR扩增出的MyHC基因的Ⅰ、Ⅱa、Ⅱb、Ⅱx型和β-actin基因长度分别为165、200、216、284、233bp。能够清晰地观察到普通RT-PCR扩增出的目的片段预期的大小,并且没有其他条带,这说明目的基因片段产生明显的特异性扩增条带,所设计引物的特异性较好,符合后期RT-PCR实验要求。
2.3 MyHCⅠ型基因在股二头肌和背最长肌中的相对表达量
大写字母不同,表示不同月龄、相同部位之间差异显著(P<0.05)。下同。
图 4 不同月龄乌珠穆沁羊股二头肌和背最长肌中MyHCⅠ基因
mRNA相对表达量
Fig.4 Relative expression of MyHCⅠ mRNA in biceps femoris and longissimus dorsi of Wuzhumuqin sheep at different ages
由图4可知,在股二头肌中MyHCⅠ型基因的mRNA相对表达量有不同变化现象。1月龄>3月龄>6月龄>9月龄≈12月龄>18月龄,总体上1~18月龄有明显的下降趋势,但9、12月龄之间的差异不显著。1、3、6、9、18月龄之间的差异显著(P<0.05)。在不同的生长阶段中背最长肌的MyHCⅠ型基因mRNA在6月龄时的相对表达量显著较高于其他月龄段(P<0.05)。1、3、9月龄之间差异均不显著。
2.4 MyHCⅡb型基因在股二头肌和背最长肌中的相对表达量
由图5可知,在不同生长阶段MyHCⅡb型基因mRNA相对表达量在不同骨骼肌中的表达有所不同。在股二头肌中,12月龄的相对表达量与其他月龄相比有显著性差异(P<0.05),在3、6、18月龄之间的差异不显著。不同生长阶段背最长肌中MyHCⅡb型基因mRNA相对表达量变化在3月龄时有较高的表达量,与其他月龄相比有显著性差异(P<0.05)。1月龄和6月龄之间差异不显著,9、12、18月龄之间差异均不显著。
图 5 不同月龄乌珠穆沁羊股二头肌和背最长肌中MyHCⅡb基因mRNA相对表达量
Fig.5 Relative expression of MyHCⅡb mRNA in biceps femoris and longissimus dorsi of Wuzhumuqin sheep at different ages
2.5 MyHCⅡa型基因在股二头肌和背最长肌中的相对
表达量
图 6 不同月龄乌珠穆沁羊股二头肌和背最长肌中MyHCⅡa基因mRNA相对表达量
Fig.6 Relative expression of MyHCⅡa mRNA in biceps femoris and longissimus dorsi of Wuzhumuqin sheep at different ages
由图6可知,在不同生长阶段MyHCⅡa型基因的mRNA相对表达量在股二头肌中的变化为18月龄>9月龄≈6月龄>3月龄≈12月龄>1月龄。1~18月龄有逐步升高的趋势。18月龄相对表达量与其他月龄的表达量之间差异显著(P<0.05)。3、12月龄差异不显著。6、9月龄之间差异不显著。不同生长阶段MyHCⅡa型的基因mRNA相对表达量在背最长肌中的变化为9月龄>1月龄>12月龄≈18月龄>3月龄>
6月龄,9月龄与其他月龄之间差异显著(P<0.05),12、18月龄之间差异均不显著。
2.6 MyHCⅡx型基因在股二头肌和背最长肌中的相对表达量
由图7可知,在不同生长阶段MyHCⅡx型基因mRNA的相对表达量在股二头肌中的变化为12月龄>3月龄≈
18月龄>6月龄>1月龄>9月龄。12月龄与其他月龄之间差异显著(P<0.05),3、18月龄之间差异不显著
(P<0.05)。不同生长阶段背最长肌中MyHCⅡx型基因mRNA相对表达量变化为9月龄>1月龄>12月龄≈18月龄>3月龄≈6月龄,9月龄的表达与其他月龄相比有显著性差异(P<0.05),3、6、12、18月龄之间差异均不显著。
图 7 不同月龄乌珠穆沁羊股二头肌和背最长肌中MyHCⅡx基因mRNA相对表达量
Fig.7 Relative expression of MyHCⅡx mRNA in biceps femoris and longissimus dorsi of Wuzhumuqin sheep at different ages
3 讨 论
总体上看,不同类型的肌球蛋白重链基因的特异性表达与不同类型的肌纤维(不同部位骨骼肌)之间存在着对应关系。本结果与Devoto等[22]的实验结论一致。家畜在它的生长以及运动等过程中骨骼肌中不同肌球蛋白重链相关基因之间也存在着相互转化的关系,这种转化关系也是导致不同类型肌纤维之间相互转化的诱导因素[23]。动物体肌纤维在色泽、直径、供能方式、酶活性、收缩速度上存在差异。不同类型肌纤维的生长具有特异性,而且其受遗传、营养和生活环境等因素的影响在生长过程中不断发生转化。事实上,各种肌球蛋白重链和肌球蛋白轻链异形体在肌纤维中的分布并不是严格的局限于某种肌纤维或肌肉发育的特定阶段。肌球蛋白重链和肌球蛋白轻链异形体有多种多样的结合形式,构成了大量的肌球蛋白分子。肌肉中肌纤维类型的构成、机能、形态学上的差异与酮体肉质性状、产肉量以及脂肪交杂、风味等性能方面有着密切关系。例如,日本和牛是以优良肉质而闻名世界。研究表明,日本国内产的肉用牛因品种的不同,肌纤维类型在特征上有很大的区别,即黑色和牛中荷尔斯泰因品种的βR型(红色肌纤维)比褐色和牛的多,这可能与肉质的改良有关系。另外,同一种黑色和牛中因饲养条件、产地等的不同,肌纤维类型也不同。肌纤维类型与产肉性质,特别是体质量增加和脂肪交杂的关系更值得重视;到目前为止还未明确的解析它们之间的关系。有研究表明动物出生后随着生长发育肌纤维增大肌肉质量也增加,白色肌纤维的直径比红色肌纤维变化大,从αR型肌纤维转移αW型。有关动物出生后肌纤维的分化方面Ashmore等[24]指出,牛出生时所有肌纤维是红色肌纤维,纯红色肌纤维的βR型不引起出生后分化,而αR型的一部分分化为αW型。这些因素可能关系到动物产肉量的增加。研究者们认为通过育种、改良来增加肌肉质量主要关系到白色肌纤维的构成比率。肉质,特别是脂肪交杂的肌肉,其中红色肌纤维的比例越高优质的脂肪交杂越高,例如黑色和牛。因此,不同种类骨骼肌骨骼肌之间,肌内蓄积脂肪含量比率有显著差别。因此研究肌纤维的生成、结构、类型及其转化规律有着重要的实际意义。肌肉中肌纤维类型的组成对宰后肉品质、生理生化等特性具有重要影响。
4 结 论
总体上乌珠穆沁羊股二头肌中MyHCⅠ型基因的相对表达量高于MyHCⅡb型基因的相对表达量,并MyHCⅠ型和MyHCⅡa型基因的相对表达量高于MyHCⅡb型基因的相对表达量。乌珠穆沁羊不同生长阶段背最长肌中除了3月龄外,其他月龄MyHCⅠ型和MyHCⅡa型基因的相对表达量都要高于MyHCⅡb型基因的相对表达量。
参考文献:
[1] CHIKUNI K, TANABE R, MUROYA S, et al. Difference inmolecular structure among the procine myosin heavy chain-2a, -2x and -2b isoforms[J]. Meat Science, 2001, 57(3): 311-317.
[2] WEISS A, LEINWAND L A. The mammalian myosin heavychain gene family[J]. Annual Reviews of Cell & Development Biology, 1996, 12(1): 417-439.
[3] EGGERT J M, DEPREUX F F S, SCHINEKEL A P, et al. Myosin heavychain isoforms account for variation in pork quality[J]. Meat Science, 2002, 61(2): 117-126.
[4] SCHIAFFINO S, REGGIANI C. Molecular diversity of myofibrillar proteins: gene regulation and functional significance[J]. Physiological Reviews, 1996, 76(2): 371-423.
[5] CHANG K C, FEMANDES K. Developmental expression and 5cloning of the porcine 2x and 2b myosin heavy chaingenes[J]. DNA and Cell Biology, 1997, 16(12): 1429-1437.
[6] 尹靖东. 动物肌肉生物学与肉品科学[M]. 北京: 中国农业大学出版社, 2011: 164-183.
[7] LEFAUCHEUR L. A second look into fibre typing-relation tomeat quality[J]. Meat Science, 2010, 84(2): 257-270.
[8] CHANGA K C, COSTA N D, BLACKLEY R, et al. Relationships of myosin heavy chain fibre types to meat quality traits intraditional and modem pigs[J]. Meat Science, 2003, 64(1): 93-103.
[9] 杨晓静. 猪骨骼肌生长及肌纤维类型分布的分子机理研究[D]. 南京: 南京农业大学, 2004: 28-35.
[10] 杨飞云. 猪骨骼肌肌纤维类型分布及转化的分子机理研究[D]. 雅安: 四川农业大学, 2008: 33-38.
[11] 郭佳, 徐娥, 黄明, 等. 金华猪背最长肌中不同肌球蛋白重链基因表达的发育性变化[J]. 中国畜牧杂志, 2012, 48(5): 14-17.
[12] 张辉, 史新娥, 袁媛, 等. FoxO1抑制猪骨骼肌MyHCⅠ的表达[J]. 中国生物化学与分子生物学报, 2010, 26(3): 283-289.
[13] 沈洁, 徐大刚, 朱道立, 等. 家兔骨骼肌肌球蛋白重链构成的电泳[J]. 安徽农业科学, 2008, 36(1): 46-49.
[14] 范晓华, 纪树荣, 周红俊, 等. 大鼠脊髓横断早期比目鱼肌重量与肌球蛋白重链亚型mRNA表达的变化[J]. 中国康复理论与实践, 2006, 12(4): 298-300.
[15] 鲁健清, 汤长发, 尹丽琴, 等. 骨骼肌肌球蛋白重链与不同类型训练的影响[J]. 中国组织工程研究与临床康复, 2010, 14(28): 5289-5292.
[16] 辛雪, 苏琳, 赵雅娟, 等. 巴美肉羊肌球蛋白重链基因表达规律的研究[J]. 肉类研究, 2014, 26(10): 134-138.
[17] FRANCISCO C L, JORGE A M. Muscle fiber type characterization and myosin heavy chain (MyHC) isoform expression in Mediterranean buffaloes[J]. Meat Science, 2011, 88(3): 535-541.
[18] 佚名. 乌珠穆沁羊繁育基地建设情况[J]. 新疆畜牧业, 2009(增刊2): 43-44.
[19] 刘震乙, 文浴兰, 沙里, 等. 乌珠穆沁羊品种志[J]. 内蒙古农牧学院学报, 1982(1): 1-6.
[20] LIGHT N, CHAMPION A E, VOYLE C, et al. The role of epimysial, perimysial and endomysial collagen in determining texture in six bovine muscles[J]. Meat Science, 1985, 13(3): 137-149.
[21] 于寒松, 彭帅, 谢远红, 等. 一种RNA提取试剂盒: Trizol的使用方法初探[J]. 食品科学, 2005, 26(11): 39-42.
[22] DEVOTO S H, MELANCON E, EISEN J S, et al. Identification of separate slow and fast muscle precursor cells in vivo prior to somite formation[J]. Development, 1996, 122(11): 3371-3380.
[23] 高强. 肌球蛋白重链基因MyHC与中国地方鸡肌肉品质之间的相关研究[D]. 北京: 中国农业大学, 2007: 20-28.
[24] ASHMORE C R, DOERR L. Comparative aspects of muscle fiber types in different species[J]. Experimental Neurology, 1971, 31(3): 408-418.
