梓醇对模拟缺血再灌注损伤兔窦房结细胞凋亡及细胞骨架β—微管蛋白的影响
2015-05-30刘如秀等
刘如秀等

摘要:目的 观察地黄主要有效成分梓醇对模拟缺血再灌注损伤兔窦房结细胞凋亡及细胞骨架β-微管蛋白(β-tubulin)的影响,探讨其治疗病态窦房结综合征的机制。方法 取新生乳兔窦房结细胞,分为正常组、模型组及梓醇高、中、低剂量组。以缺氧缺糖模拟缺血、恢复氧和糖的供应模拟再灌注造成窦房结细胞损伤模型。正常组与模型组给予等体积培养基,梓醇高、中、低剂量组给予终浓度为100、20、10 μg/mL药物,应用酶标仪、流式细胞仪、激光共聚焦显微镜观察各组窦房结细胞凋亡率、β-tubulin的形态变化。结果 模型组细胞凋亡率较正常组明显增加(P<0.01),β-tubulin裂解明显。与模型组比较,梓醇高、中、低剂量组细胞凋亡率明显降低(P<0.01),β-tubulin结构明显完整,荧光强度明显升高(P<0.01)。结论 梓醇抑制模拟缺血再灌注引起的窦房结细胞凋亡,保护窦房结β-tubulin形态可能是地黄治疗病态窦房结综合征的机制之一。
关键词:梓醇;窦房结细胞;缺血再灌注;细胞凋亡;β-微管蛋白;兔
DOI:10.3969/j.issn.1005-5304.2015.08.016
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2015)08-0059-04
Effects of Catalpol on Apoptosis and β-Tubulin of Rabbit Sinoatrial Node Cells in Vitro Injured by Simulated Ischemia Reperfusion LIU Ru-xiu, PENG Jie, LIU Yu, LIU Jin-feng, WANG Yan-li (Guanganmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China)
Abstract:Objective To observe the effects of catalpol, the effective component of Rehmanniae Radix, on atrionector cell apoptosis and β-tubulin in vitro rabbit injured by simulated ischemia reperfusion;To explore the mechanism of treating sick sinus syndrome. Methods Atrionector cells were collected from newborn rabbits. Cells were divided into 5 groups:normal group, model group, catalpol high, medium and low dose groups. Anoxia and aglycaemia were established to simulate ischemia. Atrionector cellular damage models were established by recovering the supply of oxygen and sugar. Normal control group and model group were given the same volume of culture medium, while catalpol high, medium and low dose groups were given medicine with relevant concentrations (100, 20, 10 μg/mL, respectively). ELISA, FCM, laser scanning confocal microscopy were used to observe apoptosis rate and β-tubulin of atrionector in each group. Results Apoptosis rate of the model group was obviously higher than the normal group (P<0.01), and β-tubulin cleavage was obvious. Apoptosis rate in catalpol high, medium and low dose groups were significantly lower than that of the model group (P<0.01);β-tubulin structure were significantly more complete compared with the model group;the fluorescence intensity was significantly higher than that of model group (P<0.01). Conclusion Catalpol can inhibit atrionector cellular apoptosis caused by simulated ischemia reperfusion. Its protective effects on atrionector β-tubulin may be the mechanism of the treatment of Rehmanniae Radix for sick sinus syndrome.
Key words:catalpol;atrionector cell;ischemia reperfusion;apoptosis;β-tubulin;rabbits
病态窦房结综合征(以下简称“病窦”)是临床难
基金项目:国家自然科学基金(81173447)
治性重大心血管疾病,至今尚无有效根治措施。中医药治疗病窦从整体入手,通过多种作用环节缓解病情,可改善患者的生存质量,提高生存率,延长寿命。病窦的病机多为心肾阳虚、瘀血阻滞。然善补阳者,必于阴中求阳,且病窦患者久病伤阴,地黄性凉甘润而能滋阴生血,为治疗病窦的常用中药[1]。梓醇(catalpol)是地黄的主要有效成分之一,有研究显示,梓醇具有对抗神经细胞凋亡、细胞氧化性损伤、炎症反应等作用[2-4],但目前鲜见对窦房结细胞凋亡和细胞骨架蛋白的研究。本研究从降低细胞凋亡率、保护细胞骨架β-微管蛋白(β-tubulin)两方面揭示梓醇对模拟缺血再灌注损伤兔窦房结细胞的保护机制,为临床运用地黄治疗病窦提供实验依据。
1 材料与方法
1.1 动物
出生24 h内新西兰乳兔8只,雌雄不拘,北京隆安实验动物养殖中心,合格证号11401400000095。
1.2 药物
梓醇,中国药品生物制品检定研究院,批号110808- 201210。
1.3 主要试剂与仪器
DMEM/F12(1∶1)培养基,美国Thermo公司;一抗:anti-beta tubulin antibody,美国Sigma公司;二抗:Gote Anti-Mouse IgG(H+L)Rhodamine(TRITC),美国Bioworld公司;胎牛血清,美国Gibco公司;低糖DMEM培养基,美国Hyclone公司;胰酶,美国Gibco公司。流式细胞分析仪(BD,美国),TCS-NT型激光共聚焦显微镜(德国),TMC63544防震台(美国)。
1.4 窦房结细胞的分离与培养
新生24 h内乳兔8只,吸入乙醚麻醉,用75%酒精消毒乳兔皮肤及手术区,置于冰面上。沿前正中线剪开胸腔,暴露心脏,将心底部大血管剪断,游离心脏,尽量保留大血管,用PBS清洗心脏3遍,直至无余血。在解剖镜下分离窦房结区域,用PBS清洗分离的组织,将清洗后的组织置于培养皿中,用眼科剪将组织剪碎,约0.5 mm大小,尽量于冰面上操作。将剪碎的组织置于5 mL离心管中,加入0.1%胰酶10 mL,37 ℃消化15 min,每隔5 min轻摇1次,查看情况,消化完毕,加入5 mL含血清培养基终止消化,用移液枪上下吹打70次,400 r/min离心5 min,上清液移入另一50 mL离心管,将沉淀组织块再加入0.1%胰酶10 mL,同前法消化,终止消化后,吹打,离心,取上清细胞悬液与第1次细胞悬液合并,重复1次,将3次所得细胞悬液合并至50 mL离心管,1500 r/min离心10 min,弃上清液,用含血清培养基6 mL重新悬浮细胞。取4个10 cm培养皿,各加入10 mL培养基,将细胞悬液等分移入培养基中,将培养皿置于37 ℃、5%CO2细胞培养箱中孵育1 h,光镜下观察可见大量纤维细胞,间质细胞贴壁,将上浮细胞取出,置于另4个培养皿中培养,24 h后更换新培养基,之后每48 h更换培养基[5]。
1.5 造模与分组
以缺氧缺糖模拟缺血,以恢复氧和糖的供应模拟再灌注。用不含胎牛血清的低糖培养基置换原培养基,放入自制密闭盒中,持续通入氮气,充分排尽盒内空气,缺氧缺糖以模拟缺血。放入培养箱中培养16 h后从密闭盒中取出,更换为正常培养基,恢复氧和糖的供应以模拟再灌注培养3 h。将细胞分为正常组、模型组和梓醇高、中、低剂量组。梓醇高、中、低剂量组分别加入相应浓度药物(终浓度分别为100、20、10 μmol/mL)预先培养过夜(约8 h),造模更换培养基时加入相应浓度药物,造模后取窦房结细胞实验。
1.6 细胞活力测定
将细胞接种于96孔板中,分组、造模后,弃培养基,相应检测孔内加入MTT工作液100 μL,于培养箱内孵育3 h,取出,吸除MTT工作液,加入DMSO 100 μL,摇匀,待颜色变化,于酶标仪波长570 mm处检测。
1.7 细胞凋亡测定
调整待测细胞浓度为5×105~1×106个/mL。造模后,将细胞消化移至离心管内,4 ℃、1500 r/min离心5 min,弃上清。加入1 mL预冷的PBS,轻轻震荡使细胞悬浮,同上法离心,弃上清,重复3~4次,加入200 μL Binding Buffer,轻轻震荡,使细胞悬浮。加入10 μL Annexin V-FITC,轻轻摇匀,避光,室温反应15 min,加入5 μL碘化丙啶,上机检测。
1.8 细胞骨架β-微管蛋白形态观察
14 mm盖玻片放入24孔板中进行细胞爬片,细胞贴壁后,选取生长良好细胞进行实验。吸除培养基,PBS清洗2次,4%多聚甲醛固定10 min;吸除多聚甲醛,加入0.02%Triton,37 ℃培养箱内静置15 min打孔。PBS清洗3次,每孔加入相应一抗(1∶500 PBS溶液)100 μL,放入湿盒内,4 ℃冰箱孵育过夜;PBS清洗2次,加入二抗(1∶200 PBS溶液)常温孵育1 h,甘油封片后上机检测。取得图像后,采用Image-Pro Plus 6.0进行平均荧光强度分析。
1.9 统计学方法
采用SPSS13.0统计软件进行分析。实验数据以—x±s表示,组间资料采用完全随机方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 梓醇对窦房结细胞活力的影响
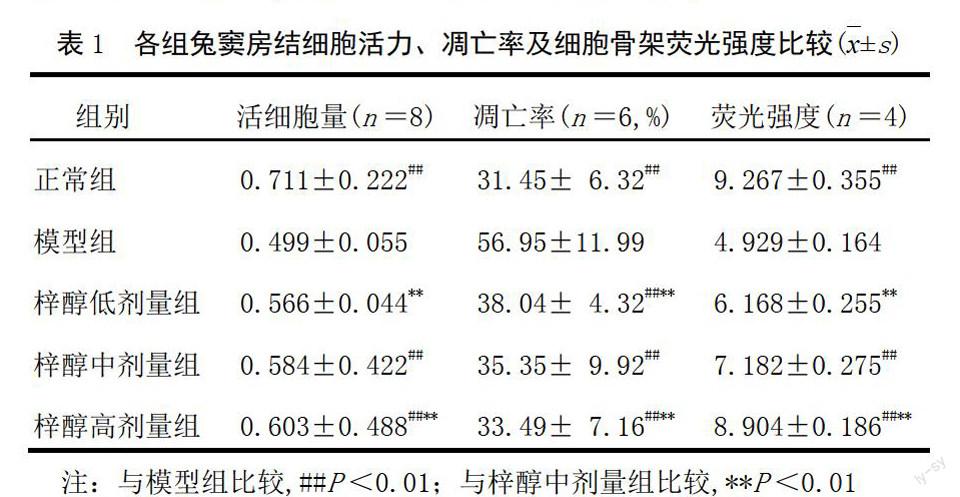
MTT比色检测结果显示,模型组活细胞量低于正常组(P<0.01),表明造模方法可行。梓醇高、中剂量组活细胞量高于模型组(P<0.01),且呈量效关系。结果见表1。
2.2 梓醇对窦房结细胞凋亡的影响
模型组细胞凋亡率明显高于正常组(P<0.01);梓醇高、中、低剂量组细胞凋亡率明显低于模型组(P<0.01),且呈量效关系,见表1。流式细胞图结果见图1。
2.3 梓醇对窦房结细胞骨架蛋白的影响
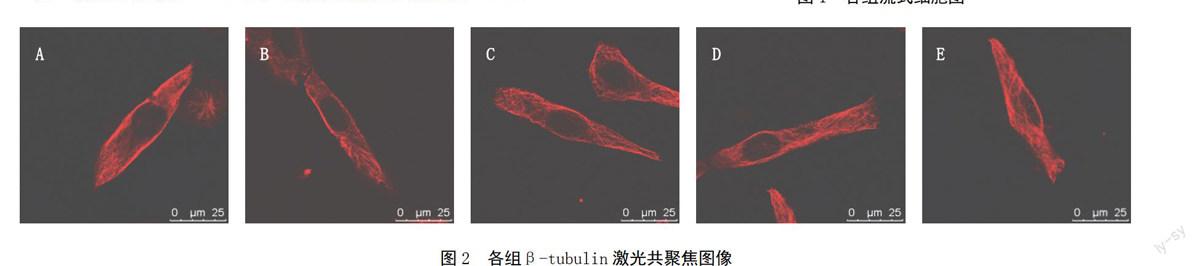
模型组平均荧光强度明显低于正常组(P<0.01);梓醇高、中剂量组平均荧光强度高于模型组(P<0.01),梓醇低剂量组平均荧光强度与模型组比较无明显差异,见表1。镜下观察结果显示,正常组细胞内细胞骨架染色清晰,骨架完整,分布均匀,线条清晰,基本充满细胞质;模型组窦房结细胞骨架排列紊乱,数量减少;梓醇高剂量组细胞骨架较模型组数量明显增多,排列有序;梓醇中剂量组细胞骨架尚完整,但数量较正常组有所减少;梓醇低剂量组细胞骨架形态与模型组比较无明显差异。结果见图2。
注:A.正常组;B.模型组;C.梓醇高剂量组;
D.梓醇中剂量组;E.梓醇低剂量组(下同)
3 讨论
细胞凋亡在心脏传导系统的发育成熟中具有重要作用,窦房结、房室结与传导阻滞细胞的胚胎发育及出生后数周的发育过程中均有细胞凋亡发生,在窦房结的发育、成熟过程中,凋亡不足可留下引发心率失常的基础,凋亡过度可引起病窦等病变[6]。1993年,Engler等首次从形态学和生物化学方面证实,缺血再灌注心肌中存有凋亡细胞[7]。近年来,随着方法学的进步和凋亡研究的深入,已发现心肌缺血再灌注损伤与细胞凋亡之间有着密切的关系,并且在心脏的生理、病理发展过程中起重要作用,被认为是心脏由代偿性变化向病理性变化发展的细胞学基础[8]。细胞凋亡是心肌缺血再灌注损伤的主要形式,抑制细胞过度凋亡则有防止缺血再灌注损伤的作用[9]。可见,缺血再灌注所致的窦房结细胞凋亡是病窦的发病机制之一。
心肌骨架系统破坏是缺血再灌注损伤主要的发生机制之一[10],有研究表明,人心肌细胞缺血10 min,微管即发生排列紊乱[11]。微管是细胞骨架系统中的主要成分之一,是由微管蛋白组成的长管状细胞器结构,β-tubulin是主要的微管蛋白之一。微管由13条原纤维组成,形成相对稳定的结构,多数微管纤维处于动态的组装和去组装状态,通过此过程以实现其功能。微管形成细胞内网状支架,维持细胞形状,支持与固定细胞器的位置,同时,微管与细胞运动和细胞器位移有关[12];另外,微管还通过调控细胞膜上L-钙电流,参与细胞的电生理活动[13-15]。缺血再灌注可导致微管破坏,损伤胞质中网状结构,导致细胞膜脆性增加、失去支持,同时胞质中亚单位线粒体因失去骨架固定与支持发生移位,从而加速细胞损伤。可见,缺血再灌注可导致细胞骨架破坏,从而影响细胞形态和功能。
本实验MTT检测结果显示,模型组与正常组存活细胞量有明显差异,表明造模方法可行;梓醇高、中、低剂量组存活细胞量明显高于模型组,表明药物浓度选取有效可行。流式细胞检测结果显示,模型组细胞大量凋亡,表明缺血再灌注是导致窦房结细胞凋亡的可能原因。梓醇高、中剂量组细胞凋亡率明显低于模型组,显示梓醇对抗细胞凋亡是地黄等药物治疗病窦的可能机制之一。
显微镜观察显示,正常组细胞内β-tubulin排列较整齐,且分布均匀,线条较清晰,基本充满细胞质;模型组β-tubulin数量较正常组明显减少,表明缺血再灌注使β-tubulin裂解损伤。β-tubulin的破坏能损伤胞质中网状结构,使细胞膜脆性增加、失去支持;同时,胞质中亚单位线粒体因失去骨架支持和固定发生移位,细胞膜上L-钙电流调控出现紊乱,从而使窦房结细胞在电生理功能及形态结构方面发生病理改变。而梓醇高、中、低剂量组β-tubulin都有不同程度增加。
综上,梓醇保护细胞骨架β-tubulin是地黄等中药治疗病窦的可能机制之一。
参考文献:
[1] 刘金凤,汪艳丽,徐利亚,等.益气通阳方治疗病态窦房结综合征临床观察[J].中国中医药信息杂志,2014,21(4):10-12.
[2] Wang Z, Liu Q, Zhang R, et al. Catalpol ameliorates beta amlyloid induced degeneration of cholinergic neurons by elevating brain derived neurotrophic factors[J]. Neuroscience,2009,163:1363- 1372.
[3] Bi J, Jiang B, Liu JH, et al. Protective effects of catalpol against H2O2 induced oxidative stress in astrocytes primary cultures[J]. Neuroscience Letters,2008,442:224-227.
[4] Zhang A, Hao S, Bi J, et al. Effects of catalpol on mitochondrial function and working memory in mice after lipopolysaccharide- induced acute systemic inflammation[J]. Exp Toxicol Pathol,2009, 61(5):461-469.
[5] 刘如秀,刘宇,汪艳丽,等.乳兔窦房结细胞的分离及鉴定[J].中国循证心血管医学杂志,2013,5(2):194-195.
[6] James TN. Apoptosis in congenital heart disease[J]. Coron Artery Dis,1997,8(10):599-616.
[7] Engler RL, Gottlieb AR, Burlesin KO, et al. Myocyte cell death by apoptosis during repefusion[J]. Circulation,1993,88(SuppⅡ):1-5.
[8] Li Z, Bing OH, Long X, et al. Increased cardiomyocyte apoptosis during the transition to heart failure in the spontaneously hypertensive rat[J]. Am J Physiol,1997,272:2313-2319.
[9] Kaistura J, Cheng W, Reiss K, et al. Apoptotic and necrotic myocyte cell deaths are independent contributing variables of infract size in rats[J]. Lab Invest,1996,74:86-107.
[10] Iwai K, Hori M, Kitabatake A, et al. Disruption of microtubules as an early sign of irreversible ischemic injury. Immunohistochemical study of in situ canine hearts[J]. Circ Res,1990,67(3):694.
[11] Hein S, Scheffold T, Schaper J. Ischemia induces early changes to cytoskeletal and contractile proteins in diseased human myocardium[J]. J Thorac Cardiovasc Surg,1995,110(l):89-98.
[12] Ohtani K, Sakamoto H, Rutherford T, et al. Ezrin, a membrane-cytoskeletal linking protein, is involved in the process of invasion of endometrial cancer cells[J]. Cancer Lett,1999, 147:31-38.
[13] Galli A, DeFelice LJ. Inactivation of L-type Ca channels in embryonic chick ventricle cells:dependence on the cytoskeletal agents colchicine and taxol[J]. Biophys J,1994,67(6):2296-2304.
[14] Gómez AM, Kerfant BG, Vassort G. Microtubule disruption modulates Ca2+ signaling in rat cardiac myocytes[J]. Circ Res, 2000,86(1):30-36.
[15] Ganote CE, Vander Heide RS. Cytoskeletal lesions in anoxic myocardial injury. A conventional and high voltage electron micmscopic and immunonuorescence study[J]. Am J Patllol,1987, 129:327-344.
(收稿日期:2015-01-13)
(修回日期:2015-01-29;编辑:华强)
